轉基因玉米雙抗12-5熒光RPA現場可視化檢測方法的建立
陳欲,陳笑蕓,彭城,徐俊鋒,沈潔,李玥瑩,汪小福
技術與方法
轉基因玉米雙抗12-5熒光RPA現場可視化檢測方法的建立
陳欲1,2,陳笑蕓1,彭城1,徐俊鋒1,沈潔3,李玥瑩2,汪小福1
1. 浙江省農業科學院,農產品質量安全危害因子與風險防控國家重點實驗室,杭州 310021 2. 沈陽師范大學生命科學學院,沈陽 110034 3. 寧夏醫科大學臨床醫學院,銀川 750004
轉基因玉米雙抗12-5具有良好的抗蟲性和除草劑耐受性,是我國第一批獲得安全證書的轉基因玉米之一,具有廣闊的應用前景。本研究利用重組酶聚合酶擴增技術(recombinase polymerase amplification, RPA)建立轉基因玉米雙抗12-5的現場快速檢測方法。針對轉基因玉米雙抗12-5的轉化體特異性序列片段,設計引物和探針,通過引物篩選實驗得到最佳引物與探針組合。熒光RPA擴增結果可以在藍光下直接進行可視化分析。結果表明,建立的轉基因玉米雙抗12-5可視化檢測體系特異性強,檢測靈敏度達到10拷貝。進一步研究發現RPA的擴增體系對溫度有很強的適應性,樣品在34℃~46℃之間都能得到擴增,據此,本研究利用市面上常見的自發熱暖貼代替常規的加熱儀器來激發RPA。結果表明,自發熱暖貼滿足RPA擴增體系對溫度的需要。最終,本研究將自發熱暖貼加熱法與RPA可視化檢測體系結合,對轉基因玉米雙抗12-5進行現場檢測,并與qPCR方法檢測結果作比較,檢測結果表明,本研究建立的現場可視化檢測方法與qPCR方法檢測結果一致,并且可視化檢測方法時間短,檢測結果清晰易分辨。本研究建立的轉基因玉米雙抗12-5現場快速可視化檢測方法,其特異性強、靈敏度高、方便、快捷,不僅滿足了轉基因玉米雙抗12-5的現場快速檢測的需要,也為其他現場快速檢測方法的開發提供了新思路。
轉基因玉米;RPA;可視化檢測;現場檢測
玉米是全球三大糧食作物之一[1],具有很高的營養價值和良好的耐旱、耐寒、耐貧瘠性,是用途最為廣泛的糧食作物[2],對糧食安全和保障農業產業結構穩定具有重要作用[3]。隨著轉基因技術的發展和滿足糧食安全保障的需要,自1990年起,世界各國開始廣泛種植轉基因作物[4]。轉基因玉米是全球種植面積第二大的轉基因作物,2019年種植面積達到了6090萬公頃,占全球玉米種植面積的31%。轉基因玉米的種植為糧食安全、環境保護等方面起到了積極的作用。
我國對于糧食的需求隨著人口的增長而遞增,玉米作為我國主要的糧食作物和加工原料,其市場需求更大[5]。自2010年以來,我國轉變為玉米凈進口國,目前我國批準進口的轉基因玉米轉化體有20多種,為保證我國的糧食安全,國內也在進行轉基因玉米的研發。2019年12月我國自主研發的兩個玉米轉化體首次獲得安全證書[6],其中轉基因玉米雙抗12-5是由浙江大學研發,擁有我國自主產權的轉基因玉米品系。該品系中導入了兩個基因表達框,分別是pUbi-Cry1Ab/Cry2Aj-T(PEPC)和p(35S/Ubi)- EPSPS-T(35S),融合基因由玉米泛素啟動子和PEPC終止子調控,而(5-enolpyruvylshikimate- 3-phosphate synthase gene)基因由CaMV35S和玉米泛素啟動子組成的復合啟動子及35S終止子調控。由于基因具有除草劑耐受性,可以作為篩選標記基因,后期可以用草甘膦進行陽性植株的篩選。該轉基因玉米表現出良好的抗蟲性和除草劑耐受性,具有廣闊的應用前景[3,6],今后可能會商業化大范圍種植。為了對其進行更好的監控和管理,迫切需要建立現場快速檢測方法。
目前轉基因作物的檢測主要有基于蛋白質和基于核酸兩種方法。基于蛋白質的檢測方法多需要制備抗體,其周期長、成本高,而且只能檢測外源蛋白,檢測靶標有限;另一方面,基于蛋白質的檢測方法,只能檢測作物的新鮮樣品或初加工樣品,對于加工品或深加工品的檢測存在局限性。而基于核酸的檢測方法更加準確、穩定,應用范圍也更加廣泛[7]。在諸多核酸檢測方法中,PCR技術(如普通PCR、qPCR)等是目前國內外已開發的數量最多的一類轉基因檢測方法,結果準確、靈敏度高、特異性強[8],被許多國家作為有關食品法規的標準檢驗方法[9]。但PCR檢測法依賴于精密儀器,且耗時長,限制了其在現場檢測中的使用[10]。
重組酶聚合酶擴增技術(recombinase polymerase amplification, RPA)是一種新型恒溫擴增技術[11],利用重組酶、單鏈結合蛋白、DNA聚合酶在恒溫條件下可實現對核酸的快速、特異性擴增,短時間(5~ 20 min)內即可完成核酸的擴增[12]。擴增條件一般為恒溫39℃,不需要大型儀器,而且RPA對模板的純度要求不高,適合不同樣品的擴增檢測。本研究結合RPA的這些特性,首先篩選出針對轉基因玉米雙抗12-5轉化體特異性檢測的RPA引物對與探針組合,并利用藍光燈照射直接判斷其擴增結果,再結合RPA對擴增溫度的耐受性,利用自發熱暖貼代替儀器加熱,從而建立一種針對轉基因玉米雙抗12-5的現場快速可視化檢測方法。
1 材料與方法
1.1 材料
轉基因玉米雙抗12-5種子,轉基因玉米NK603、BT176、T25和BT11,轉基因大豆A5547-127、356043、GTS40-3-2和FG72,轉基因油菜MS1×RF1、MS2× RF2、MS8×RF3和OXY235,轉基因棉花LLcotton25、MON15985和GHB119的DNA均來自本實驗室。
1.2 DNA提取
按照植物DNA提取試劑盒(杭州新景生物試劑開發有限公司)說明書提取各樣品的基因組DNA,所提取的DNA用核酸蛋白測定儀NanoDrop2000C (美國Thermo公司)進行核酸質量分析,并置于–20℃貯存備用。
1.3 熒光RPA
參照RPA (熒光型)試劑盒(濰坊安普未來生物科技有限公司)說明書進行體系配置,熒光RPA反應體系為50 μL:Buffer A 12.5 μL,10 μmol/L正、反向引物各2 μL,10 μmol/L探針0.6 μL,模板DNA 2 μL,加ddH2O補齊到47.5 μL,充分混勻后加入Buffer B 2.5 μL,再次混勻。熒光RPA反應條件:39℃擴增20 min。熒光RPA的實時熒光信號用熒光定量PCR儀CFX96 (美國伯樂公司)觀察,熒光RPA的可視化結果用手持藍光燈(LUYOR-3415RG,路陽儀器)照射并在黃色濾鏡下拍照觀察。
1.4 引物與探針設計
熒光RPA體系包括2條引物和1條探針,轉基因玉米雙抗12-5的載體示意圖及擴增的轉化體特異性序列信息見圖1A。利用Vector NTI軟件在外源插入位點的左側即轉基因玉米基因組序列設計上游引物8條,在外源插入位點的右側即外源插入片段序列設計下游引物8條。所設計的上、下游引物分別處于外源插入位點的兩側,以保證對轉基因玉米雙抗12-5的特異性擴增。引物長度30~35 bp,GC含量占30%~70%[13]。所設計探針包含玉米基因組和外源片段的序列,長度46~52 bp,并避免回文序列、內部二級結構和連續重復堿基。探針共有4個修飾位點,在探針中間部位,用一個四氫呋喃(THF)堿基類似物代替第31個堿基G,作為核酸外切酶的識別位點;在THF位點的上游,第30個堿基T處標記一個熒光基團6-羧基熒光素(FAM:6-carboxy- fluorescein),在THF位點的下游,第33個堿基T處標記一個黑洞淬滅基團(BHQ:black hole quencher),兩基團的間距為1~5 bp;THF位點距離3?末端至少15 bp長度,并在探針3?末端標記一個封閉基團。只有當探針與序列成功配對時,THF位點才會被外切酶切割,使熒光基團與淬滅基團分離,從而產生熒光信號(圖1B)。
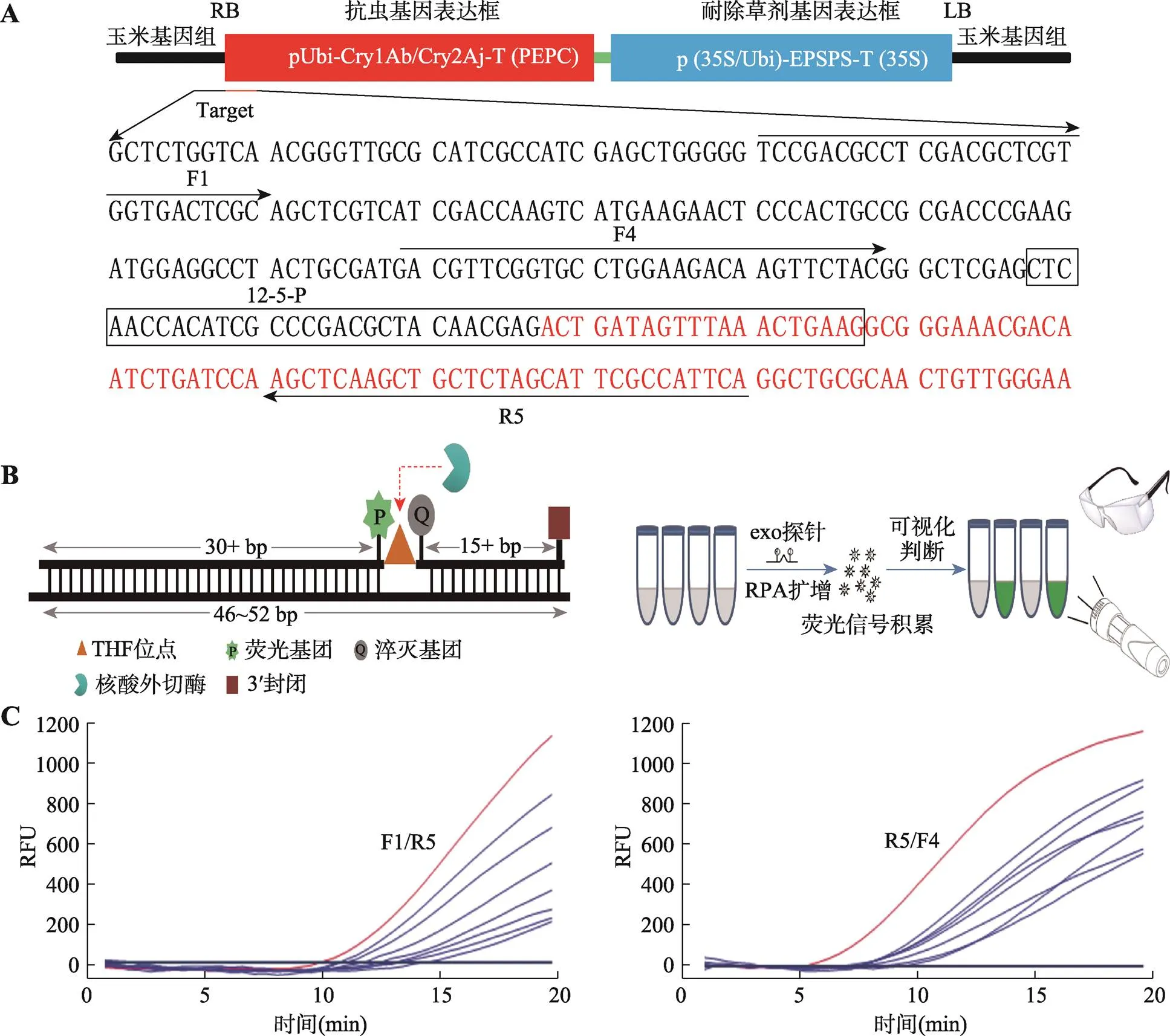
圖1 熒光RPA引物和探針的設計與篩選
A:轉基因玉米12-5載體示意圖及擴增的特異性序列。黑色字母為玉米基因組序列;紅色字母為外源插入片段序列;帶箭頭的橫線為引物F1、F4以及R5所在位置;黑色框內為探針所在位置。B:探針設計原理與可視化檢測示意圖。C:引物篩查擴增結果。左圖為上游引物F1與所有下游引物擴增結果,右圖為下游引物R5與所有上游引物擴增結果。RFU:相對熒光強度。
轉基因玉米雙抗12-5的普通PCR引物和qPCR引物引用國家標準[14],本研究所用的引物和探針配制為10 μmol/L。所有引物和探針均由生工生物工程(上海)股份有限公司合成,引物和探針信息見表1。
1.5 引物篩查
用上游引物F1分別與所有下游引物組合,結合探針,對轉基因玉米雙抗12-5進行實時熒光RPA檢測實驗,分析結果,選出其中擴增效率最高的下游引物,再用這條下游引物分別與所有上游引物組合,結合探針,對轉基因玉米雙抗12-5進行實時熒光RPA檢測實驗,選擇擴增效率最高的一組,作為最終的檢測引物組合。
1.6 普通PCR與qPCR
普通PCR體系25 μL:10×PCR buffer 2.5 μL,dNTPs 0.2 mmol/L,上、下游引物各0.2 μmol/L,r酶0.025 U/μL。使用德國Biometra公司TgradientPCR儀進行擴增。普通PCR擴增程序:98℃預變性2 min;98℃變性30 s,55℃退火30 s,72℃延伸1 min,35個循環;72℃延伸2 min,4℃保存。配制2%的瓊脂糖凝膠,GelRed染色,對擴增產物進行電泳檢測,凝膠成像儀上觀察與拍照。凝膠電泳系統為美國GE公司的EPS301;紫外凝膠成像分析儀購自美國伯樂公司。
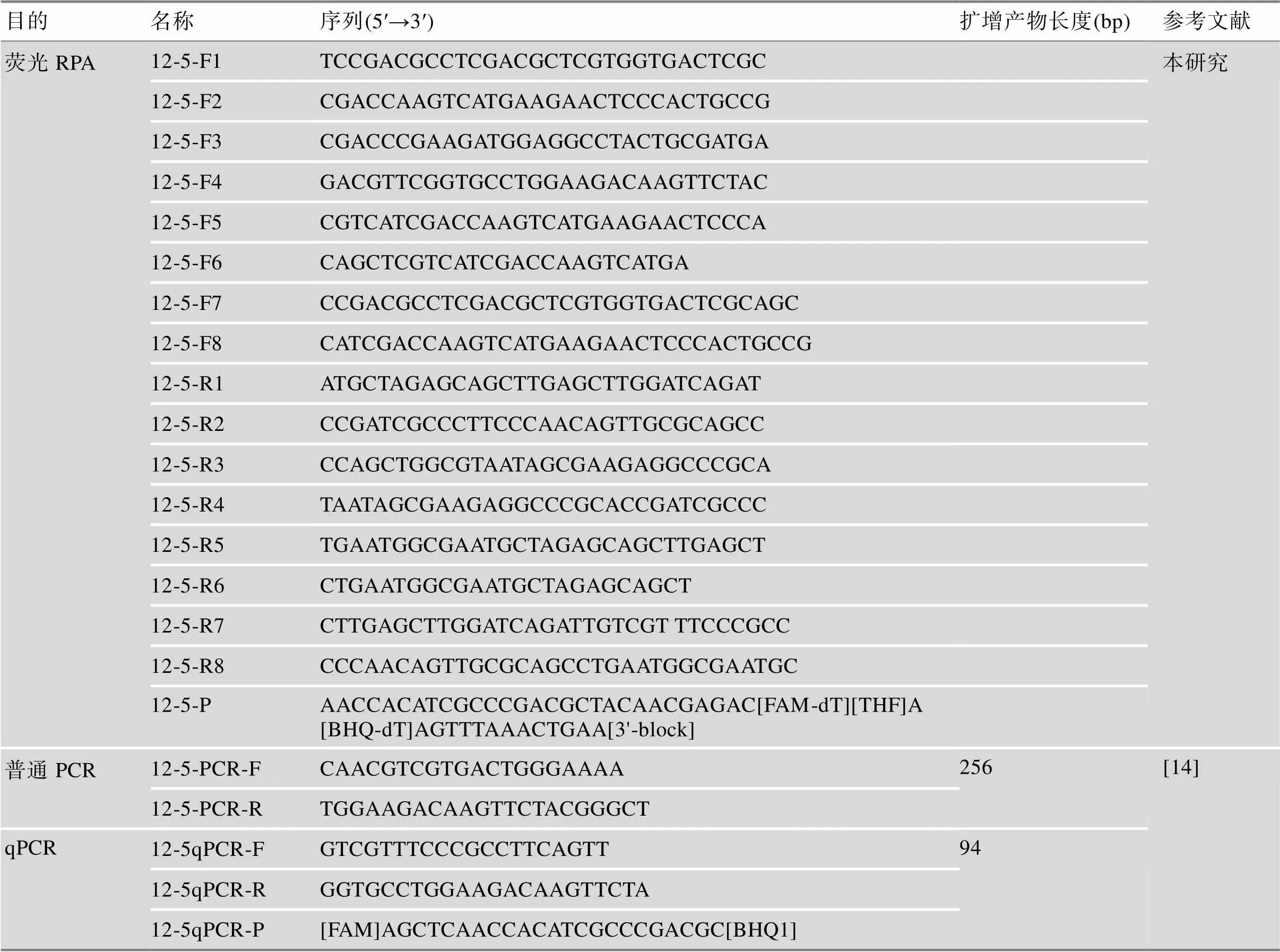
表1 本文所用引物與探針序列
qPCR體系25 μL:2×qPCR Master Mix 12.5 μL,上、下游引物各0.4 μmol/L,探針0.2 μmol/L。qPCR擴增程序:95℃預變性5 min;95℃變性15 s,58℃退火1 min,40個循環。熒光定量PCR儀為美國伯樂公司的CFX96,反應結束使用Bio-Rad CFX Manager 3.1進行數據分析。
1.7 熒光RPA特異性實驗
用篩選出的最佳引物對,根據上述熒光RPA擴增體系,以轉基因玉米12-5 DNA作為陽性對照,以轉基因玉米NK603、BT176、T25、BT11,轉基因大豆A5547-127、356043、GTS40-3-2、FG72,轉基因油菜MS1×RF1、MS2×RF2、MS8×RF3、OXY235以及轉基因棉花LLcotton25、MON15985、GHB119樣品DNA作為其他作物模板進行檢測,以評價所建立的熒光RPA檢測方法的特異性。
1.8 靈敏度實驗
核酸蛋白測定儀測定所提取轉基因玉米雙抗12-5的DNA濃度,計算拷貝數,并稀釋提取的DNA至640拷貝/μL,再2倍系列稀釋,分別得到320、160、80、40、20、10、5拷貝/μL共7個濃度。以上述8個濃度DNA為模板,以無菌水作為陰性對照,進行實時熒光RPA檢測,同時可視化觀察結果,并用qPCR檢測法和普通PCR檢測法對上述8個濃度轉基因玉米雙抗12-5的DNA進行檢測,以評估比較所建立熒光RPA方法的靈敏度。
1.9 熒光RPA溫度適應性及暖貼加熱法可行性分析
為探究熒光RPA可視化檢測法的溫度適應性范圍,本研究共設12個擴增溫度,分別是26℃、28℃、30℃、32℃、34℃、36℃、38℃、40℃、42℃、44℃、46℃和48℃。根據上述熒光RPA擴增體系,進行熒光RPA擴增實驗,擴增結束后可視化觀察分析結果。為優化熒光RPA現場擴增方式,本研究嘗試用市面上一種可以自發熱的暖貼對樣品進行加熱,對暖貼自發熱后50 min內的溫度進行測定,分析溫度隨時間的變化情況,初步判定該嘗試是否可行;并使用暖貼加熱法和加熱塊39℃加熱法分別對轉基因玉米雙抗12-5和非轉基因玉米進行熒光RPA擴增實驗,可視化觀察結果并使用多標記微孔板系統Cytation5 (美國伯騰公司)測定熒光值大小,進一步評價暖貼加熱法的可行性。
1.10 實際檢測
為實現高通量的現場檢測,本研究嘗試用96孔板完成現場可視化擴增和檢測。用上述建立的轉基因玉米雙抗12-5可視化熒光RPA檢測體系,結合暖貼加熱法,對96個實際樣品進行檢測,并同時使用qPCR檢測法對上述96個實際樣品進行檢測。通過分析和對比兩種檢測方法所得結果,判斷本研究建立的轉基因玉米12-5熒光RPA現場檢測方法是否可行。本研究模擬實際樣品檢測時,對96個樣品只進行了一次檢測,其他實驗如沒有特別說明,都是3次重復,每次3個平行。
2 結果與分析
2.1 熒光RPA引物篩選結果
引物篩選過程見圖1C。圖1C中左圖為上游引物F1與所有下游引物組合結合探針,對轉基因玉米雙抗12-5進行實時熒光RPA擴增的結果,可以看到上游引物F1與下游引物R5組合擴增效率最高,10 min開始出現熒光信號,熒光信號曲線起峰時間最早,且最終熒光值達到最高,為1200左右,其他引物組合最終達到熒光值最高僅800,說明下游引物中,R5的擴增能力最強。圖1C中右圖為下游引物R5與所有上游引物組合結合探針,對轉基因玉米雙抗12-5進行實時熒光RPA檢測的結果,可以看到下游引物R5與上游引物F4組合的擴增效率最高,5 min開始起峰,且最終熒光值最高,為1200左右,而其他引物組合最早8 min開始起峰,最終達到熒光值也未超過1000,說明上游引物中,F4的擴增能力最強。最終選定上游引物F4與下游引物R5組合,作為最終建立熒光RPA檢測轉基因玉米雙抗12-5的引物。
2.2 熒光RPA特異性檢驗
實時熒光RPA特異性檢測結果見圖2A,僅樣品為轉基因玉米雙抗12-5時出現擴增曲線,其他樣品均無擴增曲線產生,表明轉基因玉米雙抗12-5實時熒光RPA檢測方法特異性良好。可視化觀察熒光RPA擴增結果見圖2B,可以明顯看到僅轉基因玉米雙抗12-5樣品所在離心管有綠色熒光,明亮且可辨識度強。其他管內均未見綠色熒光,可視化觀察的特異性實驗結果與實時熒光結果一致,表明轉基因玉米雙抗12-5可視化熒光RPA檢測方法特異性良好。
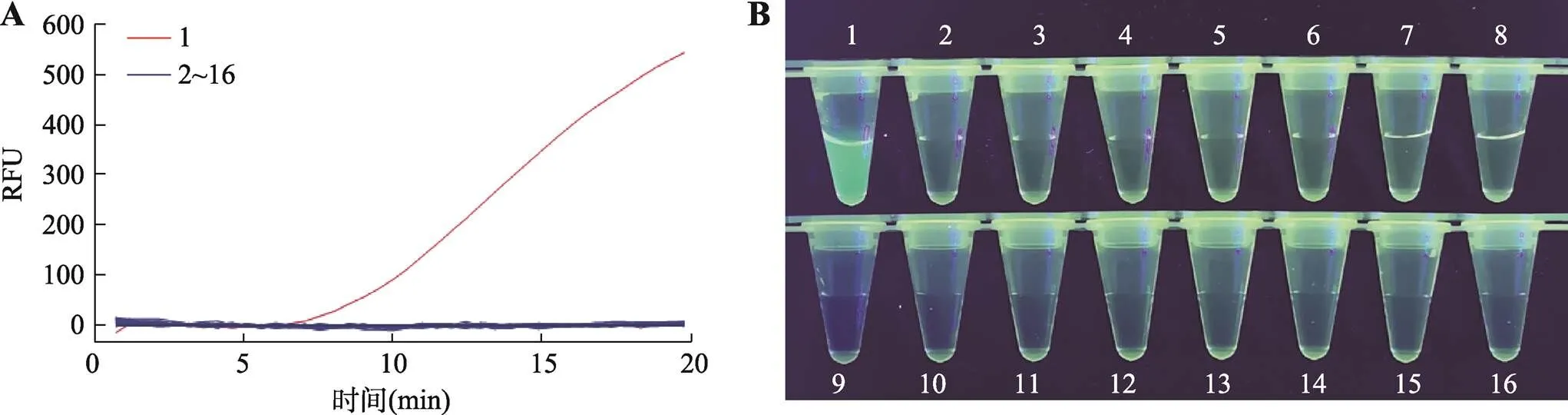
圖2 熒光RPA特異性檢測
A:實時熒光RPA檢測。RFU:相對熒光強度。B:可視化熒光RPA檢測。1:轉基因玉米雙抗12-5;2~16:轉基因玉米NK603、BT176、T25、BT11,轉基因大豆A5547-127、356043、GTS40-3-2、FG72,轉基因油菜MS1×RF1、MS2×RF2、MS8×RF3、OXY235,轉基因棉花LLcotton25、MON15985、GHB119。
2.3 靈敏度實驗
靈敏度檢測結果見圖3。實時熒光RPA靈敏度實驗結果見圖3A,結果顯示隨模板拷貝數降低,擴增曲線的起峰時間逐漸推遲,達到的最終熒光強度隨之減弱,模板為1280拷貝數時,5 min開始出現擴增,最終熒光信號達2000。模板為10拷貝數時,13 min開始出現擴增,雖然最終產生的熒光信號較弱,但可以與陰性對照區分開。熒光RPA靈敏度實驗的可視化檢測觀察結果見圖3B:1~4號管拷貝數依次為1280、640、320、160,管內樣品熒光強度用肉眼觀察相差無幾;5~8號管拷貝數依次為80、40、20、10,可以觀察到綠色熒光逐漸減弱;10拷貝數模板擴增結果,熒光最弱,但是肉眼觀察其結果可以與陰性對照區分開,與實時熒光RPA檢測結果一致,說明拷貝數為10時,熒光RPA檢測技術可以準確檢測得到結果。qPCR靈敏度實驗結果見圖3C,隨拷貝數降低,擴增曲線起峰循環數逐漸增加,除1280拷貝數的模板外,最終達到熒光信號強度依次減弱,1280拷貝數的熒光信號強度與20拷貝數的熒光信號強度相差不多,可能是因為高濃度模板內的雜質或者鹽離子對擴增產生影響。圖3D為普通PCR的靈敏度實驗,隨著模板拷貝數降低,條帶亮度逐漸減弱。
2.4 溫度適應性及暖貼加熱法可行性分析
暖貼激發RPA的實驗結果見圖4。在12個溫度下進行熒光RPA擴增可視化觀察,結果顯示在34℃~46℃范圍內均可觀察到熒光,說明可用于可視化熒光RPA擴增實驗的溫度范圍廣,為34℃~46℃。溫度為42℃時,熒光最亮,說明42℃為本可視化熒光RPA檢測法的最適溫度。暖貼自發熱后50 min內對樣品進行加熱,對樣品的溫度進行測定(圖4B)。結果可以看到0~18 min,樣品溫度從室溫24℃逐漸升高到40℃。隨后的18~50 min,樣品溫度保持40℃幾乎不變。樣品溫度從第10 min達到35℃,開始滿足熒光RPA擴增的溫度條件,說明本研究嘗試暖貼加熱方式實現可視化熒光RPA現場檢測的方法或許可行。另外建議提前10 min撕開暖貼包裝用于加熱樣品,保證擴增順利。測定樣品溫度方式見圖4B。
用暖貼加熱法和加熱塊39℃加熱法分別激發轉基因玉米雙抗12-5和非轉基因玉米的熒光RPA,其可視化觀察的結果見圖4C。兩種加熱方式均使樣品得到擴增,產生明顯熒光,且熒光強度無明顯差異,易與陰性結果區分。使用多標記微孔板系統測定暖貼加熱法和加熱塊39℃加熱的發應管中的熒光值的結果見圖4D。可以發現除4號管兩種加熱方法得到熒光值結果基本相同以外,2、6、8號管由暖貼加熱得到的熒光值明顯高于加熱塊39℃加熱得到的熒光值,這或許因為暖貼加熱溫度約為40℃,相較于加熱塊的39℃更接近最適溫度42℃,進一步說明用暖貼替代傳統加熱塊實現便攜式的現場熒光RPA檢測實驗可行。
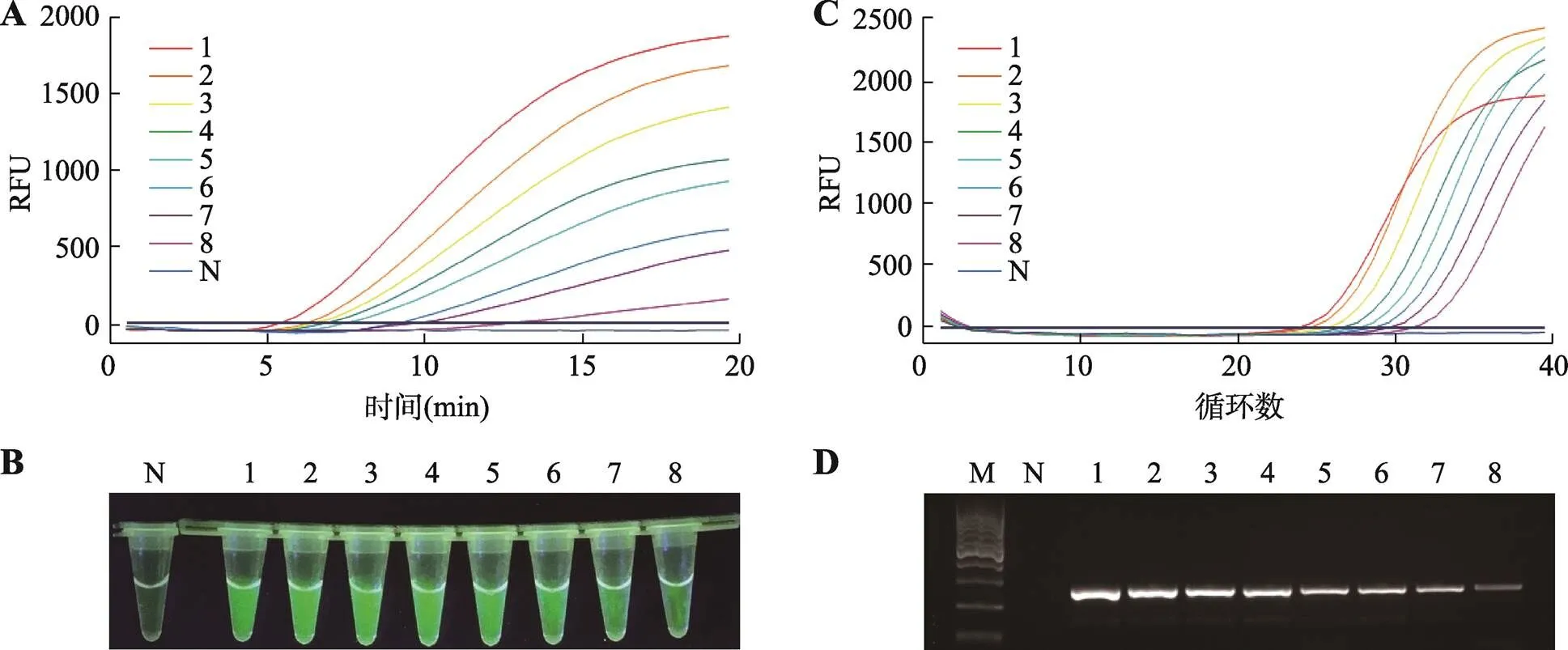
圖3 轉基因作物靈敏度檢測
A:實時熒光RPA;B:可視化熒光RPA;C:qPCR;D:普通PCR。M:Marker;N:陰性對照;1~8:分別是1280、640、320、160、80、40、20、10拷貝。RFU:相對熒光強度。
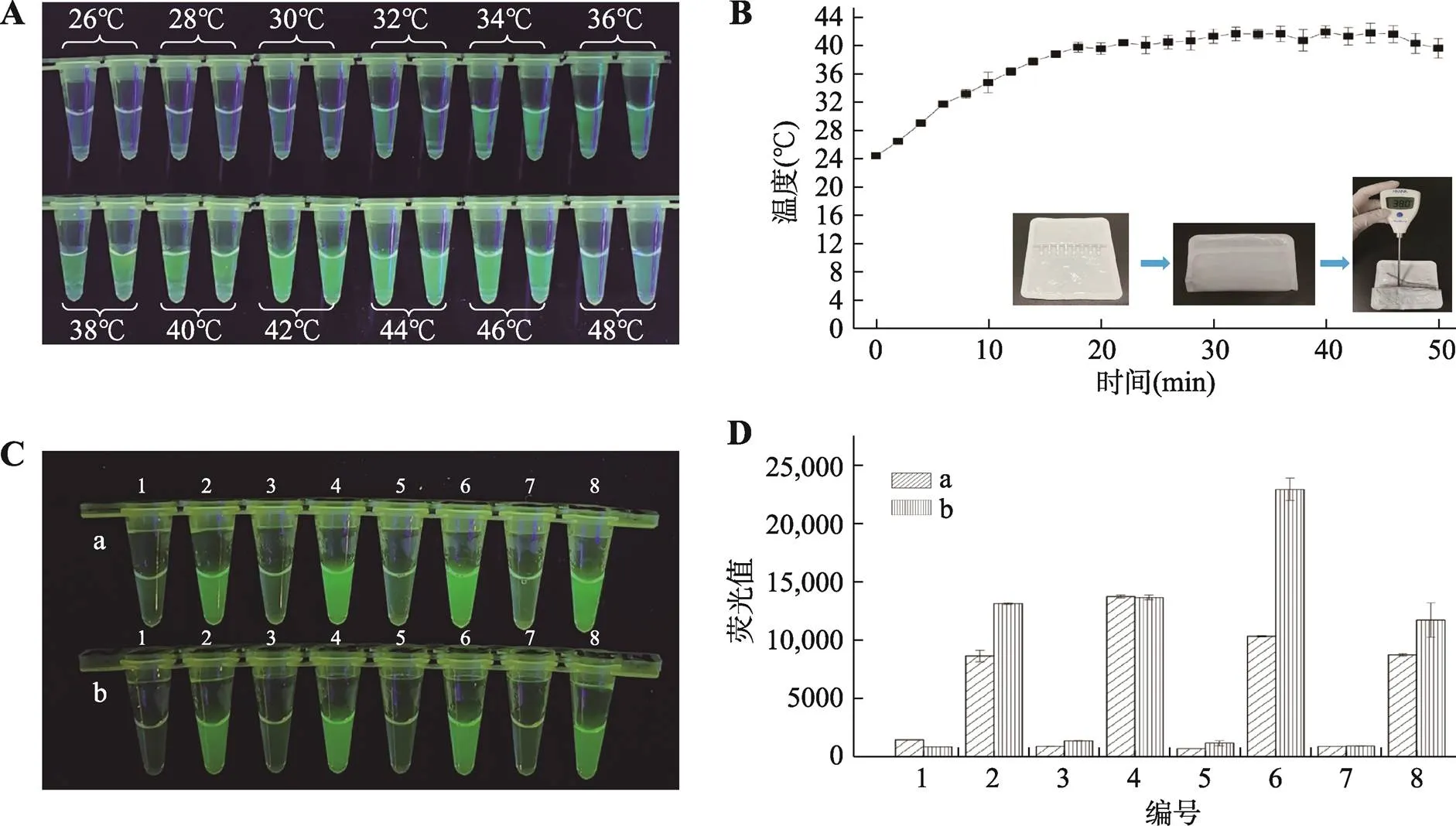
圖4 熒光RPA溫度適應性及暖貼加熱法可行性實驗
A:可視化熒光RPA溫度適應性結果。B:暖貼加熱8連管50 min內管中樣品溫度變化情況。C:兩種加熱方法擴增熒光RPA產物可視化觀察結果。a:加熱塊39℃加熱20 min;b:暖貼加熱20 min;1、3、5、7為陰性對照;2、4、6、8為轉基因玉米12-5。D:兩種加熱方法擴增熒光RPA產物熒光值測定結果。
2.5 實際檢測
用兩片暖貼加熱96孔板內樣品進行熒光RPA擴增示意圖見圖5A,用兩片暖貼分別附在96孔板上、下兩面,簡單方便。圖5B為用所建立的熒光RPA體系實際檢測96個樣品可視化觀察結果,共觀察到24個樣品有熒光產生,且熒光十分明顯。qPCR法檢測上述96個樣品結果見圖5C,共有24條擴增曲線產生。qPCR法檢測結果與熒光RPA可視化檢測結果相同,說明本研究建立的熒光RPA可視化檢測準確。熒光RPA與qPCR檢測結果和檢測所用時間的比較見表2 (表中只顯示轉基因玉米雙抗12-5樣品的陽性結果比對),熒光RPA可視化檢測所用時間均為20 min,qPCR的值在26.82~29.76之間,忽略PCR儀器升降溫時間,qPCR檢測時間范圍為58.64~64.54 min,耗時遠高于熒光RPA。實際檢測結果表明,所建立的可視化熒光RPA檢測方法快速、準確、易分辨。
3 討論
近年來,RPA技術得到迅速的發展,與傳統PCR相比,RPA技術無需昂貴的PCR儀,可以短時間內對靶片段進行快速擴增,具有簡便、靈敏、快速等優點,適用于現場檢測,目前已在病毒[15,16]、細菌[17]等臨床檢測中得到了廣泛應用。
引物是影響擴增效率的關鍵因素,引物過長可能容易產生引物二聚體或發夾結構,而過短會降低重組率和檢測靈敏度。RPA引物一般在30~35 bp[13],目前沒有專門針對RPA的引物設計軟件,為了獲得更加高效的引物組合,本研究根據RPA引物設計原理,設計上、下游引物各8條,先用任意一條上游引物與所有下游引物組合結合探針,對樣品進行擴增,觀察結果篩選出擴增效率最高的下游引物,再用篩選出的下游引物與所有上游引物組合結合探針,對樣品進行擴增,觀察篩選出擴增效率最高的上游引物。采取這種方法,僅兩次就可以篩選出其中擴增效率最高的引物對。
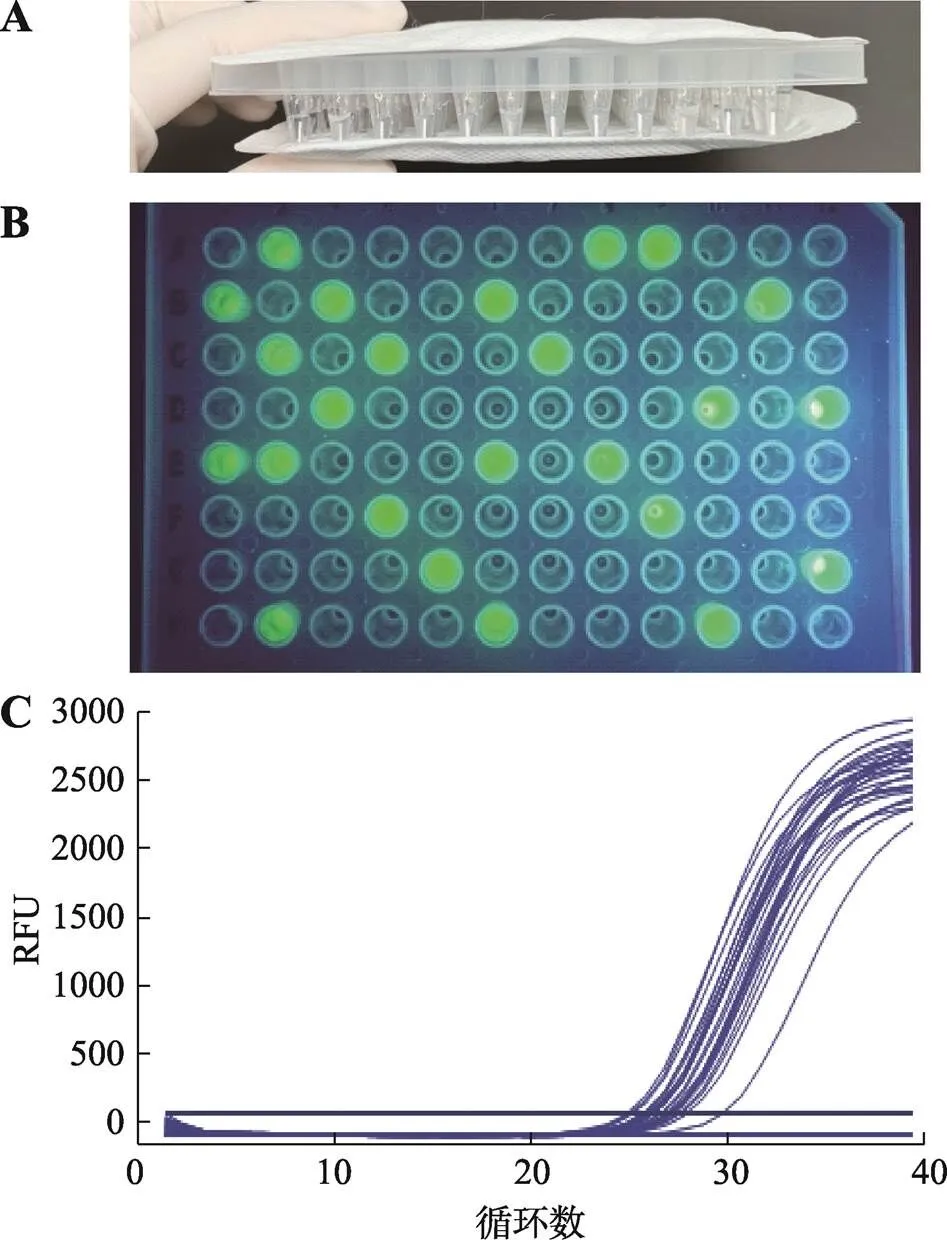
圖5 實際檢測結果
A:暖貼加熱96孔板方式;B:熒光RPA實際檢測可視化觀察結果;C:qPCR檢測結果。RFU:相對熒光強度。
目前根據RPA建立的現場檢測方法多是基于RPA與側向流動免疫技術結合或與熒光檢測技術結合的檢測方法。其中RPA與側向流動免疫技術結合的檢測方法操作簡便、肉眼可觀察結果、無需特殊檢測設備,但檢測時需要開蓋,存在氣溶膠污染的風險,且相應標記抗體試紙條的制備,也增加了檢測成本。基于RPA與熒光檢測技術結合的檢測方法,多為實時熒光RPA,近年來許多商用便攜式實時熒光RPA檢測設備問世,為實時熒光RPA現場檢測技術的推廣提供了設備支持,但同時也增加了檢測的成本投入。本研究通過RPA在不同溫度下的擴增反應,發現RPA的熒光可視化檢測具有很寬的溫度適應性(34℃~46℃)。據此,本研究利用市場上很普通的暖貼作為熱源替代儀器加熱,暖貼成本可忽略不計,而且其便于保存,方便攜帶。在檢測結果判別方面,檢測人員利用小型手持藍光燈,佩戴護目鏡即可完成現場的可視化檢測。目前,蛋白質試紙條是轉基因成分現場檢測最常用的方法,蛋白質試紙條市場價格大概在10~20元/條,而RPA目前一個反應的費用大概在15~30元。但隨著RPA技術的推廣和應用,其檢測費用會得到進一步的減少。
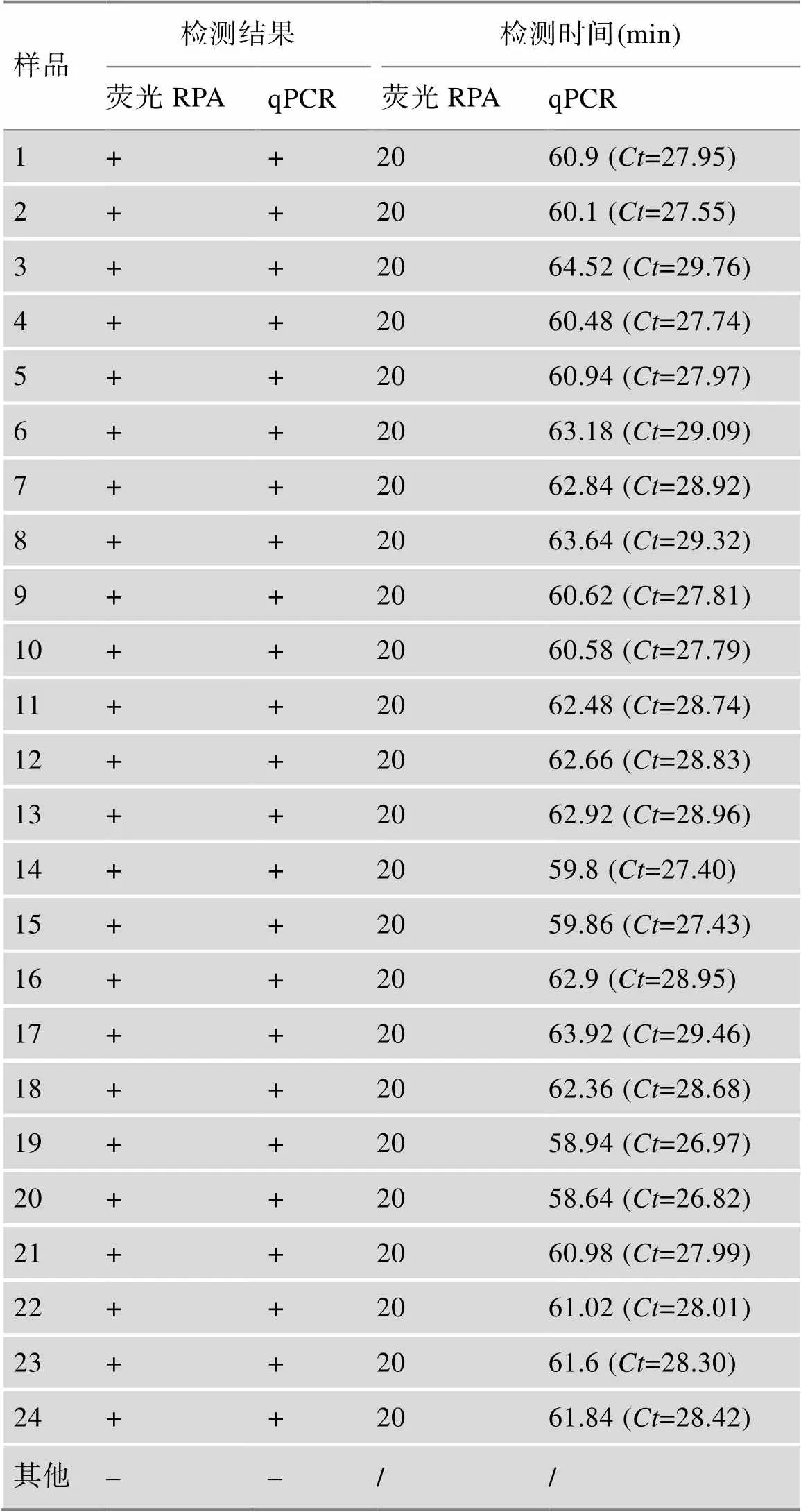
表2 熒光RPA和RT-PCR對實際樣品的檢測
[1] Wu WY, Liu XX, Zhou MY, Liu JX, Liu YY. Establishment of event-specific PCR detection method of transgenic maize line 2A-5., 2020, 10(04): 363–370.
武文艷, 劉新香, 周秒依, 劉金香, 劉亞. 轉基因玉米2A-5特異性PCR方法的建立. 生物技術進展, 2020, 10(04): 363–370.
[2] Wang J, Wu FC, Liu XY, Feng SD, Song XY. Evaluation of transgenic maize ‘Shuangkang 12-5’ with complex traits of insect-resistance and glyphosate-resistance for the resistance toand tolerance to glyphosate., 2016, 42(1): 45–50.
王江, 武奉慈, 劉新穎, 馮樹丹, 宋新元. 轉基因抗蟲耐除草劑復合性狀玉米‘雙抗12-5’對亞洲玉米螟的抗性及對草甘膦的耐受性研究. 植物保護, 2016, 42(1): 45–50.
[3] Wang R. Rapid nucleic acid amplification and visual detection strategiesfor the detection of food-borne pathogen and genetically modified organisms[Dissertation]. Zhejiang University, 2019.
王瑞. 快速核酸擴增及可視化策略用于食源性致病菌和轉基因作物檢測[學位論文].浙江大學, 2019.
[4] Jiang ZB. The significance and way of spreading corn planting technology., 2020, (23): 5.
江真兵. 玉米種植技術推廣的意義及途徑. 新農業, 2020, (23): 5.
[5] Jiao Y, Han Y, Yang Q, Huang YH, An JC, Yang YZ, Ye JM. Commercialization development trend of genetically modified maize and the enlightenment. Biotechnol Bull, 2021, 37(4): 164–176.
焦悅, 韓宇, 楊橋, 黃耀輝, 安吉翠, 楊亞洲, 葉紀明. 全球轉基因玉米商業化發展態勢概述及啟示. 生物技術通報, 2021, 37(4): 164–176.
[6] Wang HQ, Xiao F, Yang L, Miu QM, Zhang XD, Zhang XJ. Analysis of verification results by PCR methods for genetically modified double-resistant 12-5 event-specific maize., 2020, 36(5): 48–55.
王顥潛, 肖芳, 楊蕾, 繆青梅, 張旭冬, 張秀杰. 轉基因玉米雙抗12-5轉化體特異性PCR方法驗證結果分析. 生物技術通報, 2020, 36(5): 48–55.
[7] Yu Y, Liu GQ, Su SL, Luo JX, Guo L. Detection of transgenic components in corn., 2020, 36(4): 836–841.
于園, 劉國強, 蘇圣淋, 羅建興, 郭梁. 玉米轉基因成分的檢測. 江蘇農業學報, 2020, 36(4): 836–841.
[8] Meng LC, Zhou DL, Gao TT, Wang M, Lu Ming. Rapid screening of genetically modified maize based on TaqMan Real-time PCR., 2020, 1–7.
孟令聰, 周德龍, 高婷婷, 王敏, 路明. 基于TaqMan實時熒光PCR技術快速篩查轉基因玉米. 分子植物育種, 2020, 1–7.
[9] Lin FF, Hou HL, Liu J, Wang XL, Deng HC, Zhou XY. Research progress in DNA component detection of transgenic plants., 2016, (11): 19–22.
林馥芬, 侯紅利, 劉晉, 王學林, 鄧漢超, 周向陽. 轉基因植物DNA成分檢測技術研究進展. 中國種業, 2016, (11): 19–22.
[10] Jia X. The application of recombinase polymerase amplification (RPA) technology in detection of transgenic rices[Dissertation]. Chinese Academy of Agricultural Sciences, 2017.
賈玄. RPA等溫擴增技術在轉基因水稻檢測中的應用 [學位論文]. 中國農業科學院, 2017.
[11] OPiepenburg O, Williams CH, Stemple DL, Armes NA. DNA detection using recombination proteins., 2006, 4(7): e204.
[12] Ding X, Liu YH, Ni BX, Wang XT, Xu XZ, Ying QJ, Dai Y, Cao J. Establishment of a nucleic acid assay for detection of Echinococcus granulosus based on recombinase- aided isothermal amplification assay., 2020, 32(4): 340–344.
丁昕, 劉燕紅, 倪碧嫻, 王曉婷, 徐祥珍, 應清界, 戴洋, 曹俊. 基于重組酶介導等溫擴增技術的細粒棘球絳蟲核酸檢測方法的建立. 中國血吸蟲病防治雜志, 2020, 32(4): 340–344.
[13] Lobato IM, O’Sullivan CK. Recombinase polymerase amplification: Basics, applications and recent advances., 2018, 98: 19–35.
[14] Announcement No.2259 of ministry of agriculture-12- 2015, Detection of genetically modified plants and derived products. Qualitative PCR method for insect-resistant and herbicide-tolerant maize Shuangkang 12-5 and its derivates. Beijing: China Agriculture Press, 2015.
農業部2259號公告-12-2015, 轉基因植物及其產品成分檢測. 抗蟲耐除草劑玉米12-5及其衍生品種定性PCR方法. 北京: 中國農業出版社, 2015.
[15] Tan LQ, Zheng XC, Wang CP, Li WS, Qin ZF. Development of real time RT-RPA for rapid detection of rabies virus., 2019, 55(5): 44-47+122.
譚理琦, 鄭曉聰, 王翠萍, 李汶松, 秦智鋒. 狂犬病病毒實時熒光RT-RPA等溫檢測方法的建立. 中國獸醫雜志, 2019, 55(5): 44-47+122.
[16] Zhang QL, Fu CX, Zhang W, Gao XL, Wang L, Cheng MH, Zheng XY, Liu HY, Zhou DG. Establishment and application of real-time fluorescence RT-RPA detection method for canine distemper virus., 2020, 41(11): 19–23.
張啟龍, 傅彩霞, 張瑋, 高曉龍, 王林, 程敏姮, 鄭雪瑩, 劉海瑩, 周德剛. 犬瘟熱病毒實時熒光RT-RPA檢測方法的建立及應用. 動物醫學進展, 2020, 41(11): 19–23.
[17] Wang SH, Yuan SH, Shuai JB, Wang ZC, Cai J, Zhao ZG. Establishment and application of recombinase polymerase amplification assay for detection of., 2020, 42(6): 590–594.
王素華, 袁淑輝, 帥江冰, 王忠才, 蔡軍, 趙治國. 炭疽桿菌RPA等溫檢測方法的建立和應用. 中國預防獸醫學報, 2020, 42(6): 590–594.
Establishment of a field visual detection method for genetically modified maize ‘Shuangkang’12-5 by fluorescence RPA
Yu Chen1,2, Xiaoyun Chen1, Cheng Peng1, Junfeng Xu1, Jie Shen3,Yueying Li2,Xiaofu Wang1
The genetically modified (GM) maize ‘Shuangkang’12-5 has good insect resistance and herbicide tolerance, which is one of the first series of GM maizes obtained a safety certificate in China, and it has broad application prospect in the future. This study established an on-site rapid detection method for GM ‘Shuangkang’12-5 based on recombinase polymerase amplification (RPA) technology, which primes and probe were designed according to the specific flank sequence. Then the best combination of primers and probe was obtained through a screeing process. The amplification results of fluorescence RPA can be directly visualized under blue light. The results showed that the visual detection system of GM ‘Shuangkang’12-5 with high specificity, and the detection sensitivity of the method could reached 10 copies. Further research found that the RPA amplification system had a wide range of temperature (34℃-46℃). According to this property, the common self-heating warm pastes on the market were used replace the traditional heating instruments to stimulate the RPA.The results showed that the self-heating warm paste meets the temperature requirement of the RPA system. Finally, we combined the self-heating warm pastes with the RPA visual detection system to conduct on-site detection of GM ‘Shuangkang’12-5, and compared the results with the detection results of qPCR. The detection showed that the results of on-site visual detection method established in this study were consistent with the detection results of the qPCR. Moreover, the visual detection method was more shorter in time and the final detection result was clear and easy to distinguish. The rapid on-site visual detection method for GM ‘Shuangkang’ 12-5 established in this study has high specificity, high sensitivity and convenience. It not only meets the needs of on-site rapid detection of GM ‘Shuangkang’12-5, but also provides highlight for the development of other on-site rapid detection methods.
genetically modified maize; RPA; visual detection; field detection
2021-03-24;
2021-07-06
國家自然科學基金項目(編號:31772098)資助[Supported by the National Natural Science Foundation of China(No. 31772098)]
陳欲,在讀碩士研究生,專業方向:植物基因工程。E-mail: yuchen_115@126.com
汪小福,博士,副研究員,研究方向:轉基因安全評價與檢測。E-mail: yywxf1981@163.com
李玥瑩,博士,教授,研究方向:植物基因工程。E-mail: yueyinglicn@163.com
10.16288/j.yczz.21-110
2021/7/29 16:46:14
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210729.1345.003.html
(責任編委: 宋任濤)

