番石榴葉總三萜對膿毒癥大鼠急性腎損傷的治療及對PI3K/AKT通路的調控
宋銀雪 高燁 許靜 杜俊凱
創傷、感染、休克等均可并發膿毒癥,而該病屬于一種全身炎性反應綜合征,可損傷肺、心、腎等重要臟器,甚至可誘發多臟器功能衰竭綜合征,進而致死。有報道顯示,全球每年約有1 900萬人口新發膿毒癥,其中膿毒癥并發急性腎損傷者占比為30.5%~65.0%,且在膿毒癥并發急性腎損傷者中死亡率為50%~70%[1,2]。但是目前臨床上對膿毒癥并發急性腎損傷患者仍缺乏高效的治療方案,雖然烏司他丁等有一定的腎臟保護作用[3],但綜合效果不甚理想。番石榴葉總三萜是番石榴葉中提取的有效成分,其中含有豐富的烏蘇酸、積雪草酸等,在既往的研究中證實該藥物具有腎臟保護作用[4],但是在膿毒癥并急性腎損傷中的有效性尚未可知。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)通路是常用的炎性反應通路,該通路激活可影響其下游核因子-2-相關因子-2(Nrf2)基因與蛋白的表達,使得促炎性因子水平釋放量顯著增加,從而誘發急性腎損傷[5,6]。故此,本研究特設計大鼠試驗探討番石榴葉總三萜對膿毒癥大鼠急性腎損傷的治療作用,并從基因和蛋白水平上探討該藥物可能的調控機制,報道如下。
1 材料與方法
1.1 實驗動物 60只成年SD大鼠,無特定病原體級,雌雄各半,均屬同系,7~9周齡,體重180~220 g,購自廣西醫科大學實驗動物中心,合格證號:SCXK(桂)2018-0001。將所有SD大鼠分籠喂養,適應性喂養1周,喂養條件:自由飲食和進水,溫度(25±2)℃,濕度30%~50%,光照12 h、黑暗12 h,光照和黑暗交替進行。
1.2 試劑與儀器 烏司他丁(購自美國Roche公司);番石榴葉總三萜(購自溫州東匝津瑪生物科技有限公司,純度≥98%);水合氯醛溶液(購自上海經科化學科技有限公司);鼠血清肌酐(Scr)、血尿素氮(BUN)酶聯免疫法(ELISA)檢測試劑盒(購自上海江萊生物科技有限公司);鼠白介素-1β(IL-1β)、白介素-18(IL-18)、腫瘤壞死因子-α(TNF-α)ELISA檢測試劑盒(購自上海江萊生物科技有限公司);蘇木素-伊紅(HE)染色試劑盒(購自大連寶生物科技有限公司);Trizol試劑盒(購自大連寶生物科技有限公司);目的基因和內參上下游引物委托大連寶生物科技有限公司合成;蛋白定量試劑盒(購自美國ABI公司);兔抗鼠PI3K、AKT、Nrf2、磷酸化PI3K(p-PI3K)、磷酸化AKT(p-AKT)單克隆抗體、山羊抗兔PI3K、AKT、Nrf2、p-PI3K、p-AKT多克隆抗體(均購自美國Bio-Rad公司)。LA500型離心機(購自湖南湘儀儀器廠);AU5600型全自動生化分析儀(購自美國貝克曼庫爾特有限公司);KD-3368AM型組織切片機(購自上海之信儀器有限公司);11XB-PC型光學顯微鏡(購自上海光學儀器一廠);7500型聚合酶鏈反應系統(美國ABI公司);
1.3 方法 分組、建模、干預方法:自60只SD大鼠中隨機選取50只建立膿毒癥模型,具體方法:術前常規禁食禁飲,均于上午8∶00~10∶00開始手術建模。首先以水合氯醛溶液(5%)腹腔注射進行麻醉,劑量6 ml/kg,于大鼠腹部做正中切口,長度約1 cm,確認盲腸將其拉出,在總長度的1/2位置結扎,以針頭(18G)在結扎線下5 mm位置處刺孔,將盲腸回納至原位置,關閉腹腔。剩余10只記為BC組,操作與上述方法一致,但無結扎、穿刺步驟。將建模大鼠隨機分為MC組、PC組、LD組、MD組和HD組,PC組予以20萬U·kg-1·d-1烏司他丁腹腔注射,LD組、MD組和HD組予以60、120和240 mg·kg-1·d-1番石榴葉總三萜腹腔注射,連續1周。
1.4 觀察指標
1.4.1 血清腎功能和炎性反應指標檢測方法:其中腎功能指標包括血清Scr、BUN,炎性反應指標包括血清白介素-1β(IL-1β)、IL-18、腫瘤壞死因子-α(TNF-α),分別于給藥前后取尾靜脈血于真空抗凝管中,2 000 r/min 離心10 min,取上清液采用ELISA檢測,注意嚴格按照試劑盒和全自動生化分析儀說明書操作。
1.4.2 腎組織病理改變檢測:干預后斷頭法處死大鼠,迅速剝離新鮮的腎臟組織,以中性甲醛溶液固定,漂洗,梯度濃度乙醇脫水,并常規進行透明、透蠟處理。石蠟包埋,根據組織塊大小進行修整,切片,層厚設置為4 μm。HE染色,洗滌并顯色,中性樹膠封固后在光學顯微鏡下觀察腎組織病理變化。
1.4.3 腎組織PI3K、AKT、核因子-2-相關因子-2(Nrf2) mRNA表達檢測:采用實時熒光定量RT-PCR方法,具體:同法取腎組織,按照Trizol試劑盒說明書提取總RNA,逆轉錄合成為cDNA。根據NCBI基因庫信息查詢目的基因的mRNA序列,設計上下游引物,其中PI3K上游引物:5’-ACTCGATAGCTAGATCGATAGCTATAGCTAG-3’,下游引物:5’-CTGAGCTAGAGCTAGAGTTGCTAGATCGAGT-3’,長度均為18 bp;AKT上游引物:5’-TAGCTAGATCGGCTCGATAGCTAGAGGACTAG-3’,下游引物:5’-ATCGATAGCTATATATATGCTAGATGATC-3’,長度均為18 bp;Nrf2上游引物:5’-TCGATAGCTAGAGCTAGAGCTAGATCAGA-3’,下游引物:5’-ATCGATAGCTAGATCGATAGAGAGGAGATCGATG-3’,長度分別為18 bp、20 bp;內參β-actin上游引物:5’-GATAGAGAGAGGAGATGAGAGCTGAATGCATAG-3’,下游引物:5’-TAGCTAGAGATAGAGAGTCGATAGACTAGATCGA-3’,長度均為20 bp。配置反應體系,進行擴增,流程:95℃(20 s),35個循環:78℃(90 s)、58℃(30 s),最后52℃(5 min)。以配套的檢測系統分析軟件采集熒光信號,繪制溶解曲線,計算2-ΔΔCt即為待檢測基因的相對表達量。
1.4.4 腎組織PI3K、AKT、Nrf2蛋白表達及p-PI3K、p-AKT水平檢測:采用蛋白質免疫印跡法(WB)檢測。同法取腎組織,于冰上勻漿并裂解,提取總蛋白,取20 μl 樣品電泳,以轉膜儀轉膜處理,封閉孵育一抗(4℃,過夜),次日洗膜后以膜與辣根過氧化酶標記的抗IgG抗體孵育,室溫搖床孵育2 h,再次洗膜后可顯影。采用配套的圖像分析系統對條帶灰度值進行分析,內參為β-actin。
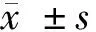
2 結果
2.1 給藥前后血清腎功能指標變化 建模和實驗期間BC組無死亡,MC組、PC組、LD組、MD組和HD組分別有4只、2只、3只、2只、2只大鼠死亡,均剔除本研究。給藥后BC組血清Scr、BUN水平均無明顯變化(P>0.05),MC組均較給藥前顯著升高(P<0.01),其余4組均較給藥前顯著下降(P<0.01),且給藥前MC組、PC組和3劑量組均高于BC組(P<0.01),給藥后MC組均顯著高于BC組(P<0.05),PC組和3劑量組均顯著低于MC組(P<0.01),PC組、MD組和HD組均顯著低于LD組(P<0.01),HD組均顯著低于PC組、MD組(P<0.01)。見表1。

表1 給藥前后血清腎功能指標變化
2.2 給藥前后血清炎性反應指標變化 給藥后BC組血清IL-1β、IL-18、TNF-α水平均無明顯變化(P>0.05),MC組均較給藥前顯著升高(P<0.01),其余4組均較給藥前顯著下降(P<0.01),且給藥前MC組、PC組和3劑量組均高于BC組(P<0.01),給藥后MC組均顯著高于BC組(P<0.05),PC組和3劑量組均顯著低于MC組(P<0.01),PC組、MD組和HD組均顯著低于LD組(P<0.01),HD組均顯著低于PC組、MD組(P<0.01)。見表2。
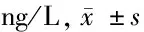
表2 給藥前后血清炎性反應指標變化
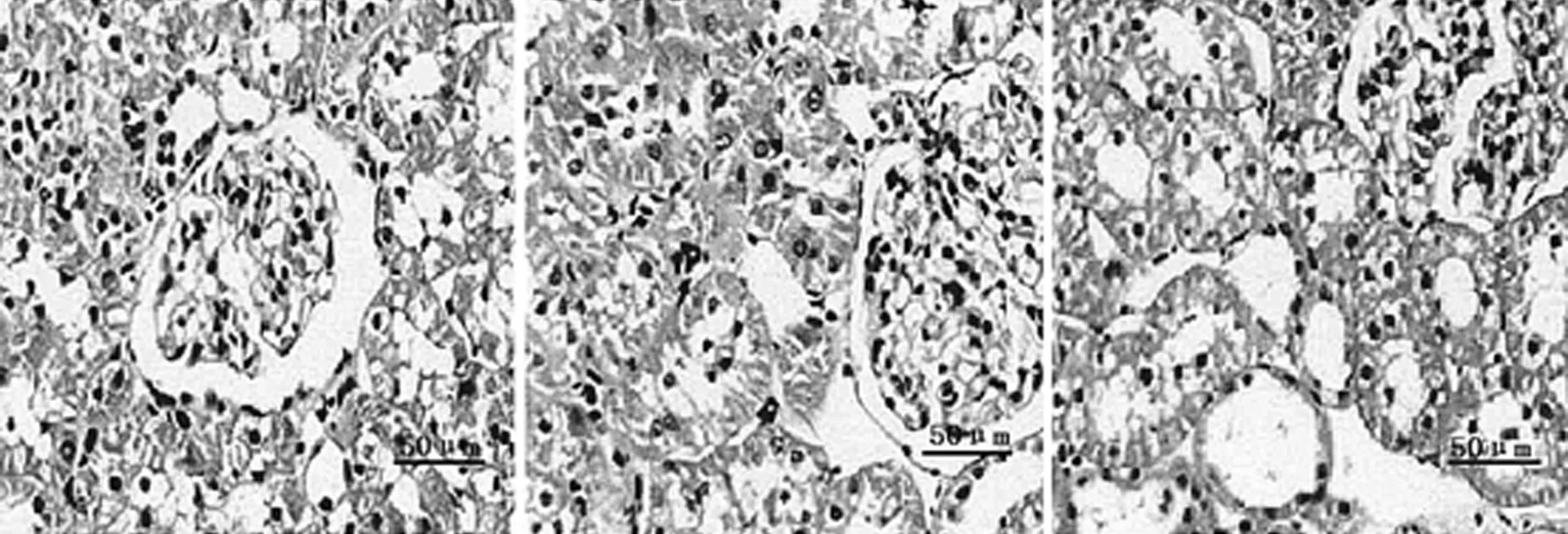
2.3 腎組織病理變化 BC組腎小球體積和形態均正常、腎曲小管上皮細胞排列整齊、均勻;MC組腎小球體積顯著增大,大多腎曲小管上皮呈嚴重濁腫變性,細胞漿內可見較多紅染顆粒細胞,且可見多個小灶狀小管壞死,甚至有部分管腔內可見明顯管型;LD組腎小球體積明顯增大,較多腎曲小管上皮呈中重度濁腫變性,細胞漿內可見多數紅染顆粒細胞,可見部分小灶狀小管壞死,有部分管腔內可見管型;PC組和MD組腎小球體積增大,部分腎曲小管上皮呈輕中度濁腫變性,細胞漿內可見部分紅染顆粒細胞,且部分小灶狀小管壞死,有少部分管腔內可見管型;HD組腎小球體積輕微增大,少量腎曲小管上皮呈輕度濁腫變性,細胞漿內可見極少紅染顆粒細胞,少部分小灶狀小管壞死,極少量管腔內可見管型。見圖1。
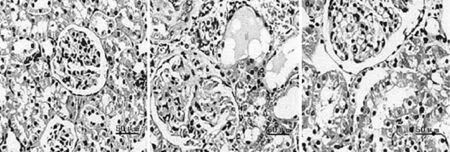
BC組MC組PC組
LD組MD組HD組
2.4 腎組織PI3K、AKT、Nrf2 mRNA相對表達量檢測 6組腎組織PI3K、AKT mRNA相對表達量對比差異均無統計學意義(P>0.05);6組腎組織Nrf2 mRNA相對表達量對比,MC組顯著高于BC組(P<0.01),PC組和3劑量組均顯著低于MC組(P<0.01),且PC組、MD組和HD組均顯著低于LD組(P<0.01),HD組顯著低于PC組和MD組(P<0.01)。見表3。

表3 腎組織PI3K 、AKT 、Nrf2 mRNA 相對表達量
2.5 腎組織PI3K、AKT、Nrf2蛋白相對表達量及p-PI3K、p-AKT水平檢測 6組腎組織PI3K、AKT蛋白相對表達量對比差異均無統計學意義(P>0.05);6組腎組織Nrf2 蛋白相對表達量、p-PI3K、p-AKT水平對比,MC組均顯著高于BC組(P<0.01),PC組和3劑量組均顯著低于MC組(P<0.01),且PC組、MD組和HD組均顯著低于LD組(P<0.01),HD組均顯著低于PC組和MD組(P<0.01)。見圖2,表4。

圖2 腎組織PI3K、AKT、Nrf2蛋白相對表達量及p-PI3K、p-AKT水平(WB)

表4 腎組織PI3K 、AKT 、Nrf2 蛋白相對表達量及p-PI3K 、p-AKT 水平
3 討論
膿毒癥主要是由感染所致,在嚴重燒傷、外科手術、多發傷、免疫力低下、重癥肺炎等患者中,可隨著疾病的進展出現臟器損傷甚至是器官功能衰竭,最終致死[7]。國內外研究均證實在膿毒癥患者及實驗動物模型中均可出現不同程度的急性腎損傷,且炎性反應嚴重,因此減輕腎損傷、改善腎功能和控制炎性反應均是膿毒癥的重要治療任務[8,9]。
本次研究結果中給藥前與BC組相比,其余5組腎功能指標和炎性反應指標均顯著升高,提示膿毒癥大鼠造模成功,且已經出現急性腎損傷;給藥后BC組腎功能指標、炎性反應指標均無明顯改變,而MC組給藥后血清Scr、BUN、IL-1β、IL-18、TNF-α水平均顯著升高,PC組和3劑量組給藥后均顯著下降,且均低于MC組,提示烏司他丁、番石榴葉總三萜均可減輕膿毒癥大鼠的腎損傷程度,控制炎性反應,且HD組均低于PC組和MD組,證實高劑量的番石榴葉總三萜的作用明顯優于烏司他丁。有研究發現,該藥物可改善糖尿病大鼠的腎功能[10];另有研究指出,番石榴葉總三萜可控制糖尿病大鼠體內高血糖狀態所致的炎性反應[11]。與本研究結果相符,推測該藥物很可能具有減輕膿毒癥大鼠急性腎損傷、控制炎性反應的作用。在本研究病理學觀察結果中顯示,MC組腎組織呈嚴重病理改變,PC組和3劑量組腎組織病變均有所減輕,且HD組的效果最佳,證實番石榴葉總三萜具有減輕膿毒癥大鼠急性腎損傷的作用,顯示出良好的挖掘價值。
PI3K/AKT信號通路可參與炎性反應、氧化應激損傷等多種病理改變,是炎性反應的經典調控通路,且已經被認為是膿毒癥急性腎損傷治療的靶點[12]。本研究中,各組腎組織PI3K、AKT mRNA及蛋白相對表達量差異無統計學意義(P>0.05),而MC組腎組織Nrf2 mRNA及蛋白相對表達量、p-PI3K、p-AKT水平均較BC組顯著升高,PC組和3劑量組均較MC組顯著下降,且HD組均明顯低于MC組和MD組,可知番石榴葉總三萜、烏司他丁均可通過調控膿毒癥大鼠腎組織PI3K/AKT信號通路,進而抑制p-PI3K、p-AKT水平、下調Nrf2的表達,推測番石榴葉總三萜很可能是通過該通路發揮保護腎臟、減輕炎性反應的作用的。PI3K/AKT可調控細胞自嗜,進而影響細胞凋亡,當該通路被激活,p-PI3K、p-AKT水平可顯著升高,激活其下游Nrf2的表達,促進膿毒癥大鼠腎臟細胞的自嗜和凋亡,同時該信號通路激活可促進IL-1β、IL-18和TNF-α等促炎性因子的分泌和釋放,引發炎性反應[13]。有報道顯示,通過抑制膿毒癥大鼠腎組織PI3K/AKT信號通路可減少IL-18的分泌和釋放,降低血清、腎組織中炎性因子的含量[14]。另有研究指出,PI3K/AKT信號通路激活還可增強炎癥小體的活性,進而加重炎性反應,誘導臟器損傷[15]。因此結合本研究結果和上述分析,推測番石榴葉總三萜很可能是通過調控PI3K/AKT信號通路,進而抑制p-PI3K、p-AKT水平、下調Nrf2的表達減輕膿毒癥大鼠模型急性腎損傷病理變化的,且其作用呈劑量依賴性。
綜上所述,番石榴葉總三萜可改善膿毒癥大鼠的腎功能,減輕炎性反應和腎組織病理損傷,且其作用呈明顯的劑量依賴性,高劑量的番石榴葉總三萜的作用顯著優于烏司他丁,推測該藥物是通過調控PI3K/AKT信號通路抑制p-PI3K、p-AKT水平、下調Nrf2的表達實現腎臟保護作用的。本研究為膿毒癥急性腎損傷患者的治療提供了新方向,但如何將其應用于臨床及其可行性、安全性,該藥物是否具有其它調控機制等問題仍需深入研究探討。

