小菜蛾溶菌酶Pxlys的基因克隆及其重組蛋白的抗菌活性分析
寧燕夏, 蘇月華, 楊 梅
(福建師范大學生命科學學院, 福州 350117)
先天性免疫主要包括細胞免疫和體液免疫,它們既可以單獨發揮作用也能相互聯系一起抵御入侵的病原生物(Lemaitre and Hoffmann, 2007)。當機體接收到免疫刺激,如病原微生物入侵或物理機械創傷等,昆蟲中的血細胞和脂肪體等會快速合成并釋放抗菌肽(例如:天蠶素、凝集素、溶菌酶)等進行防御。目前多種昆蟲的溶菌酶被研究,例如:棉鈴蟲Helicoverpaarmigera在幼蟲到蛹的變態發生時溶菌酶表達瞬時增加(Zhangetal., 2009),蠟螟Galleriamellonella也是幼蟲到蛹的變態發生時溶菌酶活性顯著增強(Altincicek and Vilcinskas, 2006),而岡比亞按蚊Anophelesgambiae在不同組織以及不同發育階段均有溶菌酶的表達(Lietal., 2005)。
溶菌酶屬于堿性蛋白酶,通過破壞細菌細胞壁的完整結構(水解肽聚糖中的N-乙酰胞壁酸和N-乙酰葡糖胺之間的糖苷鍵),最終導致細菌裂解死亡,可稱其為胞壁質酶(muramidase)(York, 2018)。依據來源進行分類,可分為4種類型:動物溶菌酶(c型溶菌酶、g型溶菌酶和i型溶菌酶)、植物溶菌酶、真菌和細菌溶菌酶、噬菌體溶菌酶(Shahmohammadi, 2017; Jietal., 2019)。溶菌酶是一種小分子抗菌肽,是從昆蟲的血淋巴中分離純化出來的抗菌因子之一,又稱其為細胞壁溶解酶,主要通過水解細菌細胞壁內的肽聚糖來殺死入侵的病原體,在昆蟲的體液免疫中扮演著重要角色。它以非特異性的方式在包括昆蟲在內的多種生物體中產生,并作為針對入侵病原體的先天免疫防御的武器庫,在缺乏獲得性免疫系統的昆蟲中起著重要作用(Nayaketal., 2018)。
小菜蛾Plutellaxylostella屬鱗翅目(Lepidoptera)菜蛾科(Plutellidae),別名吊絲蟲,是危害十字花科蔬菜的世界性害蟲之一(Linetal., 2018),每年全球由小菜蛾造成的經濟損失以及防治成本高達40~50億美元(Furingetal., 2013)。由于小菜蛾世代周期短、繁殖能力強,并對多種殺蟲劑產生抗藥性,使得對小菜蛾的防治日趨嚴峻。隨著近年來昆蟲天然免疫系統研究的深入,科學家開始把眼光集中在基于害蟲天然免疫系統為靶標的生物防治技術的開發上。而溶菌酶是動物天然免疫系統中的一類重要效應因子,有研究表明,在蚊子心臟中發現的誘導型免疫因子(溶菌酶 c-1)參與了蚊子的免疫應答(Cardoso-Jaimeetal., 2021);Liao等(2018)從紅色沼澤螯蝦克氏原螯蝦Procambarusclarkii克隆了一種c型溶菌酶,發現這種溶菌酶能夠幫助消除小龍蝦血淋巴中的侵入細菌,并通過促進血細胞吞噬作用來保護小龍蝦免于死亡;Mai等(2014)從紅斑石斑魚Epinephelusakaara中克隆了編碼c型溶菌酶的基因,其編碼蛋白為一種組成型和可誘導的急性期蛋白,參與了大腸桿菌Escherichiacoli的先天免疫防御。因此,研究小菜蛾溶菌酶的功能,有助于深入認識小菜蛾的免疫防御機理,為小菜蛾的生物防治提供新的思路。
1 材料與方法
1.1 供試生物材料和試劑
1.1.1供試昆蟲及飼養:小菜蛾取自福建省福州市閩侯縣南通鎮,人工飼養,溫度為25±2℃,相對濕度為70%~80%,光周期為16L∶8D。幼蟲飼喂人工飼料(含小麥胚芽粉37.5 g,酵母20 g,蔗糖10 g,蘿卜子粉3 g,尼泊金0.5 g,山梨酸1 g,復合維生素0.8 g,維生素C 1 g,菜籽油1 mL,亞油酸0.1 mL,瓊脂粉6 g,加雙蒸水250 mL),成蟲喂以10%的蜂蜜溶液。
1.1.2菌株、質粒和試劑:大腸桿菌E.coliDH5α和pET-29a載體由本實驗室保存;pMD19-T載體購自TaKaRa公司;大腸桿菌Origami 2(DE3)菌株由福建師范大學生命科學學院舒正玉老師惠贈;停滯棒桿菌Corynebacteriumstationis和藤黃微球菌Micrococcusluteus均購自廣東省微生物菌種保藏中心;志賀氏菌Shigellasp.由福建師范大學生命科學學院付新苗老師惠贈;蘇云金芽胞桿菌Bacillusthuringiensis(Bt)、金黃色葡萄球菌Staphyloccocusaureus、大腸桿菌和沙門氏菌Salmonellasp.為本實驗室保存。
Wizard? SV Gel和PCR Clean-Up System DNA膠回收試劑盒和Eastep? Super總RNA提取試劑盒均購自Promega公司;RACE反轉試劑盒SMARTer? RACE 5′/3′ Kit Components、ExTaq酶、DNA Marker、T4 DNA連接酶、DNA限制性內切酶BamH I和Hind III均購自TaKaRa公司。
1.2 小菜蛾溶菌酶基因RACE克隆
根據TaKaRa MiniBEST Universal RNA Extraction Kit試劑盒說明書提取小菜蛾3齡幼蟲總RNA,按SMARTer? RACE 5′/3′ Kit Components試劑盒合成5′ RACE-Ready cDNA與3′ RACE-Ready cDNA。利用引物(5′-RACE F1: 5′-CTGGCACTTGTTCTTCCA TCCATACC-3′; 3′-RACE F1: 5′-TCTTCTGACTGTGA GCTGGTGAGGG-3′)分別與UPM引物組合,進行第1輪PCR擴增;擴增產物稀釋10倍后作為模板,以引物5′-RACE引物(F2: 5′-ACTGCGACGCCTTCG TGATGT-3′)和3′-RACE引物(F2: 5′-GAGACACG GGCAAGGTGAGCA-3′)分別與UPS組合,進行第2輪PCR擴增5′端與3′端目標序列,經膠回收后連接pMD19-T,送至鉑尚生物技術(上海)有限公司測序,測序結果用DNAStar進行拼接。
1.3 小菜蛾溶菌酶基因生物信息學分析
對1.2節拼接獲得的小菜蛾溶菌酶基因序列進行生物信息學分析。利用ExPASy網站的Protparam(http:∥web.expasy.org/protparam/)分析該蛋白的理化性質;通過SignalP 4.1(http:∥www.cbs.dtu.dk/services/SignalP/)分析該蛋白質是否有信號肽序列;利用在線工具TMHMM-2.0(http:∥www.cbs.dtu.dk/services/TMHMM-2.0/)分析該蛋白質是否有跨膜結構;通過MEGA 7.0軟件對序列進行同源比對,同時采用鄰接法構建進化樹。
1.4 小菜蛾溶菌酶的原核表達與純化
根據1.2節擴增獲得的小菜蛾溶菌酶基因序列,并結合表達載體pET-29a酶切位點信息設計含酶切位點的引物(上游引物引入BamH I,下游引物引入Hind III):F′引物:5′-CGCGGATCCAAGGTA TTTTCTTCAGACTGTGAGCTGG-3′;R′引物:5′-CCC AAGCTTGCACTTGCTAACATCAGGTAGGGCT-3′。并由上海生物工程有限公司合成。PCR擴增獲得目的基因,擴增體系(20 μL):ddH2O 10.9 μL,10×ExTaqBuffer 1.5 μL,dNTP Mixture 0.5 μL,上下游引物(10 μmol/L)各0.5 μL,以1.2節的pMD19-T-Pxlys為模板1 μL,ExTaq0.15 μL。擴增程序:95℃ 5 min; 95℃ 30 s,58℃ 30 s,72℃ 1 min,30個循環;72℃ 5 min。擴增產物連接pMD19-T,轉化至大腸桿菌DH5α細胞,測序正確后,提取質粒;用BamH I酶和Hind III酶對重組質粒pMD19-T-Pxlys和pET-29a質粒進行雙酶切后用T4 DNA連接酶進行連接,以構建重組表達質粒pET-29a-Pxlys。將重組表達質粒轉化至大腸桿菌Origami 2(DE3)感受態細胞中,篩選重組工程菌。以空載pET-29a作為對照,在嚴格無菌的條件下,取50 μL驗證正確的重組表達菌株接種于含100 mg/mL卡那霉素的5 mL LB液體培養基中,37℃ 230 r/min條件下過夜震蕩培養。次日按照1%的接種量,接種于含100 mg/mL卡那霉素的50 mL LB液體培養基中,37℃ 230 r/min震蕩培養,使其菌濃度至OD600約為0.6左右,重組菌于IPTG終濃度0.6 mmol/L,溫度為16℃,轉速為150 r/min條件下誘導培養16 h,以未加IPTG誘導作為對照組,SDS-PAGE法分析蛋白表達情況。批量發酵工程菌株,超聲波破碎后,利用ATKA蛋白純化儀進行Ni柱親和層析,純化重組表達蛋白Pxlys,以HiTrapTMDesating柱脫去蛋白液中的咪唑,SDS-PAGE法分析蛋白純化情況。
1.5 小菜蛾重組蛋白Pxlys的抑菌活性鑒定
1.5.1抗菌譜的檢測:參考張洋(2016)和王藝穎(2018)的研究方法,利用牛津杯法檢測重組溶菌酶蛋白Pxlys的抗菌譜,該方法是通過觀察抑菌圈的大小來判斷樣品對該菌的抑菌能力,抑菌圈越大說明該蛋白的抗菌能力就越強(馬俊, 2016)。取革蘭氏陽性細菌停滯棒桿菌、金黃色葡萄球菌和藤黃微球菌以及革蘭氏陰性細菌大腸桿菌、志賀氏菌、沙門氏菌和蘇云金芽孢桿菌劃線活化,挑取活化后的單菌落過夜培養,次日按1%的接種量加到30 mL的LB液體培養基中發酵至OD600為0.5,備用。
離心收集1 mL待測菌液,用PBS緩沖液洗滌3次,用1 mL的PBS緩沖液懸浮菌體,經微孔濾膜過濾除菌,取100 μL備好的OD600為0.5的菌液均勻涂布于LB平板;待平板上的菌液干后,用鑷子將滅菌后的牛津布置于LB培養基表面,每個平板均勻放置3個牛津杯,吸取1.4節純化后200 μL的小菜蛾重組蛋白Pxlys液加入到牛津杯中,25℃培養,觀察抑菌圈現象,測量抑菌圈的直徑采用十字交叉法量取,重復3次。
1.5.2最小抑菌濃度(minimum inhibitory concentration, MIC)的檢測:參考李勇(2016)采用液體生長抑制法,離心收集1.5.1節中1 mL已培養好的停滯棒桿菌、金黃色葡萄球菌和大腸桿菌,用1 mL LB液體培養基制成菌懸液,并將待測菌稀釋至原濃度(OD600約為0.5)的10-4倍;1.4節純化的重組蛋白Pxlys液經微孔濾膜過濾除菌后,再用已滅菌的PBS緩沖液按2倍比例稀釋,取無菌的96孔板,每孔中分別加入100 μL稀釋好的小菜蛾重組蛋白Pxlys液和100 μL新鮮配制的菌液,以不加蛋白液用PBS代替的孔為對照組,重復3次;過夜培養,利用酶標儀檢測OD600處的吸光值,根據試驗孔與對照孔中細菌的生長情況,進行比較判斷;菌液吸光值沒有增加且肉眼觀察無明顯細菌生長的對應最低蛋白濃度即為所測菌的MIC。
1.5.3掃描電鏡觀察細菌細胞的形態:離心收集1.5.1節中1 mL已培養好的停滯棒桿菌和大腸桿菌菌液,用PBS 緩沖液(pH 7.4)洗滌3次,制成菌懸液,并將待測菌稀釋至原濃度(OD600約為0.5)的10-2倍。在停滯棒桿菌中分別加入Pxlys使得終濃度為1×MIC(50 μg/mL)和4×MIC(200 μg/mL),25℃孵育8 h;在大腸桿菌中分別加入Pxlys使得終濃度為1×MIC(100 μg/mL)和4×MIC(400 μg/mL),25℃孵育8 h;只加1 mL PBS不加溶菌酶的處理為對照。孵育結束后,離心收集菌體,用磷酸鹽緩沖液(pH 7.4)洗滌菌體3~4次,再加入2.5%戊二醛溶液,置于4℃冰箱固定2 h,離心棄去上清,用0.1 mol/L PBS(pH 7.4)沖洗4~5次,再用乙醇梯度脫水,將處理好樣品置于硅片上,室溫干燥后,用離子濺射鍍膜儀噴金,在掃描電鏡Nova NanoSEM 230中進行觀察,拍照。
2 結果
2.1 小菜蛾溶菌酶基因克隆和序列分析
RACE擴增的5′端與3′端分別出現單一條帶,與預期結果大小相近,表明擴增獲得小菜蛾溶菌酶基因5′端和3′端的產物。基于擴增得到的5′端和3′端產物進行回收測序,并利用SeqMan進行序列拼接,結果顯示成功克隆獲得的小菜蛾溶菌酶基因,命名為Pxlys(GenBank登錄號:MN702780),開放閱讀框長423 bp,編碼140個氨基酸。Protparam分析結果表明該蛋白相對分子質量為15.79 kD,理論等電點是8.91。SignalP 4.1分析結果表明該蛋白有信號肽存在,且位于第19-20位氨基酸之間,該蛋白為分泌蛋白,而TMHMM預測結果顯示該蛋白質不存在跨膜結構。
2.2 小菜蛾溶菌酶基因系統進化
序列比對(圖1)和系統進化分析結果表明(圖2),Pxlys序列與棉鈴蟲Heliothisvirescens、家蠶Bombyxmori、大豆食心蟲Leguminivoraglycinivorella和亞洲玉米螟Ostriniafurnacalis等的溶菌酶序列都具有60%以上的一致性,與NCBI中小菜蛾溶菌酶序列具有100%的一致性,確定本研究所獲得的基因Pxlys為小菜蛾溶菌酶基因。
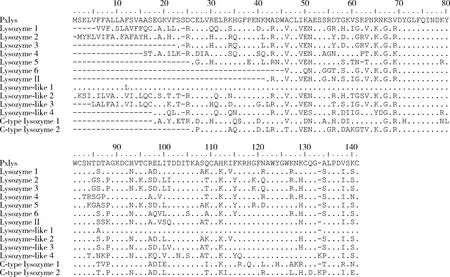
圖1 小菜蛾Pxlys與同源蛋白序列比對
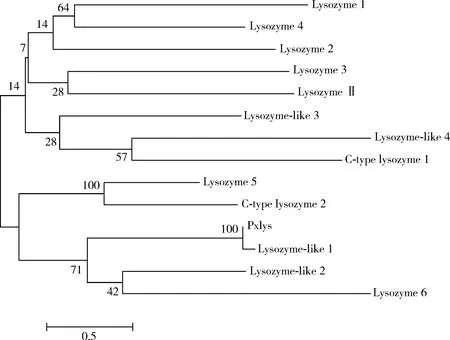
圖2 鄰接法構建的基于氨基酸序列的小菜蛾Pxlys與同源蛋白的系統進化樹(重復1 000次)
2.3 小菜蛾溶菌酶原核表達及純化
重組工程菌大腸桿菌Origami 2(DE3)-pET-29a-Pxlys經IPTG誘導后,與未誘導的對照組(泳道1)相比較,誘導的樣品(泳道2)約在19 kD出現目標條帶,說明成功表達目標蛋白;從泳道3可看出蛋白液與鎳柱較好地結合;經不同濃度的洗脫液洗脫(泳道4-7),成功純化目標蛋白(圖3)。
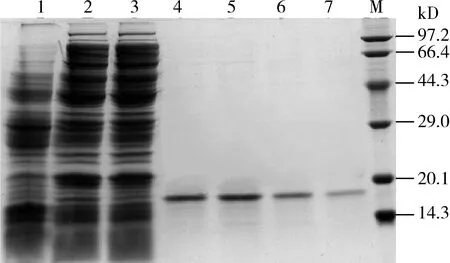
圖3 小菜蛾溶重組蛋白Pxlys的純化
2.4 小菜蛾溶菌酶Pxlys的抑菌活性
結果表明,溶菌酶Pxlys對革蘭氏陽性細菌停滯棒桿菌、藤黃微球菌和金黃色葡萄球菌以及革蘭氏陰性細菌大腸桿菌、志賀氏菌和沙門氏菌均有明顯的抑菌活性,對革蘭氏陽性細菌蘇云金芽孢桿菌也有抑菌活性(圖4);但溶菌酶對不同類型的細菌表現出不一樣的抑菌活性,對革蘭氏陽性細菌表現出的抑菌圈比對革蘭氏陰性細菌的更大(表1;圖4);其中對停滯棒桿菌、藤黃微球菌、金黃色葡萄球菌和大腸桿菌這4種細菌的抑菌圈直徑(分別為20.0±1.1, 19.0±0.5, 16.5±0.5和16.3±0.5 mm)與對革蘭氏陰性細菌的相比均表明溶菌酶Pxlys對這4種細菌表現出較強的抑菌作用。

表1 小菜蛾溶菌酶重組蛋白Pxlys(2.5 mg/mL)的抑菌活性
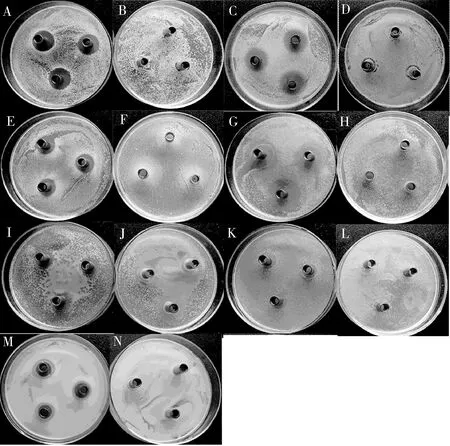
圖4 小菜蛾重組溶菌酶蛋白Pxlys(2.5 mg/mL)的抑菌效果
采用液體生長抑制法測定重組小菜蛾溶菌酶蛋白Pxlys對2種革蘭氏陽性細菌和1種革蘭氏陰性細菌的最小抑菌濃度(MIC)。結果表明,Pxlys對停滯棒桿菌的最小抑菌濃度為50 μg/mL,對金黃色葡萄球菌的最小抑菌濃度為64 μg/mL,對大腸桿菌的最小抑菌濃度為100 μg/mL。
用重組Pxlys分別處理停滯棒桿菌和大腸桿菌,以不加Pxlys為對照組,分別收集對應的菌體,在掃描電鏡下進行觀察結果顯示,未經Pxlys處理的對照組,正常的停滯棒桿菌呈短棒狀,細胞的表面完整、光滑,細胞形態沒有發生改變,且未見細胞壁或細胞膜發生損傷(圖5: A);而在50 μg/mL Pxlys處理后,停滯棒桿菌細胞的形態發生了明顯的變化,細胞表面損傷,細胞出現裂痕,進而導致細胞斷裂,細胞內容物泄露(圖5: B,紅色箭頭所示);在更高濃度200 μg/mL Pxlys處理后,細菌的完整結構遭到嚴重破壞,細胞表面粗糙不平,細胞破裂,出現大量的細胞碎片,細菌死亡,其中部分細胞出現細胞骨架崩塌現象(圖5: C,紅色箭頭所示)。未經過Pxlys處理的對照組,正常的大腸桿菌呈長桿狀,細胞的結構完整,菌體飽滿、表面光滑,未見細胞壁或細胞膜損傷(圖5: D);經100 μg/mL Pxlys處理后,細胞腫脹、凸起,細胞發生明顯損傷,細胞表面不再完整,出現裂痕,小部分內容物流出(圖5: E,紅色箭頭所示);經更高濃度(400 μg/mL)Pxlys處理后,細胞結構遭到嚴重破壞,細胞出現不同程度漲破,大量胞漿內容物流出,最終導致細菌死亡(圖5: F,紅色箭頭所示)。
3 討論
本研究通過RACE技術從小菜蛾中克隆獲得一條溶菌酶基因序列,命名為Pxlys。抑菌試驗表明,重組Pxlys對停滯棒桿菌的最小抑菌濃度最小,對其抑菌活性最大;其次對金黃色葡萄球菌的抑菌作用也大于對大腸桿菌的抑菌作用(圖4; 表1),也進一步說明,重組小菜蛾溶菌酶不僅對革蘭氏陽性細菌有抑菌能力,對革蘭氏陰性細菌也具有一定的抑菌作用,并且小菜蛾溶菌酶對革蘭氏陽性菌表現出比對革蘭氏陰性菌更強的抑菌能力。抑菌分析表明,Pxlys表現出了廣譜的抗菌活性,說明溶菌酶在昆蟲先天性免疫抵御病原菌入侵中起著重要作用。同時也為生物防治小菜蛾提供了理論基礎。研究表明,溶菌酶主要是通過破壞細菌的細胞壁來起到抗菌作用,因此其對革蘭氏陽性菌比對革蘭氏陰性菌具有更強的抗菌活性。為了探明小菜蛾溶菌酶對革蘭氏陽性細菌與革蘭氏陰性細菌的作用機制是否存在差異,我們通過掃描電鏡觀察Pxlys處理待測菌后細胞的形態變化來初步探究Pxlys抑菌作用的機理。掃描電子顯微鏡下,經Pxlys處理過的停滯棒桿菌和大腸桿菌的溶菌特征不同(圖5),表明Pxlys對于這兩種細菌有不同的抑菌機理。
前期研究表明,溶菌酶是一種陽離子抗菌肽(Sowa-Jasileketal., 2014),它能夠在帶負電荷的細菌細胞膜中插入并成孔(Derdeetal., 2013; Hukietal., 2017)。多數研究表明,溶菌酶水解細菌的作用是由其作為肽聚糖水解酶來發揮作用的,使得細菌由于細胞壁出現裂痕,導致胞漿內容物泄露,最終導致細菌死亡(Brottetal., 2019)。盡管革蘭氏陽性菌與革蘭氏陰性菌結構存在差異,但Pxlys對其均有抑菌活性,那么對這兩種細菌的抑菌作用方式是否存在差異呢?為了闡明小菜蛾溶菌酶抗菌機制,本研究采用掃描電鏡技術,從細胞超微結構的角度來分析其抗菌機制。電鏡結果顯示(圖5),正常的停滯棒桿菌細胞結構完整,而經Pxlys處理過的停滯棒桿菌,其細胞邊緣粗糙、外形不平,細胞出現裂痕,細胞骨架崩塌,出現大量的細胞碎片;與大腸桿菌的細胞腫脹、凸起進而導致細胞漲破不同,提示Pxlys對停滯棒桿菌與大腸桿菌的抑菌機理不同。前期研究認為,溶菌酶對革蘭氏陽性細菌的抗菌作用主要是通過破壞細菌細胞壁的結構來起到殺菌作用,而溶菌酶對革蘭氏陰性細菌的抗菌作用可能涉及到膜的破壞,增強了膜的通透性(Derdeetal., 2013)。雖然該機制較好地解釋了小菜蛾溶菌酶對革蘭氏陽性細菌和革蘭氏陰性細菌作用效果的不同,但該機制仍需后續進一步深入的研究。

