Wnt-5a/JNK信號通路參與PM2.5誘導的人支氣管上皮細胞系16HBE分泌IL-6和TNF-α
鄒威鳳,王曉茜,盛 青,祝 濤,周曉婷
(廣州市胸科醫院 呼吸科,廣東 廣州 510095)
隨著大氣污染的日益嚴重和慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPDs)(簡稱慢阻肺)患病率的上升,直徑≤2.5 μm的細顆粒物(fine particulate matter≤2.5 μm in diameter,PM2.5)在慢阻肺發病中的作用日益受到關注,但其機制尚不明了。研究顯示 PM2.5 可致氣道上皮細胞損傷,隨后誘導一系列炎性因子和生長因子等的分泌導致氣道慢性炎性反應持續存在[1]。炎性反應貫穿慢阻肺發展的整個過程,是慢阻肺氣流受限的重要機制[2]。既往研究表明慢阻肺患者誘導痰中無翼型整合位點家族成員5a(Wnt-5a)表達上調且與氣道阻塞程度成正相關[3]。PM2.5 可能通過誘導Wnt-5a的分泌促進慢阻肺大鼠氣道炎性反應,并促進氣道上皮細胞分泌炎性介質[4]。上述研究提示Wnt-5a在PM2.5相關慢阻肺的氣道炎性反應中扮演了重要角色。前期研究顯示PM2.5可誘導支氣管上皮細胞中Wnt-5a的表達。研究提示Wnt-5a/c-Jun N 端激酶通路的激活參與了慢阻肺炎性反應[5]。因此本研究將在前期研究基礎上,進一步探討PM2.5是否通過Wnt-5a/JNK信號通路調控氣道上皮細胞IL-6和TNF-α的分泌。
1 材料與方法
1.1 材料
1.1.1 細胞及動物:人支氣管上皮細胞系16HBE (廣州醫科大學提供);18只雌性SD大鼠(體質量180~200 g,6~8周齡)飼養于廣州醫科大學附屬第一醫院動物實驗研究中心內,飼養實驗條件參照之前的研究[6]。
1.1.2 試劑(盒)及PM2.5的方案:DMEM培養基(Gibco公司);無翼型整合位點家族成員5a (Wingless-related integration site 5a,Wnt-5a)、Wnt-5a siRNA、JNK(c-Jun-N terminal kinase,JNK)、c-Jun、p-JNK和p-c-Jun(Santa Cruz公司);SP600125(Sigma-Aldrich公司);IL-6 和TNF-αELISA試劑盒(R&D公司)。直徑≤2.5 μm 的細顆粒物(fine particulate matter≤2.5 μm in diameter,PM2.5)采集自廣東省廣州市東風西路繁忙道路旁,采集的標本凍存于-80 ℃備用,標本的詳細信息和分析方法參照之前的研究[6]。
1.2 方法
1.2.1 分組及處理:本研究分大鼠和16HBE兩部分。將大鼠分為清潔空氣對照組,吸入機動車尾氣組(機動車尾氣濃度1.5 mg/m3,2 h/d,1個月)。在機動車尾氣暴露室,PM2.5濃度是(1.46±0.03)mg/m3。最后通過腹腔內注射戊巴比妥(100 mg/kg)將大鼠處死,雙肺用4%多聚甲醛(pH 7.40)固定24 h,將肺組織包埋于石蠟中,切成4 μm厚的切片;人支氣管上皮細胞系16HBE按2×10-5個細胞/瓶將細胞接種于6孔板中,使細胞增殖達到60%~70%匯合。將細胞分為對照組、PM2.5(20 μg/mL)組、陰性對照siRNA+PM2.5組、Wnt-5a siRNA+PM2.5組、Wnt-5a siRNA+對照組、JNK抑制劑SP600125+PM2.5組、SP600125+對照組(每組設3個復孔)。細胞干預前24 h將細胞接種于6孔培養板,當細胞匯合達60%時,分別預先加入Wnt-5a siRNA、陰性siRNA培養24 h或SP600125培養1 h,再繼續加入PM2.5刺激培養24 h。
1.2.2 免疫組化檢測肺組織中p-JNK和p-c-Jun蛋白的表達:將肺組織切片脫蠟水化,并分別與p-JNK抗體(1∶100)和p-c-Jun抗體(1∶100)在室溫下孵育1 h,洗滌后,加羊抗鼠HRP二抗,室溫下孵育1 h,DAB 法顯色。在共聚焦顯微鏡(×200)下進行評估,使用半定量評分系統對p-JNK和p-c-Jun陽性細胞的吸光度進行定量。
1.2.3 Western blot檢測16HBE細胞中Wnt-5a、p-JNK、p-c-Jun蛋白的表達:提取細胞蛋白,BCA法測定蛋白濃度。取 50 μg蛋白上樣,電泳結束后將目的蛋白轉移到PVDF膜上(200 mA,2 h),加Wnt-5a抗體(1∶1 000)、p-JNK抗體(1∶1 000)、p-c-Jun抗體(1∶1 000)、GAPDH抗體(1∶5 000)室溫下孵育1 h。DAB 法顯色,電泳凝膠成像分析儀采集結果。用Image J圖像分析系統進行吸光度值分析。結果以目的蛋白的吸光度值除以內參GAPDH的吸光度值表示。
1.2.4 ELISA檢測16HBE中IL-6和TNF-α的分泌:按ELISA試劑盒說明書進行測定。
1.3 統計學分析
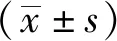
2 結果
2.1 機動車尾氣(motor vehicle exhaust,MVE)暴露對大鼠肺組織p-JNK和p-c-Jun蛋白表達水平的影響
MVE組大鼠支氣管上皮細胞和肺泡上皮細胞p-JNK和p-c-Jun表達顯著高于對照組(P<0.05)(圖1)。

A.representative expression of p-JNK and p-c-Jun(×200);B.statistical analysis of p-JNK and p-c-Jun A value;*P<0.05 compared with control group圖1 免疫組化檢測大鼠肺組織p-JNK和p-c-Jun蛋白的表達Fig 1 Immunohistochemistry examined the expression of p-JNK and p-c-Jun in the lungs of
2.2 不同處理組16HBE細胞中Wnt-5a蛋白表達的比較
與PM2.5組相比,Wnt-5a siRNA+PM2.5組Wnt-5a的表達顯著減少(P<0.05);與對照組相比,Wnt-5a siRNA+對照組Wnt-5a的表達顯著減少(P<0.05)(圖2)。

A.effects of Wnt-5a siRNA on expression of Wnt-5a;B.statistical analysis of Wnt-5a protein expression level;#P<0.05 compared with control group;*P<0.05 compared with PM2.5 group圖2 Western blot檢測16HBE細胞中的Wnt-5a蛋白表達水平Fig 2 Western blot examined the expression of
2.3 不同處理組16HBE中p-JNK和JNK蛋白表達的比較
與對照組相比,PM2.5組p-JNK蛋白的表達明顯增加(P<0.05);與PM2.5組相比,Wnt-5a siRNA+PM2.5組p-JNK蛋白的表達明顯減少(P<0.05)(圖3)。

A.effects of Wnt-5a siRNA on expression of p-JNK and JNK;B.statistical analysis of p-JNK/JNK ratio;#P<0.05 compared with control group;*P<0.05 compared with PM2.5 group圖3 Western blot檢測16HBE中p-JNK和JNK的蛋白表達水平Fig 3 Western blot examined the expression of p-JNK and JNK in
2.4 不同處理組16HBE中p-c-Jun和c-Jun蛋白表達的比較
與對照組相比,PM2.5組JNK的下游蛋白p-c-Jun的表達明顯增加(P<0.05);與PM2.5組相比,Wnt-5a siRNA+PM2.5組p-c-Jun蛋白的表達明顯減少(P<0.05)(圖4A,B),SP600125+PM2.5組p-c-Jun蛋白的表達明顯減少(P<0.05)(圖4C,D)。

A.effects of Wnt-5a siRNA on expression of p-c-Jun and c-Jun;B.statistical analysis of p-c-Jun/c-Jun ratio;C.effects of SP600125 on expression of p-c-Jun and c-Jun;D.statistical analysis of p-c-Jun/c-Jun ratio;#P<0.05 compared with control group;*P<0.05 compared with PM2.5 group圖4 Western blot檢測16HBE中的p-c-Jun和c-Jun蛋白表達水平Fig 4 Western blot examined the expression of p-c-Jun and c-Jun in
2.5 不同處理組16HBE中分泌炎性因子IL-6和TNF-α的比較
與對照組相比,PM2.5組IL-6和TNF-α的分泌明顯增加(P<0.05);與PM2.5組相比,Wnt-5a siRNA+PM2.5組IL-6和TNF-α的分泌明顯減少 (P<0.05)(圖5A),SP600125+PM2.5組IL-6和TNF-α的分泌明顯減少(P<0.05)(圖5B)。

A.effects of Wnt-5a siRNA on the secretion of IL-6 and TNF-α;B.effects of SP600125 on the secretion of IL-6 and TNF-α;#P<0.05 compared with control group;*P<0.05 compared with PM2.5 group圖5 ELISA檢測16HBE中IL-6和TNF-α的分泌Fig 5 ELISA examined the secretion of IL-6 and TNF-α in
3 討論
近年來大量流行病學研究發現空氣污染中的 PM2.5可增加慢阻肺的發病率、急性加重風險、肺功能下降及病死率[7]。PM2.5 可避開上呼吸道的保護作用直接進入下呼吸道,直接或間接(代謝產物、后續急慢性炎性反應)損傷肺組織,對人體的危害最大。氣道上皮細胞作為呼吸道對抗有害氣體和顆粒的第一道解剖屏障,在慢阻肺的發生發展過程中有著關鍵作用[8],可以通過釋放一系列炎性因子如TNF-α和IL-6等參與慢阻肺氣道結構重塑,最終導致不可逆氣流受限。本研究發現大鼠暴露于機動車尾氣可誘導肺組織p-JNK和p-c-Jun上調。PM2.5誘導16HBE細胞中Wnt-5a、p-JNK和p-c-Jun表達上調,并誘導IL-6和TNF-α的分泌,提示Wnt-5a/JNK信號通路可能參與PM2.5相關慢阻肺氣道炎性反應的過程。
Wnt-5a屬于Wnts蛋白家族成員之一,是一種富含半胱氨酸結構域的分泌性糖蛋白,其表達水平與某些肺部疾病直接或間接相關。研究表明慢阻肺患者誘導痰中Wnt-5a表達上調且與氣道阻塞程度成正相關[3]。在慢阻肺大鼠模型中,CSE和炎性因子協同作用上調Wnt-5a的表達,抑制 Wnt-5a的表達能改善肺功能[9]。PM2.5誘導氣道上皮細胞中Wnt-5a的表達[10]。上述研究提示Wnt-5a的表達調控及其信號傳導與PM2.5相關的慢阻肺氣道炎性應答密切相關。
Wnt-5a可作為重要的炎性介質通過非經典Wnt通路誘導JNK的活化。JNK是一種絲氨酸/蘇氨酸蛋白激酶,在細胞的增殖、分化及凋亡的過程中發揮重要的作用,與細胞的應激反應及炎性反應有明顯的關系。研究發現PM2.5暴露的動物模型中JNK的表達上調[11]。本研究顯示Wnt-5a siRNA抑制了PM2.5誘導16HBE中JNK和c-Jun磷酸化、p-JNK/JNK和p-c-Jun/c-Jun比值,也抑制了IL-6和TNF-α分泌。各種刺激因子可誘導支氣管上皮細胞中p-JNK的表達[12]。JNK抑制劑SP600125抑制PM2.5促進人成纖維細胞中IL-6的產生[13]。本研究結果進一步提示SP600125降低了PM2.5誘導16HBE中p-c-Jun/c-Jun比值及IL-6和TNF-α的分泌。這說明Wnt-5a/JNK信號通路在PM2.5誘導16HBE分泌的IL-6和TNF-α中起重要作用。
綜上所述,Wnt-5a可能通過促進p-JNK和p-c-Jun的表達參與了PM2.5誘導的人支氣管上皮細胞系IL-6和TNF-α炎性因子的分泌,從而促進了PM2.5相關慢阻肺患者的氣道炎性反應。該研究為有針對性的治療慢阻肺尋找有效的藥物新靶點提供了理論依據。

