新型大黃酸煙酸偶聯(lián)物的合成及抗血小板聚集活性
丁 樂, 尚飛揚, 姚傳勇, 戴衛(wèi)國, 何黎琴
(安徽中醫(yī)藥大學(xué) 藥學(xué)院,安徽 合肥 230038)
血栓性疾病的發(fā)病率與死亡率較高,嚴(yán)重危害人類健康。臨床應(yīng)用表明,抗血小板藥物能夠抑制血小板的黏附、聚集和釋放,有助于減少心腦血管不良事件的發(fā)生,降低血栓疾病的發(fā)病率和死亡率[1]。目前臨床使用的抗血小板藥物較多,但存在抗血小板聚集療效不佳、藥物抵抗或增加出血風(fēng)險等缺點[2-4]。因此,尋找高效低毒的新型抗血小板藥物是藥學(xué)工作者關(guān)注重點問題之一。
導(dǎo)致血栓形成的因素有很多,其中血小板聚集對血栓的形成起著關(guān)鍵的作用。人類血小板表面上存在脂蛋白特異性位點,與LDL-C、 ox-LDL結(jié)合后可激活血小板,增強腺苷二磷酸酶和凝血酶誘導(dǎo)的血小板聚集作用[5]。此外,高濃度的LDL-C、 ox-LDL可以直接引起血小板聚集。因此,利用拼合原理,選用具有抗血小板聚集活性和降低LDL-C的活性成分進行偶聯(lián),以期得到更好的抗血小板藥物,不失為一種具有良好發(fā)展前景的藥物設(shè)計思路。
大黃是常用中藥之一,《神農(nóng)本草經(jīng)》上記載:“大黃主下淤血,血閉,寒熱,破癥瘕積聚,留飲,宿食,蕩滌腸胃,推陳致新,通利水殺,調(diào)中化食,安和五臟,生山谷”。由此可知,活血化瘀作用是大黃的重要功效之一。大黃酸是中藥大黃的主要有效成分之一,譚鵬等[6]的研究表明,大黃酸對血小板表面的P2Y12受體有較高的親和力,與其結(jié)合可有效阻斷ADP誘導(dǎo)的血小板聚集,從而抑制血栓形成。但由于大黃酸溶解性較差,生物利用度較低,使大黃酸的臨床使用受到了很大限制。現(xiàn)已有多個課題組對大黃酸進行了結(jié)構(gòu)修飾,得到的系列大黃酸衍生物在藥理活性、溶解性能和生物利用度方面均具有較大的改善[7-10],這為大黃酸的進一步的修飾改造打下良好的基礎(chǔ)。
煙酸為臨床上常用的調(diào)節(jié)血脂異常的藥物,在藥理劑量下能降低總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、極低密度脂蛋白膽固醇(VLDL-C)、三酰甘油(TG)的量,同時還能夠有效地升高高密度脂蛋白膽固醇(HDL-C)水平[11-13]。煙酸除了具有良好的降血脂作用外,還有擴張外周血管,抑制血小板聚集,抑制TXA2合成和促進PGI2合成等作用[14]。孿藥是指將兩個相同或不同的先導(dǎo)化合物或藥物經(jīng)共價鍵連接,綴合成的新分子,在體內(nèi)代謝生成以上兩種藥物而產(chǎn)生協(xié)同作用,增強活性或產(chǎn)生新的藥理活性,或者提高作用的選擇性。成功用于臨床的孿藥不少,如依托貝特,為氯貝酸(貝特類)與煙酸通過化學(xué)鍵連接所形成的前體藥物。它不僅具有貝特類藥物所具有的強大的降低總膽固醇(TG)和升高高密度脂蛋白膽固醇(HDL-C)血中濃度的能力,同時還具有煙酸類強大的降低密度脂蛋白膽固醇(LDL-C)的能力和中等強度地降TC及能輕微地降低血壓,有貝特和煙酸的雙重功效而又減少和彌補了它們各自的缺陷和不足。
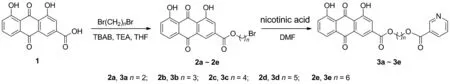
受此啟發(fā),本文將具有P2Y12受體阻滯作用的大黃酸(1)與具有降低LDL-C作用的煙酸通過不同連接橋偶聯(lián),設(shè)計并合成了5個新型的大黃酸煙酸偶聯(lián)物(3a~3e, Scheme 1),并對其體外抗血小板聚集活性進行了初步評價,期望得到具有多靶點的高療效、低不良反應(yīng)并產(chǎn)生的協(xié)同作用的抗血小板藥物。
1 實驗部分
1.1 儀器與試劑
Mel-TEMP Ⅱ型數(shù)字熔點儀;Bruker AV Ⅲ 600 MHz型核磁共振儀;Finnigan LCQ Advantage MAX型液質(zhì)聯(lián)用質(zhì)譜儀。
大黃酸(98%),西安小草植物科技有限責(zé)任公司;二溴烷烴,分析純,上海麥克林生化科技有限公司;煙酸,分析純,國藥集團化學(xué)試劑有限公司;其余所用試劑均為分析純。
1.2 合成
(1) 大黃酸-溴代烷基酯(2a~2e)的合成通法[15]
將大黃酸284 mg(1 mmol),三乙胺0.6 mL(4 mmol),四正丁基溴化銨322 mg(1 mmol)加入到10 mL四氫呋喃(THF)中,于30 ℃攪拌5 min;加入二溴烷烴4 mmol,反應(yīng)至終點(TLC檢測)。過濾,濾液減壓濃縮,殘余物經(jīng)硅膠柱層析[洗脫劑:A=V(乙酸乙酯)/V(石油醚)=1/5]純化得黃色固體2a~2e,收率81%~85%。
(2)3a~3e的合成通法[12]
將2a~2e(0.5 mmol)溶于10 mL DMF中,依次加入煙酸123 mg(1 mmol),碳酸鉀276 mg(2 mmol),催化量碘化鉀,攪拌下于50 ℃反應(yīng)至終點(TLC檢測)。抽濾,濾液加水150 mL,用乙酸乙酯(3×50 mL)萃取,合并有機層,依次用飽和食鹽水(50 mL)洗滌,無水硫酸鈉干燥,抽濾,濾液減壓濃縮,殘余物經(jīng)硅膠柱層析(洗脫劑:A)純化得到深黃色固體3a~3e。
3a: 黃色固體,收率67.3%, m.p.136.3~137.7 ℃;1H NMR(CDCl3, 600 MHz)δ: 12.01(s, 1H, OH), 11.93(s, 1H, OH), 9.26(s, 1H, PyH), 8.79(s, 1H, PyH), 8.42(d,J=8.8 Hz, 1H, PyH), 8.33(d,J=8.9 Hz, 1H, PhH), 7.94(s, 1H, PhH), 7.86(d,J=8.7 Hz, 1H, PhH), 7.75~7.72(m, 1H, PyH), 7.43~7.39(m, 1H, PhH), 7.34(d,J=7.3 Hz, 1H, PhH), 4.72(t,J=6.2 Hz, 4H, CH2); HR-MS(ESI)m/z: Calcd for C23H16NO8{[M+H]+}434.0831, found 434.0913。
3b: 黃色固體,收率66.2%, m.p.123.7~125.6 ℃;1H NMR(CDCl3, 600 MHz)δ: 12.01(s, 1H, OH), 11.94(s, 1H, OH), 9.25(s, 1H, PyH), 8.77(s, 1H, PyH), 8.41(d,J=8.7 Hz, 1H, PyH), 8.32(d,J=8.8 Hz, 1H, PhH), 7.95(s, 1H, PhH), 7.87(d,J=8.4 Hz, 1H, PhH), 7.74~7.72(m, 1H, PyH), 7.42~7.37(m, 1H, PhH), 7.33(d,J=7.1 Hz, 1H, PhH), 4.72~4.69(t,J=6.1 Hz, 4H, CH2), 2.43~2.41(m, 2H, CH2); HR-MS(ESI)m/z: Calcd for C24H18NO8{[M+H]+}448.0988, found 448.1036。
3c: 黃色固體,收率77.9%, m.p.122.1~123.5 ℃;1H NMR(CDCl3, 600 MHz)δ: 12.02(s, 1H, OH), 11.94(s, 1H, OH), 9.23(s, 1H, PyH), 8.78(s, 1H, PyH), 8.38(s, 1H, PyH), 8.29(d,J=8.8 Hz, 1H, PhH), 7.91(s, 1H, PhH), 7.85(d,J=8.5 Hz, 1H, PhH), 7.72~7.67(m, 1H, PyH), 7.41~7.37(m, 1H, PhH), 7.35(d,J=7.0 Hz, 1H, PhH), 4.68(t,J=6.3 Hz, 4H, CH2), 1.77~1.75(m, 4H, CH2); HR-MS(ESI)m/z: Calcd for C25H20NO8{[M+H]+}462.1144, found 462.1229。
3d: 黃色固體,收率72.0%, m.p.118.3~120.1 ℃;1H NMR(CDCl3, 600 MHz)δ: 12.01(s, 1H, OH), 11.93(s, 1H, OH), 9.25(s, 1H, PyH), 8.79(s, 1H, PyH), 8.42(d,J=8.7 Hz, 1H, PyH), 8.32(d,J=8.7 Hz, 1H, PhH), 7.94(s, 1H, PhH), 7.87(d,J=8.8 Hz, 1H, PhH), 7.75~7.72(m, 1H, PyH), 7.43~7.39(m, 1H, PhH), 7.34(d,J=7.1 Hz, 1H, PhH), 4.69(t,J=5.9 Hz, 4H, CH2), 1.76~1.73(m, 4H, CH2), 1.56~1.53(m, 2H, CH2); HR-MS(ESI)m/z: Calcd for C26H22NO8{[M+H]+}476.1301, found 476.1386。
3e: 黃色固體,收率73.8%, m.p.113.7~115.4 ℃;1H NMR(CDCl3, 600 MHz)δ: 12.02(s, 1H, OH), 11.94(s, 1H, OH), 9.22(s, 1H, PyH), 8.77(s, 1H, PyH), 8.41(d,J=8.8 Hz, 1H, PyH), 8.30(d,J=8.8 Hz, 1H, PhH), 7.93(s, 1H, PhH), 7.87(d,J=8.8 Hz, 1H, PhH), 7.75~7.72(m, 1H, PyH), 7.43~7.39(m, 1H, PhH), 7.34(d,J=7.5 Hz, 1H, PhH), 4.37(t,J=6.1 Hz, 4H, CH2), 1.75~1.73(m, 4H, CH2), 1.42~1.39(m, 4H, CH2); HR-MS(ESI)m/z: Calcd for C26H24NO8{[M+H]+}490.1457, found 490.1546。
1.3 體外抗血小板聚集活性實驗方法及結(jié)果
參照文獻[16]方法,以阿司匹林(ASP)和煙酸為陽性對照藥,采用比濁法對目標(biāo)化合物3a~3e進行了體外抗血小板聚集活性測試,結(jié)果如表1所示。
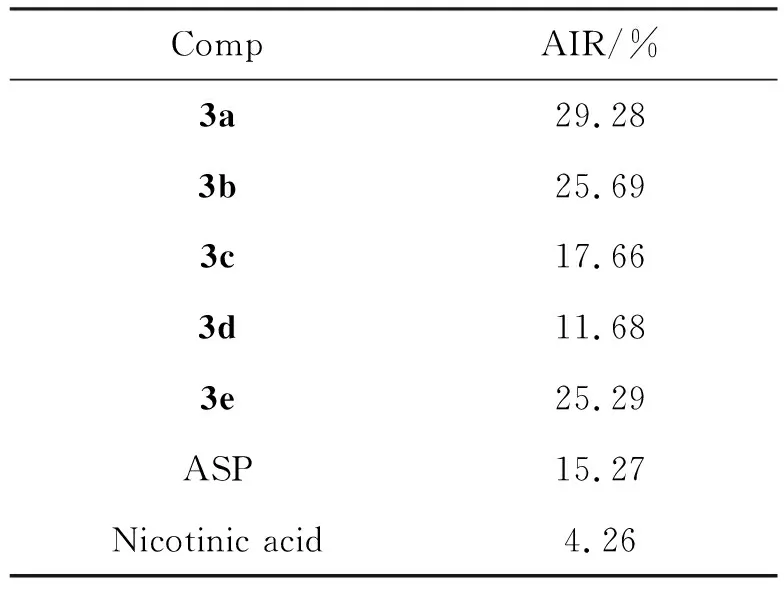
表1 化合物3a~3e的血小板聚集抑制率(AIR)
2 結(jié)果與討論
2.1 合成
將具有P2Y12受體阻滯作用的大黃酸,與具有降低LDL-C作用的煙酸通過不同碳數(shù)的烷基連接臂偶聯(lián),合成了5個新的大黃酸煙酸偶聯(lián)物。在目標(biāo)化合物合成路線設(shè)計的過程中,考慮到研究室前期曾對大黃酸與二溴烷烴反應(yīng)的條件進行優(yōu)化并以良好收率獲得中間體2a~2e,參考此方法,以大黃酸為起始原料,與二溴烷烴反應(yīng)生成相應(yīng)的大黃酸溴代烷基酯,收率達80%以上;本文還對目標(biāo)化合物的反應(yīng)條件進行了考察與優(yōu)化,發(fā)現(xiàn)其最佳反應(yīng)條件為:DMF為溶劑,物料比n(大黃酸溴代烷基酯)/n(煙酸)=1/2,反應(yīng)溫度為50 ℃,收率66.2%~77.9%。
2.2 藥理活性
體外抗血小板聚集活性實驗結(jié)果表明(表1),目標(biāo)化合物3a~3e對ADP誘導(dǎo)的血小板聚集具有較好的抑制作用,血小板聚集抑制率在11.68%~29.28%,除化合物3d(AIR為11.68%)的活性略低于陽性對照藥阿司匹林(AIR為15.27%),其余化合物的活性均強于陽性對照藥阿司匹林,尤其以3a的活性最佳(AIR為29.28%)。
利用拼合原理,以不同碳數(shù)的烷烴鏈為連接臂,將具有活血化瘀作用的大黃酸與降血脂藥煙酸偶聯(lián),得到相應(yīng)的大黃酸煙酸偶聯(lián)物(3a~3e)。采用比濁法對合成的大黃酸煙酸偶聯(lián)物進行體外抗血小板聚集活性測試。結(jié)果表明,目標(biāo)化合物均具有一定的體外抗血小板聚集活性,其中,化合物3a、3b、3e的活性明顯優(yōu)于陽性對照藥阿司匹林,尤其以3a的活性最佳。

