豬圓環(huán)4型病毒Cap蛋白的原核表達
于成東,哈 卓,王 政,李 凱,李秋璇,孟 媛,李亭玉,于 桐,金 鑫*,魯會軍*,金寧一*
(1.延邊大學 農學院,吉林 延吉 133000;2.軍事科學院 軍事醫(yī)學研究院 軍事獸醫(yī)研究所,吉林 長春 130122;3.揚州大學 動物醫(yī)學學院,江蘇 揚州 225000;4.吉林農業(yè)大學 動物醫(yī)學學院,吉林 長春 130122)
豬圓環(huán)病毒(porcine circovirus,PCV)屬于圓環(huán)病毒科、圓環(huán)病毒屬,為二十面體對稱、無囊膜的單股、閉合、環(huán)狀 DNA 病毒[1]。據(jù)報道,已鑒定出3種豬圓環(huán)病毒,其中包括PCV1、PCV2和PCV3。PCV1是由TISCHER等[1]在1974年于豬腎傳代細胞系PK-15中發(fā)現(xiàn)并分離,對豬群沒有致病性;PCV2最早是由ELLIS等[2]在1991年于加拿大發(fā)現(xiàn)的,對豬群有較強的致病性,是引起斷奶仔豬多系統(tǒng)衰竭綜合征(postweaning multisystemic wasting syndrome,PMWS)的主要病原;PCV3是2016年美國科研人員通過宏基因組測序技術,從患有皮炎與腎病綜合征(PDNS)和繁殖障礙的母豬及流產胎兒中鑒定出的豬圓環(huán)病毒[3]。
2019年,中國學者從湖南省患有嚴重臨床癥狀的豬中鑒定出了一種新型圓環(huán)病毒,命名為豬圓環(huán)4型病毒(PCV4)。PCV4基因組全長1 770 bp,與水貂圓環(huán)病毒的同源性最高。對PCV4的2個主要基因進行了分析,其中長度為891 bp的ORF1主要編碼復制酶蛋白(Rep蛋白);ORF2長度為687 bp,編碼衣殼蛋白(Cap蛋白)[4]。Cap蛋白是主要的結構蛋白,含有多個抗原表位,是病毒的重要免疫原區(qū)域。
據(jù)報道,中國湖南省、河南省與山西省均檢測出PCV4,但在意大利與西班牙并未檢測出該病毒[4-6]。PCV4病毒作為一種新發(fā)現(xiàn)的圓環(huán)病毒,由于發(fā)現(xiàn)時間較短,對其存在的時間、感染率、流行情況及致病性并不明確。豬瘟、豬偽狂犬病、豬圓環(huán)病毒病并稱為世界三大豬病,每年對養(yǎng)豬業(yè)造成了巨大經濟損失[7],而中國作為PCV4的首次檢出地,面臨著更加嚴峻的挑戰(zhàn),對PCV4進行分子流行病學調查,建立有效的抗原、抗體檢測方法并對其進行更加深刻的基礎研究,對我國養(yǎng)豬業(yè)新發(fā)PCV的防控具有重要意義。Cap蛋白作為PCV的主要結構蛋白,其在對PCV4的監(jiān)測與抗病毒方面具有廣闊的應用前景。本試驗旨在構建pET28a-PCV4-Cap原核表達載體,制備PCV4 Cap蛋白,為建立PCV4血清流行病學檢測方法奠定基礎。
1 材料與方法
1.1 菌株、載體及主要試劑pET28a載體由本實驗室保存;大腸桿菌Trans1 T1、FastPfu Fly DNA聚合酶、Blue PlusⅡ Protein Marker均購自北京全式金生物技術有限公司;表達宿主菌BL21(DE3)PLySs購自生工生物工程(上海)股份有限公司;限制性內切酶BamHⅠ與XhoⅠ,T4DNA連接酶均購自NEB公司;IPTG、DL2000 DNA Marker、λ-EcoT14Ⅰdigest Marker購自TaKaRa公司,質粒小量提取試劑盒購自美國AxyPrep公司。
1.2 基因、引物的設計與合成以本實驗室擴增的內蒙PCV4毒株PCV4/CN/NM1/2017(GenBank登錄號為:MT882410)的ORF2基因序列為參考,送往生工生物工程(上海)股份有限公司進行ORF2基因合成。應用Premier 5.0軟件,設計1對去掉Cap蛋白N端信號肽特異性引物,分別在引物的上下游分別加入BamHⅠ與XhoⅠ酶切位點。上游引物P1:5′-CGCGGATCCCACGCGCGTTTCATGC-GTGA-3′;下游引物P2:5′-CGGCTCGAGAACCCTGTTTCGGGTAGTTAA-3′。
1.3 目的基因的擴增以合成的基因質粒為模板,對目的片段進行PCR擴增,反應體系為:ddH2O 13.5 μL;5× FastPfu Fly Buffer 5 μL;2.5 mmol/L dNTPs 2 μL;;FastPfu Fly DNA聚合酶 0.5 μL;上游引物P1 1 μL(10 μmol/L);下游引物P2 1 μL(10 μmol/L);模板 2 μL,總反應體系為25 μL。PCR擴增程序如下:95℃預變性2 min;95℃變性20 s,60℃退火20 s,72℃延伸30 s,40個循環(huán);72℃延伸5 min。將PCR產物進行1 %瓊脂糖凝膠電泳鑒定,對目的片段切膠回收備用。
1.4 重組表達質粒pET28a-PCV4-Cap的構建與鑒定將經PCR擴增后目的片段的膠回收產物與pET-28a載體,使用BamHⅠ與XhoⅠ限制性內切酶進行雙酶切,膠回收雙酶切產物,將回收的Cap基因與pET-28a載體,使用T4連接酶于16℃條件下連接過夜。將連接產物轉化至大腸桿菌Trans1 T1感受態(tài)細胞中,挑取單克隆菌落,37℃ 震蕩培養(yǎng)12 h,進行質粒小量提取,對所得質粒進行雙酶切鑒定,鑒定正確的送往生工生物工程(上海)股份有限公司進行測序,測序結果正確的質粒命名為pET28a-PCV4-Cap。
1.5 重組蛋白的誘導表達將鑒定正確的重組表達質粒轉化至BL21(DE3)pLysS 感受態(tài)細胞,挑取單克隆菌落,接種于5 mL卡那霉素抗性LB培養(yǎng)基中,37℃震蕩培養(yǎng)12 h。以1∶200的比例接種于卡那霉素抗性的LB培養(yǎng)基中,37℃震蕩培養(yǎng)至D600達到0.5左右時,加入 IPTG 進行誘導表達,收集菌液進行超聲處理。
1.6 重組Cap蛋白的表達條件優(yōu)化
1.6.1最適表達溫度優(yōu)化 按照1∶200的比例將保存的重組菌接種于卡那霉素抗性的LB培養(yǎng)基中,當D600達到0.5左右時,加入終濃度為1 mmol/L的IPTG進行誘導,于26,37℃條件下分別誘導6 h,收集菌液樣本,制備蛋白樣,使用12.5%的分離膠進行SDS-PAGE電泳。
1.6.2最適IPTG誘導濃度 按照1∶200的比例將保存的重組菌接種于卡那霉素抗性的LB培養(yǎng)基中,當D600達到0.5左右時,加入終濃度為0.2,0.4,0.6,0.8,1.0 mmol/L的IPTG,37℃誘導8 h,收集菌液,制備蛋白樣,進行SDS-PAGE電泳,篩選IPTG最適誘導濃度。
1.6.3最佳誘導時間 按照1∶200的比例將保存的表達菌接種于卡那霉素抗性的LB培養(yǎng)基中,220 r/min 震蕩培養(yǎng)至D600為0.5左右時,加入終濃度為0.2 mmol/L的IPTG,于37℃條件下分別誘導2,4,6,8,10,12 h,制備蛋白樣,使用12.5%的分離膠進行SDS-PAGE電泳,確定最佳誘導時間。
1.7 重組Cap蛋白的表達形式驗證將誘導后的菌液進行收集,5 000 r/inm離心10 min,棄去上清,將沉淀用PBS重懸后,低溫條件下進行超聲破碎,將破碎后的菌液5000 r/min 離心10 min,收集上清,沉淀用與上清等量的PBS重懸,并取出適量樣本,加入5×SDS-PAGE上樣液,沸水煮10 min,而后通過SDS-PAGE電泳進行驗證。
1.8 Western blot驗證將1.5中所得誘導表達的蛋白樣本,進行SDS-PAGE電泳后,半干法恒壓15 V轉至硝酸纖維素膜,5%脫脂乳室溫封閉2 h;TBST洗滌3次;使用1∶3 000稀釋的鼠源His抗體,4℃孵育過夜;TBST洗滌3次;使用HRP標記的山羊抗小鼠二抗1∶5 000稀釋,室溫孵育45 min;TBST洗滌3次,每次10 min,而后進行顯影。
2 結果
2.1 PCV4Cap基因的擴增使用設計的Cap基因特異性擴增引物,經PCR方法擴增后,進行1%瓊脂糖凝膠電泳,最終得到567 bp的目的片段產物,與預期效果相同(圖1)。
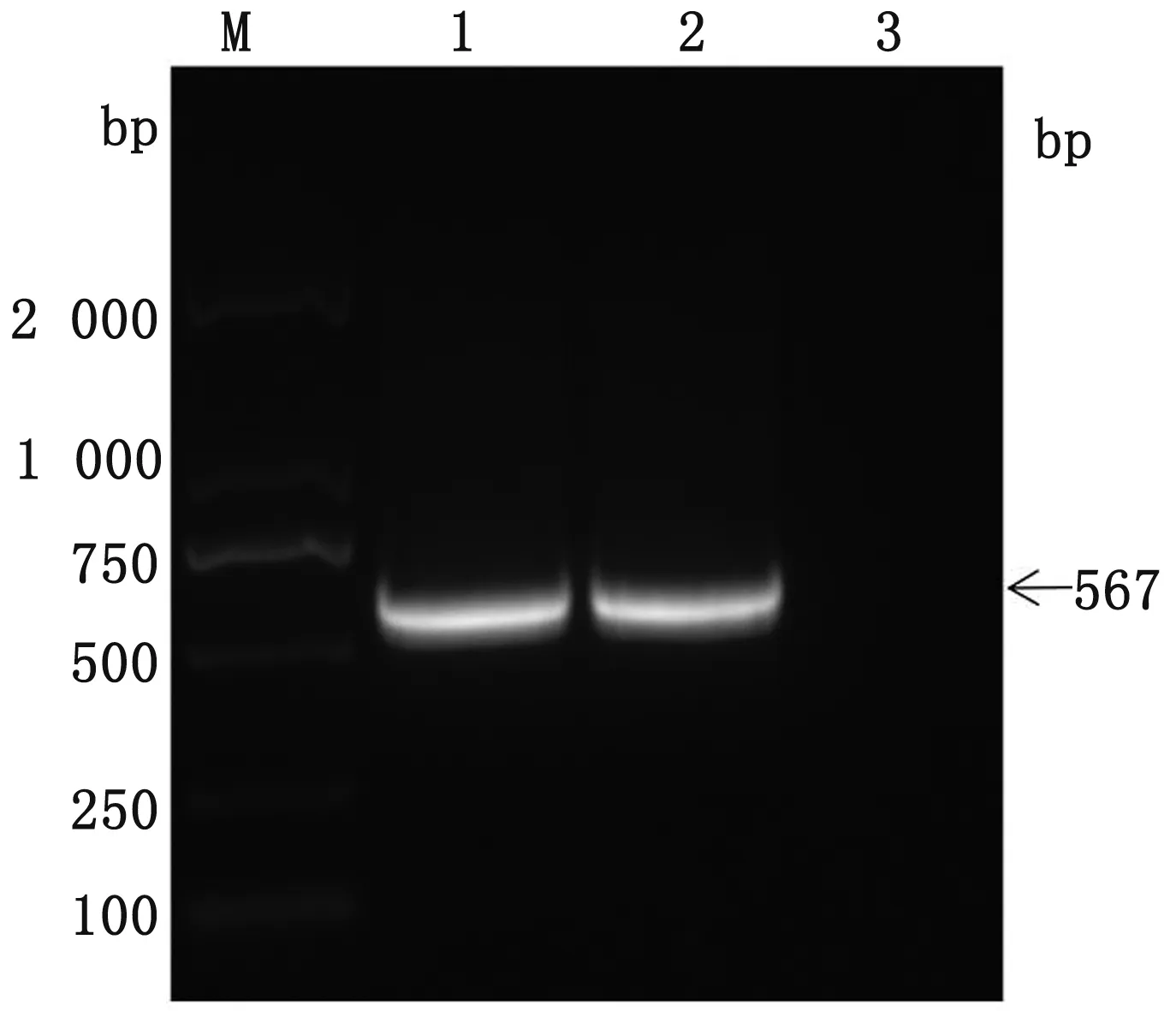
M.DL2000 DNA Marker;1,2.PCV4 Cap基因PCR擴增產物;3.空白對照
2.2 pET28a-PCV4-Cap 重組質粒的構建與鑒定將擴增的PCV4Cap基因片段與pET-28a載體連接,獲得重組質粒后,將質粒經BamHⅠ與XhoⅠ限制性內切酶進行雙酶切鑒定,結果顯示載體與目的基因分別出現(xiàn)在預期位置,PCV4Cap基因成功連接至pET-28a載體(圖2)。同時將重組質粒進行測序,測序結果顯示,連接至載體的PCV4Cap基因,無堿基突變與缺失。
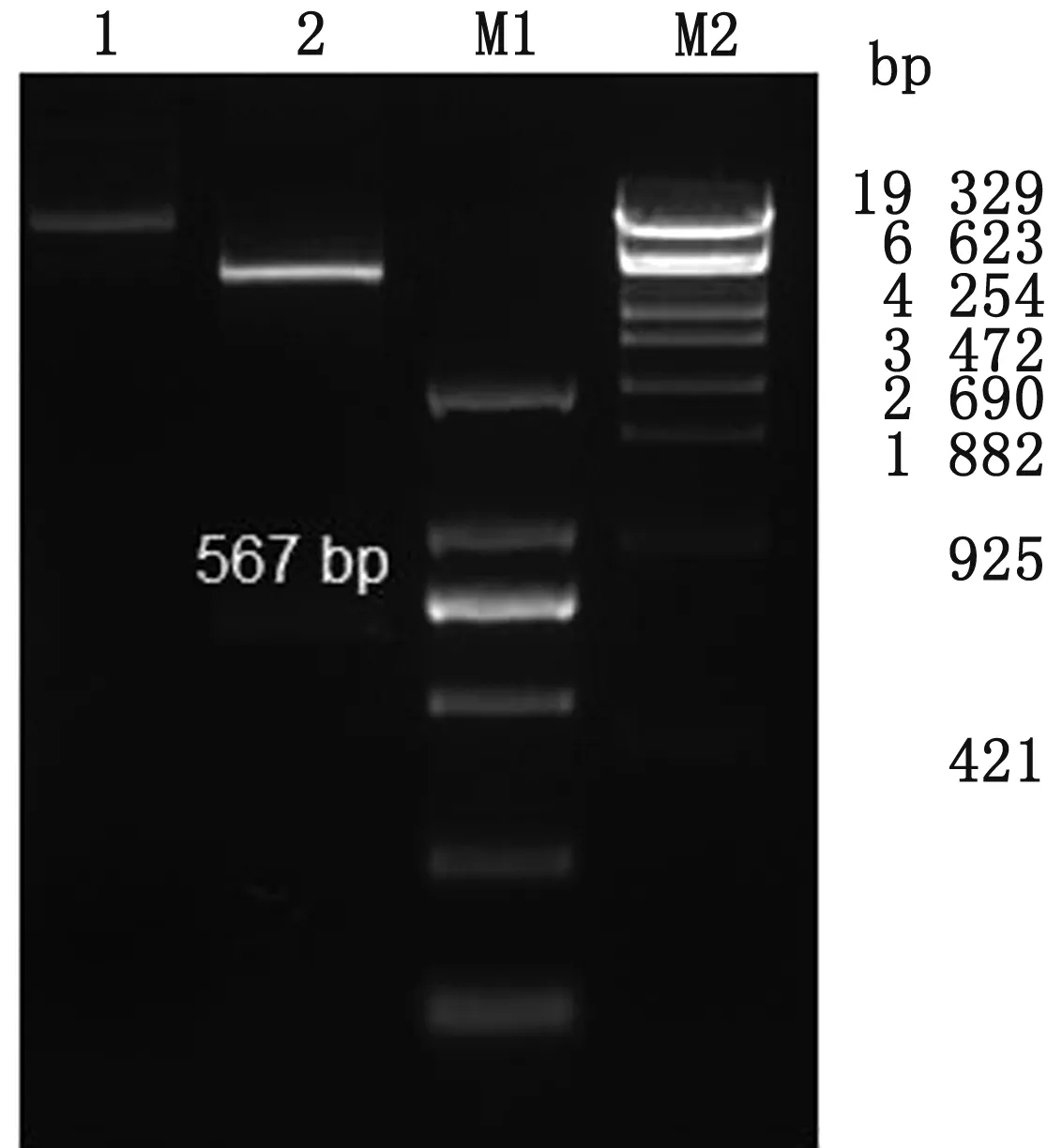
1.pET28a-PCV4-Cap重組質粒;2.pET28a-PCV4-Cap質粒酶切產物;M1.DL2000 DNA Marker;M2.λ-EcoT14 I digest Marker
2.3 pET28a-PCV4-Cap重組蛋白表達條件優(yōu)化
2.3.1優(yōu)化最適表達溫度 將重組菌分別置于26,37℃條件下誘導表達6 h,SDS-PAGE電泳結果顯示26℃幾乎沒有蛋白表達,pET28a-PCV4-Cap重組蛋白在37℃條件下,表達量更高,更適宜表達(圖3)。
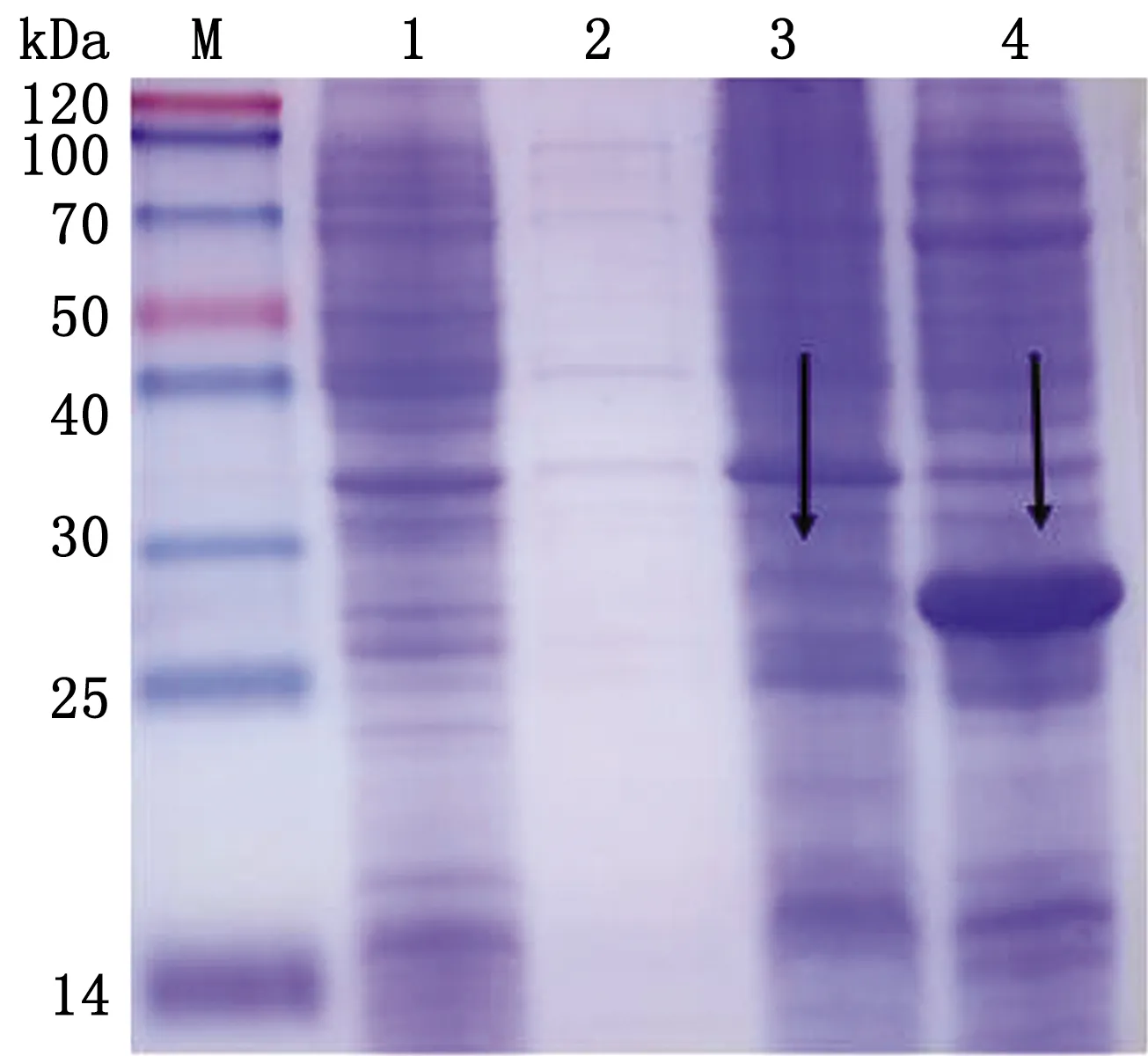
M.Blue PlusⅡProtein Marker;1.pET-28a空載體蛋白;2.重組蛋白誘導前;3.26℃誘導pET28a-PCV4-Cap蛋白表達;4.37℃誘導pET28a-PCV4-Cap蛋白表達
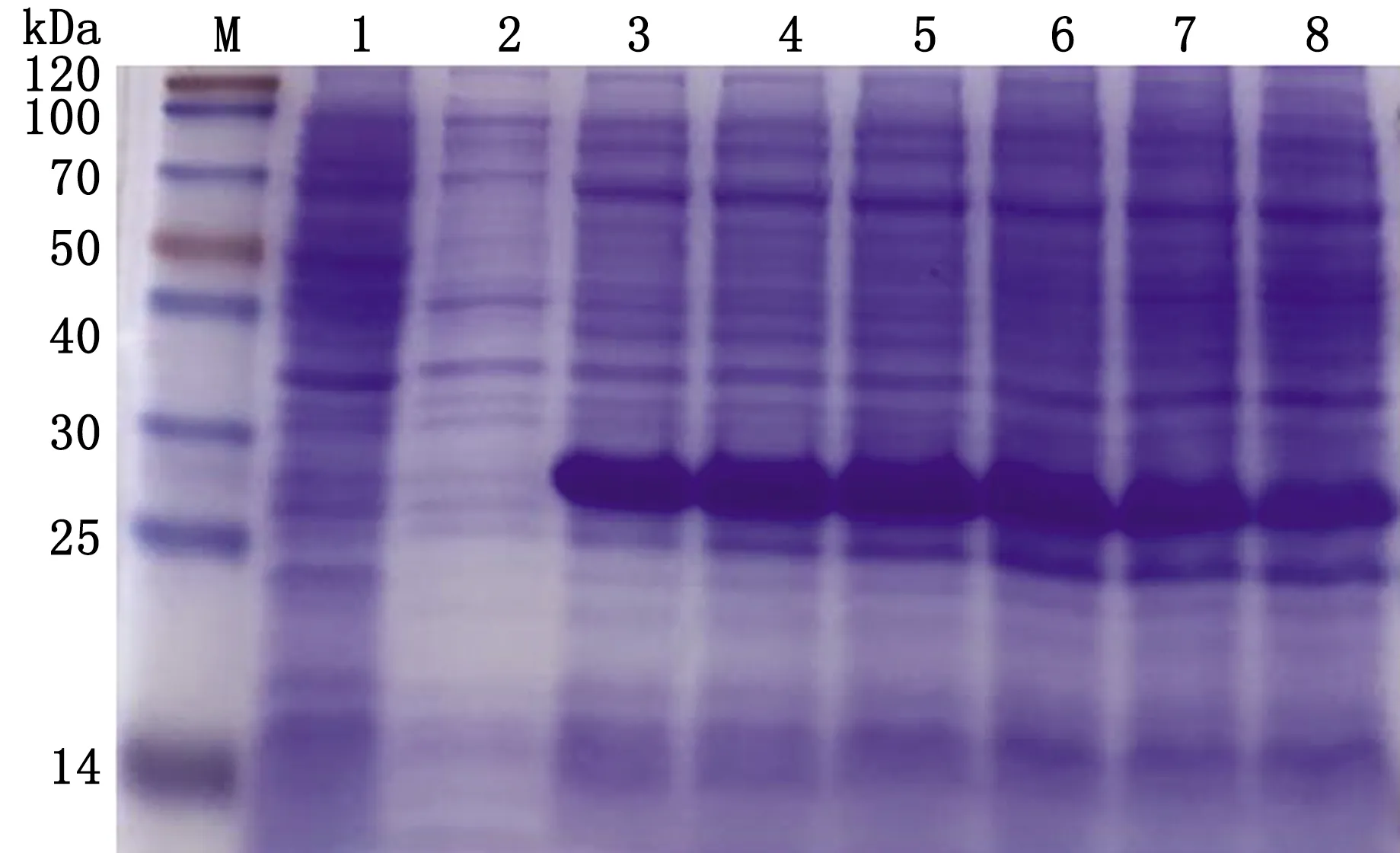
2.3.2優(yōu)化最佳IPTG誘導濃度 將重組菌于37℃條件下,分別加入終濃度為0.2,0.4,0.6,0.8,1.0 mmol/L 的IPTG進行誘導,結果顯示在0.2 mmol/L 的IPTG條件下,pET28a-PCV4-Cap重組蛋白就已經呈現(xiàn)很高的表達量,而后的幾個IPTG濃度梯度與0.2 mmol/L濃度IPTG誘導相比并無明顯變化。從節(jié)約成本的方面進行考慮,故選取0.2 mmol/L的IPTG為最佳誘導濃度(圖4)。

M.Blue PlusⅡ Protein Marker;1.pET-28a空載體蛋白;2~7.誘導濃度分別為0.0,0.2,0.4,0.6,0.8,1.0 mmol/L
2.3.3優(yōu)化最佳誘導時間 于37℃、0.2 mmol/L IPTG誘導條件下,分別在誘導后0,2,4,6,8,10,12 h,取不同時間段取等量菌液,制蛋白樣品,通過SDS-PAGE電泳進行比較,發(fā)現(xiàn)在誘導后6 h時蛋白的表達量最高(圖5)。
M.Blue PlusⅡ Protein Marker;1.pET-28a空載體蛋白;2~8.誘導時間分別為0,2,4,6,8,10,12 h
2.4 pET28a-PCV4-Cap重組蛋白表達形式驗證收集誘導后菌體,5 000 r/min離心10 min后,用適量PBS重懸菌體沉淀,低溫條件下超聲,使用600 W 功率,超聲5 s,間歇7 s,總計15 min。4℃條件下,5 000 r/inm 離心10 min,沉淀用與上清等量PBS重懸,分別取上清與沉淀制備蛋白樣后,SDS-PAGE電泳顯示,pET28a-PCV4-Cap蛋白均以包涵體形式表達(圖6)。
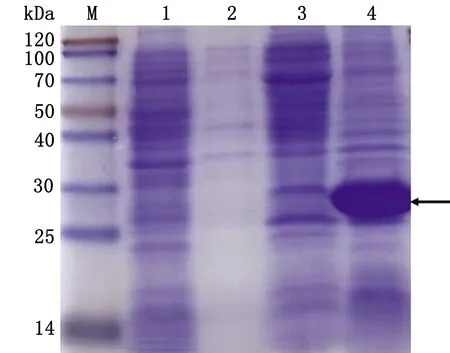
M.Blue PlusⅡ Protein Marker;1.pET-28a空載體蛋白;2.pET28a-PCV4-Cap蛋白誘導前;3.pET28a-PCV4-Cap蛋白超聲上清;4.pET28a-PCV4-Cap蛋白超聲沉淀
2.5 重組蛋白誘導表達Western blot驗證收取誘導后菌液,進行Western blot驗證。結果顯示,重組蛋白在誘導前具有少量表達,通過誘導后能夠出現(xiàn)大量表達,在約27 kDa處出現(xiàn)單一條帶,與預期結果相同(圖7)。
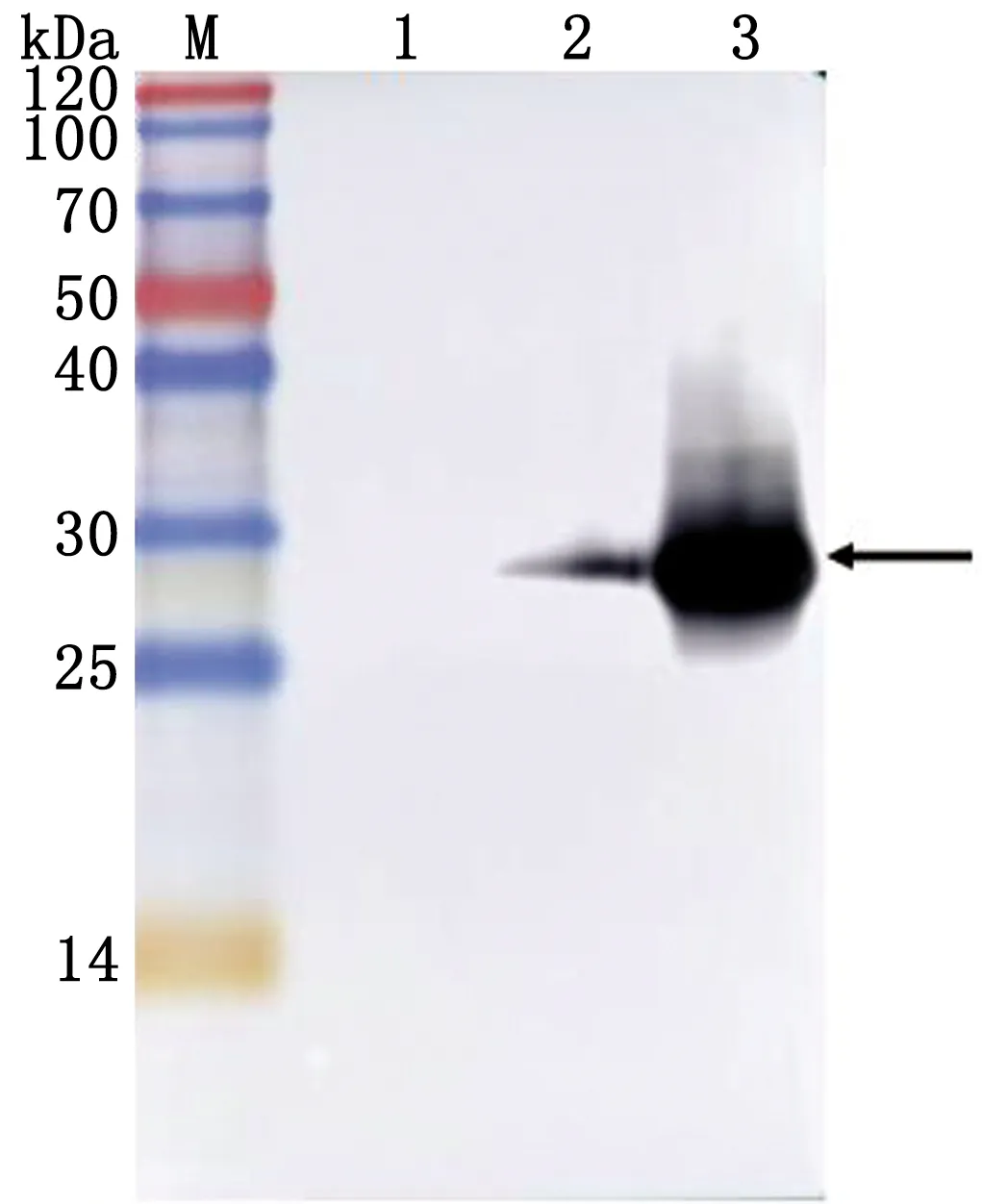
M.Blue PlusⅡ Protein Marker;1.pET-28a空載體蛋白;2.重組蛋白誘導前;3.重組蛋白誘導后
3 討論
2016年國際病毒分類學委員會更新的圓環(huán)病毒科分類標準表明,圓環(huán)病毒屬內物種劃分的標準是全基因組核苷酸同源性小于80%[8]。通過Cap和Rep蛋白完整的基因組及核苷酸序列分析,進一步證明了PCV4屬于單獨的進化枝,是圓環(huán)病毒屬中一個獨立基因型。通過對PCV4 Cap與Rep蛋白的氨基酸預測,顯示其與水貂圓環(huán)病毒的同源性最高,而與PCV1、PCV2、PCV3的氨基酸同源性低于50%[4]。PCV1的非致病性與PCV2的致病性已經充分被證實,在有呼吸疾病和腹瀉豬中,PCV3檢出率和病毒滴度都較高,預示PCV3與這些臨床疾病的出現(xiàn)有一定的相關性,且PCV3能夠在健康的動物中檢測出來[9]。PCV4既可以單獨檢測,也可以在同時感染了PRRSV或PCV2的豬體內被檢測出來。大多數(shù)被檢測的豬都呈現(xiàn)嚴重的臨床癥狀,包括呼吸系統(tǒng)疾病、腸炎和豬皮炎與腎病綜合征。但是,PCV4 DNA也已在健康豬中檢測出來[4]。在2019年中國學者通過感染性克隆,研究了PCV3的致病性,但至今為止也沒有可以在細胞中進行穩(wěn)定傳代的PCV3毒株被分離出來。
到目前為止,PCV4的存在時間、感染率、流行情況及致病性并不明確,而Cap蛋白作為PCV的唯一結構蛋白,在病毒的感染與復制中起著至關重要的作用,所以對PCV4 Cap蛋白展開研究,對接下來PCV2、PCV3與PCV4的Cap蛋白之間是否可以提供交叉保護,通過PCV4 Cap蛋白的表達,建立PCV4抗體水平的檢測方法,都具有重大意義。
原核表達系統(tǒng)和真核表達系統(tǒng)是當今研究較多的,兩者各有優(yōu)缺點,而目前原核表達系統(tǒng)研究最為透徹,其中大腸桿菌表達系統(tǒng)是外源基因表達的首選,但是表達的外源目的蛋白大多為包涵體[10]。原核表達系統(tǒng)具有試驗成本較低、周期短、轉化率高且能夠獲得大量目的蛋白的優(yōu)點[11],所以本試驗選擇大腸桿菌表達系統(tǒng)對pET28a-PCV4-Cap重組蛋白進行表達,主要以包涵體的形式表達出約為27 kDa的重組蛋白,并對其表達條件進行了優(yōu)化。本試驗結果顯示,加入終濃度0.2 mmol/L IPTG誘導6 h為最優(yōu)誘導表達條件,重組蛋白表達量最高。
本試驗通過成功構建重組表達質粒表達pET28a-PCV4-Cap重組蛋白,為PCV4病毒Cap蛋白的深入研究與PCV4單克隆及多克隆抗體的制備及血清學特異性檢測方法的建立提供了依據(jù)。

