銅電極電解不同濃度食鹽水的實驗探究
于 寧
(遼寧省大連經濟技術開發區第二中學 116600)
國內現行教材大都采用石墨電極作為陽極進行電解飽和食鹽水實驗.蘇教版選修教材《實驗化學》專題5的拓展實驗采用了銅電極(用銅絲作為陰陽兩極)電解飽和食鹽水.受此啟發,將此實驗裝置“放大”,并將飽和食鹽水更換為不同濃度的食鹽水進行實驗,得到更多有趣的現象.
一、實驗裝置
教材中拓展實驗裝置如圖1所示.將此裝置“放大”——試管放大為燒杯,銅絲放大為銅棒,如圖2所示.
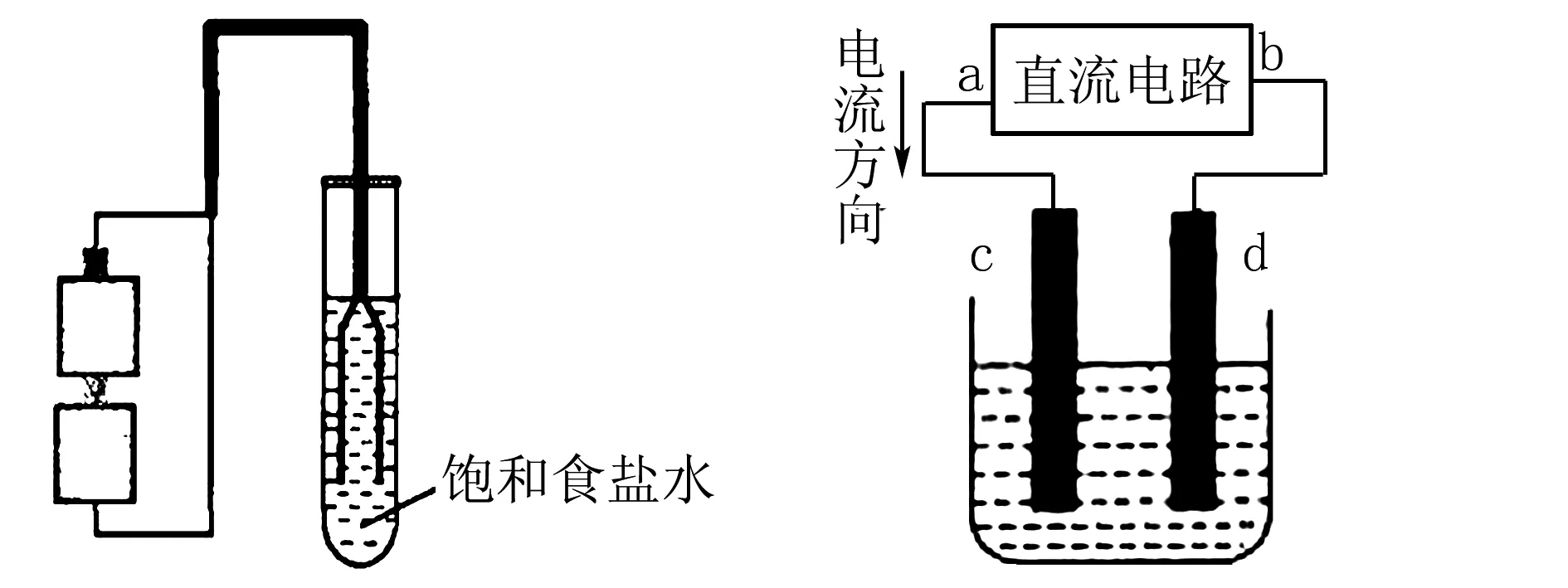
圖1 圖2
二、實驗操作、現象及解釋
向大燒杯中分別注入飽和食鹽水、體積比V(飽和食鹽水)∶V(蒸餾水)=5∶1、5∶2、5∶3的溶液、蒸餾水,調節電壓為1.5V.記錄剛出現白色沉淀的時間,觀察兩極沉淀物的顏色及生成的先后順序.
1.兩電極的實驗現象及解釋
銅電極電解不同濃度食鹽水的兩電極的實驗現象是相同的,即:
(1)電解發生后,陰極立即有無色氣體放出,且源源不斷.
(2)陽極銅絲逐漸“溶解”,由粗變細;結束電解時取出觀察其紫紅色光澤不變.
對現象的解釋如下:
(1)陰極總反應:2H2O+2e-→2OH-+H2↑(還原反應)
(2)銅電極露出的部分被“溶解”后仍為銅,故仍有金屬光澤.
2.溶液中的實驗現象及解釋[陽極銅“溶解”后的最終存在形式(+1價、+2價)的探究]
陽極金屬放電都易生成相對穩定的離子.正如Fe-2e-→Fe2+(如果生成Fe3+則被Fe還原為Fe2+)一樣,銅放電的初產物為:Cu-2e-→Cu2+.那么陽極生成的Cu2+最終會以怎樣的形式存在呢?實驗表明,銅放電的初產物Cu2+最終的存在形式與Cl-濃度密切相關.將其反應過程分為3個階段,如圖3所示.
圖3
(1)電解飽和食鹽水
理論上發生A、B、C,由于動力學因素,只發生A,故溶液未出現白色沉淀,直接由澄清變為黃色沉淀.
陽極反應:Cu-2e-→Cu2+
Cu2++Cu+4Cl-→2[CuCl2]-
陽極總反應:Cu-e-+2Cl-→[CuCl2]-
因Cl-濃度很大,使Cu2+全部生成無色的[CuCl2]-,故始終(約15分鐘)沒有觀察到白色沉淀.當陰極產生的OH-移動到陽極附近時,有:[CuCl2]-+OH-→CuOH↓(黃色)+2Cl-;2CuOH(黃色)→Cu2O(磚紅色)+H2O.橙色沉淀是CuOH、Cu2O的混合物.因此約15分鐘時,在陽極銅周圍看到黃色沉淀,繼而迅速轉變為橙色和磚紅色.
(2)電解高濃度不飽和食鹽水
理論上發生A、B、C,由于動力學因素,只發生A、B,故溶液需等待較長時間才能出現白色沉淀,繼而變黃.
陽極反應:Cu-2e-→Cu2+
Cu2++Cu+4Cl-→2[CuCl2]-
Cu2++Cu+2Cl-→2CuCl↓
陽極總反應:2Cu-2e-+3Cl-→[CuCl2]-+CuCl↓
因Cl-濃度大,使Cu2+先生成無色的[CuCl2]-,再生成CuCl↓,故需等待較長時間(170秒)才能觀察到白色沉淀.逐漸增多的白色沉淀CuCl與陰極生成的OH-相遇時,生成更難溶的黃色沉淀CuOH(CuCl、CuOH的溶度積分別為1.2×10-6和1.0×10-14),即:CuCl+OH-→CuOH+Cl-,且2CuOH(黃色)→Cu2O(磚紅色)+H2O.因此白色沉淀片刻后變為黃色、橙色、磚紅色.
(3)電解中等濃度不飽和食鹽水
實際上發生A、B、C,故溶液需等待一會兒便可出現白色沉淀,再有藍色沉淀(少量)生成,白色沉淀繼而變黃.
陽極反應:Cu-2e-→Cu2+
Cu2++Cu+4Cl-→2[CuCl2]-
Cu2++Cu+2Cl-→2CuCl↓
陽極總反應:
5Cu-6e-+6Cl-→Cu2++2[CuCl2]-+2CuCl↓
因Cl-濃度較大,使Cu2+先生成無色的[CuCl2]-,再生成CuCl↓,故需等待一會兒(48秒)才能觀察到白色沉淀且白色沉淀量逐漸增多.Cl-消耗完后,Cu2+“顯露”出來,與陰極OH-生成藍色絮狀沉淀Cu(OH)2,且Cu2+移動至陰極的速度比OH-移動至陽極的速度快,因此藍色沉淀產生在陰極附近.由于“顯露”出的Cu2+量很少,故產生的藍色沉淀量很少.量較多的白色沉淀逐漸變為黃色、橙色、磚紅色.
(4)電解低濃度不飽和食鹽水
實際上發生B、C,故溶液很快就出現白色沉淀,再有藍色沉淀(大量)生成,少量的白色沉淀繼而變黃.
陽極反應:Cu-2e-→Cu2+
Cu2++Cu+2Cl-→2CuCl↓
陽極總反應:3Cu-4e-+2Cl-→Cu2++2CuCl↓
因Cl-濃度小,使Cu2+直接生成CuCl↓,故很快(21秒)就能觀察到白色沉淀.由于“顯露”出的Cu2+量很多,故產生的藍色沉淀量很多.量較少的白色沉淀逐漸變為黃色、橙色、磚紅色.
(5)電解純凈的蒸餾水
實際上發生C,故溶液有大量的藍色沉淀生成,由于動力學因素,反應很緩慢,需等待很長時間.
三、實驗結論
由上述現象可推出以下三個結論:
1.電解飽和食鹽水和蒸餾水的過程中始終不會出現白色沉淀;而電解高、中、低濃度的不飽和食鹽水的過程中均會產生白色沉淀,且白色沉淀生成的速度逐漸加快,等待時間越來越短(實驗測得從電解開始到產生白色沉淀的時間分別為170秒、48秒、21秒),最終生成的磚紅色沉淀量越來越少.
2.電解飽和食鹽水和高濃度不飽和食鹽水最終都只產生磚紅色沉淀(大量);電解中等濃度不飽和食鹽水、低濃度不飽和食鹽水和純凈的蒸餾水最終都有藍色沉淀生成,且藍色沉淀的量越來越多.剛出現藍色沉淀(極少量)對應的不飽和食鹽水中Cl-的濃度便是臨界濃度.
3.對臨界Cl-濃度從理論上無法計算出(因不知Cu2+的濃度),故從實驗現象推測臨界濃度的范圍:體積比V(飽和食鹽水)∶V(蒸餾水)為5∶1的溶液電解結束后只有磚紅色沉淀生成,而體積比V(飽和食鹽水)∶V(蒸餾水)=5∶2的溶液電解結束后除有大量的磚紅色沉淀生成之外,還有少量藍色沉淀出現.因此推測臨界Cl-濃度必定在V(飽和食鹽水)∶V(蒸餾水)為5∶1到5∶2之間,且接近于5∶2(也就是說,推測臨界Cl-濃度必定對應的是中等濃度的不飽和食鹽水).若想進一步更深入地了解精確的臨界Cl-濃度,可配制體積比V(飽和食鹽水)∶V(蒸餾水)=5∶1到5∶2之間的不同濃度的不飽和食鹽水進行再次探究.

