桂枝附子湯調控TXNIP/NLRP3/caspase-1通路抑制軟骨細胞焦亡的機制研究
楊洋,梅勝,辛龍
骨關節炎是最常見的老年慢性疾病之一,隨著社會老齡化的加劇和肥胖率的上升,骨關節炎的發病率逐年提高,已經給我國帶來了嚴重的經濟負擔和社會負擔[1]。晚期骨關節炎患者可以進行關節置換手術治療,然而,由于關節置換術后的功能恢復可能較差,并且假體有一定的壽命限制[2],因此更多研究的重點轉移到骨關節炎的預防和早期治療。目前有研究提出了骨關節炎相關的發病因素,比如遺傳性、衰老、肥胖等,但是骨關節炎的發病機理仍不明確[3]。研究表明,細胞焦亡在骨關節炎的病理過程中發揮著不可忽視的作用[4]。因此,通過藥物抑制細胞焦亡可能是一種潛在的治療骨關節炎方法。我國中醫藥是治療骨關節炎的傳統手段,具有不良反應小、藥效緩及多靶向整體作用等優勢[5],為骨關節炎現代臨床的藥物治療提供了新的思路。桂枝附子湯是《傷寒路》中的經典方劑,臨床常用于骨關節炎的治療,但其具體作用機制尚不明確[6]。因此,本研究通過探究桂枝附子湯調控TXNIP/NLRP3/caspase-1通路抑制軟骨細胞細胞焦亡的作用機制,以期為桂枝附子湯治療骨關節炎的臨床應用提供理論依據。
1 資料與方法
1.1 試劑 桂枝附子湯由浙江省立同德醫院提供;軟骨細胞由浙江省骨骼肌肉退變與再生修復轉化研究重點實驗室提供;DMEM/高糖培養基購自美國Gibco公司;胎牛血清購自德國Serana公司;MTT試劑盒購自上海MCE公司;LDH試劑盒、Hoechst/PI染色購武漢巴菲爾生物科技有限公司;TXNIP、NLRP3、caspase-1、IL-1和-actin購自上海abcam公司。
1.2 方法
1.2.1 桂枝附子湯制備與質控 桂枝附子湯由桂枝12 g、附子15 g、生姜9 g、紅棗12枚及甘草6 g組成,全方水煎,濃縮去渣。以HPLC制備全方指紋圖譜,分別用各味藥對照品進行定性定量分析,建立質量控制標準。
1.2.2 軟骨細胞培養 軟骨細胞用含體積分數10%胎牛血清、1%青霉素、1%鏈霉素的DMEM/高糖培養基培養,并置于37℃、5%CO2的恒溫培養箱中培養。
1.2.3 MTT檢測細胞活性 取5×104的細胞接種至96孔板中,分別用0、10、20、50、100及200mol/L濃度的桂枝附子湯干預軟骨細胞48h。每孔加入5mg/ml MTT溶液20l,避光培養4 h;棄上清,每孔加入150l DMSO溶液,震蕩10 min,自動酶標讀數儀比色,測定其吸光值(波長490 nm),計算各組軟骨細胞活性。以未進行干預的軟骨細胞為對照組,使用不同濃度枝附子湯溶液干預的軟骨細胞為試驗組。細胞活性(%)=實驗組吸光值/對照組吸光度均值×100%。
1.2.4 OGD/R模型建立軟骨細胞 用Earle's平衡鹽溶液培養,置于37℃,1%O2、5%CO2和94%N2的培養箱中培養12 h,然后用DMEM/高糖培養基培養,置于37℃、5%CO2的恒溫培養箱中培養24 h。
1.2.5 細胞分組 將軟骨細胞分為對照組、OGD/R組、低劑量桂枝附子湯組(10mol/L)、高劑量桂枝附子湯組(100mol/L)進行研究分組。
1.2.6 微量酶標法檢測軟骨細胞LDH釋放量 各組軟骨細胞接種于96孔板,進行相應干預后。加入60l LDH檢測液混勻,在避光條件下搖床孵育30 min。將細胞培養板用多孔板離心機1 600 r/min離心5 min。分別取各孔的上清液120l,加入到新的96孔板相應孔中,酶標儀檢測各孔的吸光度(波長490 nm)。分別測定OGD/R組、低劑量桂枝附子湯組、高劑量桂枝附子湯組軟骨細胞LDH相對釋放量。LDH釋放量=實驗組吸光值/對照組吸光度均值。
1.2.7 Hoechst33342/PI染色法檢測軟骨細胞細胞焦亡 將細胞培養于6孔板中,分別對各組細胞進行干預。PBS洗滌3次,將Hoechst33342溶液、PI溶液和細胞染色緩沖液以1∶1∶200比例混勻形成工作液,每孔加入1 ml工作液,4°C避光反應30 min,PBS洗滌3次后熒光顯微鏡下觀察各組軟骨細胞焦亡情況。
1.2.8 RT-PCR檢測軟骨細胞mRNA表達 按Trizol試劑盒說明書進行,在20l反應體積中進行。42℃固定浴60 min,99℃固定浴5 min,-20℃保存備用。引物擴增設計:根據Genebank序列,設計各個引物序列并合成,引物序列見表1。使用SYRB Premix ExTaqTM和ABI 7900擴增儀進行熒光擴增;分析計算CT值,檢測各組軟骨細胞TXNIP、NLRP3、caspase-1和IL-1 mRNA的表達水平。

表1 PCR引物序列
1.2.9 Western Blotting法檢測軟骨細胞蛋白表達提取軟骨細胞蛋白,用聚丙烯酰胺凝膠電泳分離蛋白,轉膜。在TBS-T液內清洗,加5%脫脂奶粉,37℃封閉1h。封閉結束后,用TBS-T稀釋3次,并置于TBS-T 4℃震蕩過夜。TBS-T液漂洗PVDF膜3次,將膜與TBS-T稀釋二抗孵育,室溫下振蕩1h;TBST漂洗PVDF膜3次,隨后顯影、定影,用圖像分析系統測定蛋白條帶的光密度,進行定量分析TXNIP、NLRP3、caspase-1和IL-1蛋白表達水平。
1.3 統計方法 采用SPSS 22.0軟件進行分析,計量資料以均值±標準差表示,采用單因素方差分析和獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 不同濃度桂枝附子湯對軟骨細胞活性的影響10、20、50及100mol/L桂枝附子湯處理后,軟骨細胞活性較0mol/L差異均無統計學意義(均P>0.05),200mol/L桂枝附子湯能明顯降低軟骨細胞活性(P<0.05)。見表2。
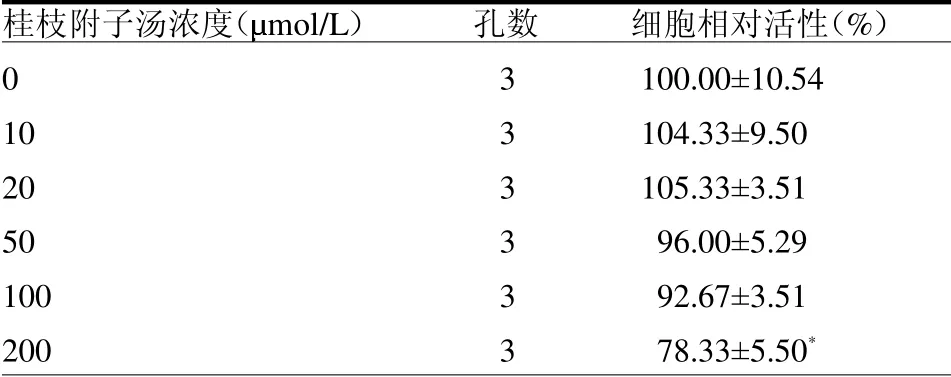
表2 不同濃度桂枝附子湯對軟骨細胞活性的影響
2.2 桂枝附子湯降低軟骨細胞LDH釋放量 OGD/R組軟骨細胞LDH釋放量較對照組顯著升高(P<0.05),而低劑量桂枝附子湯組和高劑量桂枝附子湯組軟骨細胞的LDH釋放量較OGD/R組均明顯降低(均P<0.05)。見表3。

表3 桂枝附子湯對軟骨細胞LDH釋放量的影響
2.3 桂枝附子湯降低PI陽性軟骨細胞數量 與對照組相比,OGD/R組PI陽性軟骨細胞數明顯上升(P<0.05),而經不同濃度桂枝附子湯處理后,PI陽性軟骨細胞數較OGD/R組顯著降低(P<0.05)。見封二彩圖1和表4。

表4 桂枝附子湯對軟骨細胞細胞焦亡的影響
2.4 桂枝附子湯抑制TXNIP、NLRP3、caspase-1和IL-1 mRNA的表達 與對照組相比,OGD/R組軟骨細胞TXNIP、NLRP3、caspase-1和IL-1 mRNA表達顯著升高(均P<0.05);而低劑量桂枝附子湯組和高劑量桂枝附子湯組軟骨細胞TXNIP、NLRP3、caspase-1和IL-1 mRNA表達較OGD/R組顯著降低(均P<0.05)。見表5。

表5 桂枝附子湯對軟骨細胞mRNA表達的影響
2.5 桂枝附子湯抑制TXNIP、NLRP3、caspase-1和IL-1蛋白水平的表達 與對照組相比,OGD/R組軟骨細胞TXNIP、NLRP3、caspase-1和IL-1蛋白表達顯著升高(均P<0.05);而經不同濃度桂枝附子湯處理后,TXNIP、NLRP3、caspase-1和IL-1蛋白表達明顯降低(均P<0.05)。見封二彩圖2、表6。
3 討論
骨關節炎一種常見的高致殘率、低治愈率的慢性關節疾病,主要病變是關節軟骨的退行性變和繼發性骨質增生[1]。目前,臨床上常用于治療骨關節炎的藥物有阿片類鎮痛藥、非甾體類抗炎藥、甾體類抗炎藥及解熱鎮痛藥等[7]。然而盡管這類藥物能緩解骨關節炎疼痛癥狀,但無法減緩骨關節炎的退變進程[8]。
中醫藥是我國治療骨關節病的傳統手段,具有不良反應小、藥效緩和、多靶向整體作用等優勢[5]。骨關節炎常以關節疼痛、膠著為主要臨床表現,屬于痹證中營衛不和、寒濕阻痹證的范疇[9]。桂枝附子湯包含桂枝、附子、生姜、紅棗及甘草成分,具有祛濕通絡、溫經通陽、調和營衛、補益肝腎及活血化瘀等作用[10]。然而由于中醫藥方和骨關節炎病理的復雜性,桂枝附子湯治療骨關節病的具體機理尚未明確闡明。本實驗通過探究TXNIP/NLRP3/caspase-1通路,表明桂枝附子湯可以抑制軟骨細胞細胞焦亡,這可能是桂枝附子湯治療骨關節炎的機制之一。有趣的是,筆者發現小劑量(10、20mol/L)的桂枝附子湯可以增加軟骨細胞活性,這表明桂枝附子湯中有成分能促進軟骨細胞增殖,然而高劑量的桂枝附子湯卻抑制軟骨細胞活性,這可能是高濃度藥物的毒副作用導致的。
炎癥和細胞死亡是骨關節炎的兩個主要特性[11]。細胞焦亡是近年來被證實的一種伴隨炎癥發生的程序性細胞死亡方式。有研究表明,細胞焦亡在骨關節炎的病理過程中發揮著至關重要的作用[6]。TXNIP/NLRP3/caspse-1通路是細胞焦亡的一條重要通路[12]。在骨關節炎氧化應激的條件下,TXNIP將被激活,從胞核轉位到胞質,結合并激活NLRP3受體,促進NLRP3炎性小體的形成。NLRP3炎性小體是由NLRP3、pro-caspase-1和凋亡相關的斑點樣蛋白(ASC)所組成的蛋白復合物,能進一步激活caspse-1。活化的caspase-1誘導IL-1成熟、釋放,募集炎癥細胞聚集,誘發級聯放大的炎癥反應[13]。本研究通過ODG/R方法建立軟骨細胞焦亡模型,分別用10、20mol/L的桂枝附子湯處理軟骨細胞后,LDH 釋放試驗和Hoechst33342/PI染色法均證明桂枝附子湯能抑制軟骨細胞細胞焦亡。此外,RT-PCR和westernblot結果進一步表明桂枝附子湯能通過調節TXNIP/NLRP3/caspse-1通路抑制細胞焦亡。
綜上所述,桂枝附子湯能調控TXNIP/NLRP3/caspase-1通路抑制軟骨細胞焦亡,為臨床上桂枝附子湯治療骨關節炎提供了理論依據。

