老年慢性心力衰竭病人血清和肽素水平與炎癥因子和心室重構的相關性
蔡婕 韋偉 張郁青
CHF是各種病因導致心臟舒縮功能障礙,心排血量不足、心臟負荷增加,并引起病人血流動力學異常的一種心臟循環障礙癥候群[1]。CHF常見于老年冠心病、心肌梗死、心肌病等多類心血管疾病的終末階段,具有預后較差且致死率較高的特點,對老年病人的生命安全構成了嚴重的威脅[2]。早期診斷CHF并進行有針對性的治療,對緩解CHF病人病情,改善其預后具有重要意義。有研究表明,血清和肽素(CPP)預測聯合終點事件與死亡的價值較BNP更高[3]。另有研究發現,炎癥反應是導致老年CHF持續進展的重要因素,其參與了CHF發生、發展的全過程,對早期輔助診斷CHF亦具有積極的臨床意義[4]。本研究探討老年CHF病人血清CPP水平與炎癥因子hs-CRP、TNF-α、IL-6水平和心室重構的相關性,報道如下。
1 資料與方法
1.1 研究對象 選取2018年7月至2019年7月于本院就診收治的83例老年CHF病人作為研究對象(CHF組),另選取同期于本院行健康體檢的46例老年體檢健康者作為對照組。CHF組中男47例,女36例;年齡67~78歲,平均(72.64±2.98)歲; BMI為22~30,平均23.78±2.86;基礎性心臟病類型:高血壓性心臟病27例、冠心病30例、瓣膜性心臟病6例、擴張型心臟病7例,其他類型心臟病13例。對照組男26例,女20例;年齡66~77歲,平均(71.24±2.92)歲;BMI為23~31,平均24.08±2.67。2組研究對象上述一般資料比較,差異均無統計學意義,具有可比性(P>0.05)。納入標準:(1)臨床癥狀與診斷標準參照中華醫學會心血管病學分會對CHF的診斷[5];(2)年齡>60歲且心臟彩超提示為CHF者;(3)LVEF<45%、心功能Ⅱ級以上者[6]。排除標準:(1)伴有意識障礙等存在交流障礙者;(2)伴有嚴重肝損或腎功能不全者;(3)伴有惡性腫瘤或急、慢性感染及已使用相關抗感染藥物者;(4)為急性心力衰竭、急性心肌梗死或縮窄性心包炎等其他心臟疾病者。所有研究對象均簽署知情同意書。
1.2 檢測指標 所有研究對象均于晨起采集空腹肘靜脈血5 mL, 3000 r/min離心10 min,分離血清后置于-80 ℃環境下備用。
1.2.1 血清CPP:使用廣州易錦生物技術有限公司提供的ELISA試劑盒,嚴格按照說明書進行檢測[7]。
1.2.2 血清炎癥因子:使用北京北方生物制劑研究所提供的試劑盒,嚴格按照說明書采用放射免疫法對血清炎癥因子hs-CRP、TNF-α、IL-6水平進行檢測[8]。
1.2.3 心室重構相關指標:使用美國GE公司提供的Vivid-7型彩色多普勒超聲診斷儀對心室重構相關指標LVEF、左心房內徑(LAD)、左心室舒張末期內徑(LVEDD)進行檢測,其中LVEF采用Simpson法進行計算[9]。
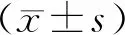
2 結果
2.1 2組血清CPP及炎癥因子水平比較 CHF組血清CPP、hs-CRP、TNF-α、IL-6水平均高于對照組,差異具有統計學意義(P<0.01)。見表1。
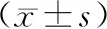
表1 2組血清CPP及炎癥因子水平比較
2.2 2組心室重構相關指標比較 CHF組病人的LAD、LVEDD均高于對照組,而LVEF低于對照組,差異均具有統計學意義(P<0.01)。見表2。
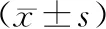
表2 2組心室重構相關指標比較
2.3 CHF組病人血清CPP、炎癥因子水平與心室重構相關指標的相關性分析 Pearson相關分析顯示,CHF組病人的血清CPP、hs-CRP、TNF-α、IL-6水平與LAD均呈正相關,與LVEDD亦呈正相關,而與LVEF均呈負相關。見表3。
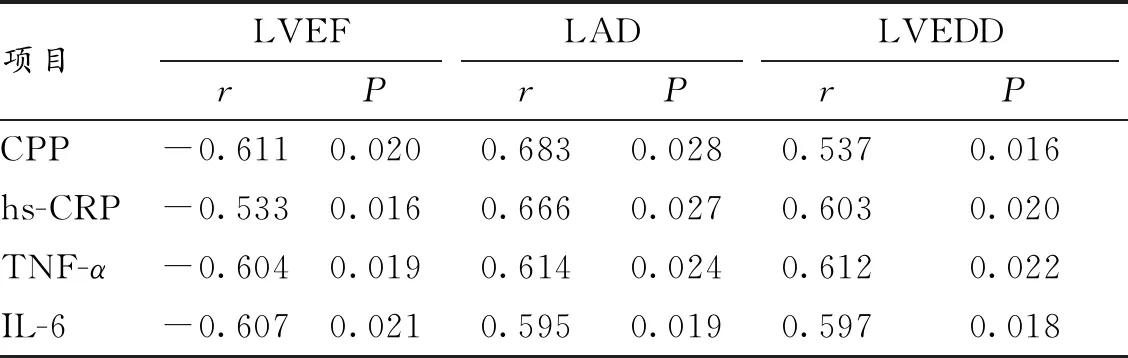
表3 CHF組血清CPP水平、炎癥因子水平與心室重構相關指標的相關性分析
3 討論
CHF已成為老年心血管疾病病人中發病率及病死率最高的疾病。老年病人往往同時合并多種病因及其他臟器功能異常,使臨床表現具有復雜性、隱匿性、并發癥較多等特點,給臨床診斷也帶來了較多的困難。
血清CPP是抗利尿激素原C末端的部分肽段,為血管加壓素(AVP)的前體物質。與AVP相比,血清CPP具有在常溫下保存時間長、穩定性更好且檢測更方便的優點[10]。有研究表明,對于心力衰竭(心衰)病人,血清CPP水平可比BNP、心肌肌鈣蛋白T(cTnT)更快、更早地發生變化,且隨著心衰嚴重程度的升級而增高,因而對CPP水平的檢測可作為早期診斷急慢性心衰病人、評估CHF病人病情嚴重程度及判斷其預后的重要標志物[11]。本研究結果顯示,CHF組病人的血清CPP水平明顯較對照組高,且血清CPP水平與心室重構相關指標LAD、LVEDD呈正相關而與LVEF呈負相關,說明出現CHF后,病人的血清CPP水平顯著增高,提示可將血清CPP水平檢測作為診斷CHF病人的重要參考指標。
炎癥因子介導了CHF的發生且參與了心肌細胞肥大、凋亡、纖維化的全過程,可推動心衰病情的演進及炎癥細胞因子的合成與釋放[12]。血清CRP是在血清TNF-α、IL-6等相關炎癥因子刺激下由肝臟細胞、活化的巨噬細胞等合成與分泌的一種細胞因子,臨床常用于評估機體炎癥反應的程度。而hs-CRP較單純的CRP能更靈敏地反映機體炎癥反應[13]。血清TNF-α可通過介導氧化應激反應使心肌細胞肥大、凋亡、纖維化,進而出現心臟的功能障礙,最終轉變為心衰[14]。血清IL-6可通過與特異性受體結合而激活心肌細胞內的信號轉導受體復合物,進而對細胞毒性及負性肌力起到調控作用[15]。本研究結果顯示,CHF組病人的血清hs-CRP、TNF-α、IL-6水平均較對照組明顯升高,且血清hs-CRP、TNF-α、IL-6水平均和LAD、LVEDD呈正相關,而與LVEF呈負相關,提示CHF的發生與血清炎癥因子hs-CRP、TNF-α、IL-6水平密切相關,故而亦可將血清hs-CRP、TNF-α、IL-6檢測作為診斷CHF病人的重要參考指標。
心室重構是CHF演進的重要過程及病理機制,而心功能受損、心臟順應性降低、心腔擴大等是心室重塑的重要體現,在超聲檢查中對LVEF、LAD、LVEDD進行測量可反映心室重構的嚴重程度[16]。本研究結果顯示,CHF組病人的心室重構相關指標LAD、LVEDD水平均較對照組高,而LVEF水平較對照組低,提示當出現CHF時,心臟彩超檢查亦可在一定程度上為CHF的診斷提供參考依據。
由于樣本量較小,本研究并未開展心功能分級后的多組對比分析,因而無法判斷其與病情嚴重程度及預后的關系。若要進一步全面、深入的分析,還需本領域相關工作者在未來的工作中投入大量的工作開展更為詳盡的研究。
綜上,CHF病人血清CPP水平與炎癥因子hs-CRP、TNF-α、IL-6水平異常升高,且與心室重構相關,檢測血清CPP水平與炎癥因子hs-CRP、TNF-α、IL-6水平對CHF病人的臨床診斷具有重要的輔助作用。

