感染伯氏瘧原蟲小鼠外周血淋巴細(xì)胞及其表面分子的檢測
鄭貴星,陳冰霞,張夢欣,金晨曦,謝世豪,齊艷偉
(1.廣州醫(yī)科大學(xué)附屬第一醫(yī)院 輸血科,廣州 511436;2.廣州醫(yī)科大學(xué) 第三臨床學(xué)院,廣州 511436;3.廣州醫(yī)科大學(xué) 病原生物學(xué)與免疫學(xué)教研室,廣州 511436)
瘧疾是由瘧原蟲引起的傳染性蟲媒病,其發(fā)生發(fā)展由宿主和寄生蟲的相互作用引起,包括微血管中紅內(nèi)期寄生蟲受到的物理阻隔和寄生蟲在宿主體內(nèi)生長、傳播過程中釋放的有毒產(chǎn)物誘發(fā)的局部和全身炎癥[1]。另外,機(jī)體也會(huì)作出一定的反應(yīng)進(jìn)行自我防御,這種保護(hù)是通過細(xì)胞和體液免疫效應(yīng)機(jī)制介導(dǎo)的,尤其是體液免疫,其對疾病血液階段的發(fā)展至關(guān)重要[2]。例如,B細(xì)胞產(chǎn)生的抗瘧疾特異性抗體在限制血液階段寄生蟲繁殖和延緩疾病進(jìn)展及阻止寄生蟲全面感染中發(fā)揮關(guān)鍵作用[3]。
小鼠外周血B細(xì)胞、T細(xì)胞和NK細(xì)胞等免疫細(xì)胞百分比可反映機(jī)體免疫應(yīng)答水平。其中,NK細(xì)胞主要存在于外周血中,其發(fā)揮殺傷作用不受外周血抗體等影響[4]。相關(guān)研究顯示,NK細(xì)胞參與宿主抗瘧原蟲感染[5],且在伯氏瘧原蟲(Plasmo-diumberghei)血液感染時(shí)期含量下降[6]。
作為趨化因子成員之一的CXCR3,有CXCR3-A、CXCR3-B、CXCR3-alt 3種亞型,可在B細(xì)胞、T細(xì)胞、CD8+T細(xì)胞、NK細(xì)胞、單核細(xì)胞等免疫細(xì)胞中表達(dá)[7]。CXCR3配體可通過參與激活MAPK、AKT等多種信號通路發(fā)揮免疫功能[8];此外,其可與多種配體結(jié)合參與免疫細(xì)胞的遷移和功能發(fā)揮[9]。CD69是細(xì)胞表面的一種二聚體蛋白,可在B細(xì)胞、T細(xì)胞等免疫細(xì)胞中表達(dá)[10]。CD69在激活后的免疫細(xì)胞表面迅速被表達(dá)以增加機(jī)體IL-2R水平、促進(jìn)Th1型細(xì)胞因子分泌等參與免疫細(xì)胞的增殖活化等過程[11]。CD62L是選擇素家族成員之一,主要在淋巴細(xì)胞、單核細(xì)胞等免疫細(xì)胞中表達(dá)[12],其可參與調(diào)節(jié)免疫細(xì)胞浸潤免疫器官、腫瘤局部、炎癥部位等協(xié)助機(jī)體發(fā)揮免疫保護(hù)作用[13]。
WHO《2018年世界瘧疾報(bào)告》顯示,2017年全球共有瘧疾病例2.19億例,死亡人數(shù)也高達(dá)43.5萬人。而我國2018年的瘧疾數(shù)據(jù)表明已無本地感染病例出現(xiàn),99.0%的瘧疾病例來源于境外輸入[14]。這些數(shù)據(jù)也說明全球的瘧疾形勢仍不容樂觀。同時(shí),目前東南亞使用的抗惡性瘧原蟲感染的一線藥物青蒿素已出現(xiàn)了一定的抗藥性[15],這更為人類全面消除瘧疾帶來嚴(yán)峻考驗(yàn)。因此,現(xiàn)許多學(xué)者致力于瘧疾疫苗的研究。目前,針對瘧原蟲的發(fā)育周期,相關(guān)疫苗主要分為三大類,分別是肝期瘧疾疫苗、血液階段瘧疾疫苗以及蚊媒期的傳播阻斷疫苗[16]。雖然仍未有瘧疾疫苗投入臨床使用,但這也是防治瘧疾的一大有效途徑。另外,還可以通過控制病媒預(yù)防瘧疾,主要措施有使用殺蟲劑處理過的蚊帳和室內(nèi)殘留噴霧劑噴灑[17]。為此,本研究檢測小鼠B細(xì)胞、T細(xì)胞、CD8+T細(xì)胞和NK細(xì)胞百分比及其表面分子CXCR3、CD69、CD62L的表達(dá)水平變化,探索C57BL/6小鼠外周血循環(huán)中不同的免疫細(xì)胞及其表面分子在伯氏瘧原蟲感染后的功能狀態(tài),以此為學(xué)界探究瘧原蟲的致病機(jī)制和研發(fā)血液階段疫苗提供新的證據(jù)與參考。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物6~8周齡SPF級C57BL/6小鼠,10只,雌性,20~25 g,購自廣州中醫(yī)藥大學(xué)實(shí)驗(yàn)動(dòng)物中心;伯氏瘧原蟲ANKA株,由廈門大學(xué)李劍博士惠贈(zèng),于廣州霍夫曼免疫研究所長期保存。
1.2 試劑與儀器Hank's液、PBS和紅細(xì)胞裂解液,購自生工生物工程(上海)股份有限公司;RPMI 1640基礎(chǔ)培養(yǎng)液和FBS,購自Thermo Fisher Scientific公司;小鼠抗CD19-PerCP-Cy5.5、抗CD3-FITC和抗NK1.1-PE-Cy7流式抗體,購自BioLegend公司;小鼠抗CD8-APC-Cy7、抗CD69-Pacific Blue、抗CD62L-APC和抗CXCR3-PE流式抗體,購自Abcam公司。FACSCalibur流式細(xì)胞儀,來自美國貝克曼庫爾特公司。
1.3 方法
1.3.1 模型鼠的培養(yǎng) 于標(biāo)準(zhǔn)SPF環(huán)境中(溫度20~26 ℃,相對濕度40%~70%)飼養(yǎng)模型鼠,自由飲食飲水。將10只C57BL/6小鼠隨機(jī)均分為感染組和對照組(n=5);予感染組小鼠尾靜脈注射106個(gè)伯氏瘧原蟲(用100 μL生理鹽水稀釋),予對照組小鼠尾靜脈注射等量生理鹽水。實(shí)驗(yàn)操作過程符合廣州醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物倫理委員會(huì)要求。
1.3.2 樣本的采集 于感染第6天(Day 6, D6)自小鼠眼眶后靜脈叢取血1.5 mL,置于離心管中,加入200 μL抗凝劑,充分搖勻,置冰上備用。
1.3.3 小鼠外周血免疫細(xì)胞懸液的制備 將采集的外周血與1 mL Hank's液混合,將所得的細(xì)胞懸液轉(zhuǎn)移至離心管,600×g離心5 min后棄上清液并重懸。用Hank's液漂洗2次后,每500 μL加入5 mL常溫紅細(xì)胞裂解液裂解紅細(xì)胞,于室溫條件下靜置5 min。分別加入5 mL Hank's液終止裂紅,600×g離心5 min,棄上清液。加入5 mL Hank's液重懸后,600×g離心5 min,棄上清液。將細(xì)胞沉淀轉(zhuǎn)移至RPMI 1640培養(yǎng)液中,用1 mL 5% FBS重懸,通過血細(xì)胞計(jì)數(shù)板計(jì)算免疫細(xì)胞密度。
1.3.4 小鼠外周血免疫細(xì)胞亞群和細(xì)胞因子水平的檢測 調(diào)整細(xì)胞密度至每孔100 μL混懸液中含1.5×106個(gè)細(xì)胞,用200 μL PBS漂洗后600×g離心5 min并棄上清液,用100 μL/孔PBS重懸。按照試劑盒說明書將適量流式抗體加至細(xì)胞懸液中,進(jìn)行15 s的渦旋振蕩(混合抗體和細(xì)胞)。于4 ℃避光條件下孵育30 min,加入2 mL PBS終止染色并離心(600×g,5 min),棄上清液后漂洗細(xì)胞1次;用250 μL上機(jī)液重懸細(xì)胞。FACS檢測染色細(xì)胞,通過CytExpert軟件分析并得出檢測結(jié)果。
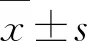
2 結(jié)果
2.1 兩組小鼠外周血B、T、CD8+T細(xì)胞和NK細(xì)胞百分比的比較分離兩組小鼠外周血并制備單細(xì)胞懸液,F(xiàn)ACS檢測B細(xì)胞(CD3-CD19+)、T細(xì)胞(CD3+CD19-)、CD8+T細(xì)胞(CD3+CD8+)和NK細(xì)胞(CD19-CD3-NK1.1+)百分比。結(jié)果顯示,感染組小鼠外周血B細(xì)胞水平顯著低于對照組[(7.28±0.57)%vs(44.49±4.31)%,P<0.01,圖1A、1D];感染組小鼠T細(xì)胞、CD8+T細(xì)胞和NK細(xì)胞百分比與對照組相比差異不顯著[(33.26±6.65)%vs(35.99±3.45)%,(17.86±5.34)%vs(14.61±3.86)%,(13.32±1.92)%vs(11.75±1.64)%,均P>0.05,圖1]。

注: A. 兩組小鼠外周血B細(xì)胞和T細(xì)胞百分比FACS結(jié)果;B. 兩組小鼠外周血CD8+T細(xì)胞百分比FACS結(jié)果;C. 兩組小鼠外周血NK細(xì)胞百分比FACS結(jié)果;D. 兩組小鼠外周血免疫細(xì)胞百分比統(tǒng)計(jì)結(jié)果。**P<0.01。
2.2 兩組小鼠外周血免疫細(xì)胞表面CXCR3表達(dá)水平的比較FACS結(jié)果顯示,感染組小鼠外周血B細(xì)胞、T細(xì)胞表面CXCR3表達(dá)水平顯著高于對照組[(10.52±0.65)%vs(5.46±1.59)%,(25.44±5.67)%vs(12.45±0.23)%,均P<0.05,圖2A、2C];感染組NK細(xì)胞表面CXCR3表達(dá)水平顯著低于對照組[(2.33±0.23)%vs(5.42±1.37)%,P<0.05,圖2B、2C];感染組CD8+T細(xì)胞表面CXCR3表達(dá)水平比對照組高,但差異無統(tǒng)計(jì)學(xué)意義[(30.13±6.40)%vs(21.29±0.60)%,P>0.05,圖2A、2C]。

注:A. 兩組小鼠外周血B細(xì)胞、T細(xì)胞和CD8+T細(xì)胞表面CXCR3表達(dá)水平比較;B. 兩組小鼠外周血NK細(xì)胞表面CXCR3表達(dá)水平比較;C. 兩組小鼠外周血免疫細(xì)胞表面CXCR3表達(dá)水平統(tǒng)計(jì)結(jié)果。*P<0.05。
2.3 兩組小鼠外周血免疫細(xì)胞表面CD69表達(dá)水平的比較FACS結(jié)果顯示,感染組小鼠外周血T細(xì)胞、CD8+T細(xì)胞和NK細(xì)胞表面CD69表達(dá)水平顯著高于對照組[(25.89±1.89)%vs(1.68±0.56)%,(20.43±3.91)%vs(2.34±1.05)%,(34.58±1.67)%vs(5.28±1.04)%,均P<0.001,圖3];而感染組小鼠B細(xì)胞表面CD69表達(dá)水平高于對照組,但差異無統(tǒng)計(jì)學(xué)意義[(38.83±2.24)%vs(15.29±15.12)%,P>0.05,圖3A、3C]。

注:A. 兩組小鼠外周血B細(xì)胞、T細(xì)胞和CD8+T細(xì)胞表面CD69表達(dá)水平比較;B. 兩組小鼠外周血NK細(xì)胞表面CD69表達(dá)水平比較;C. 兩組小鼠外周血免疫細(xì)胞表面CD69表達(dá)水平統(tǒng)計(jì)結(jié)果。***P<0.001。
2.4 兩組小鼠外周血免疫細(xì)胞表面CD62L表達(dá)水平的比較FACS結(jié)果顯示,感染組小鼠外周血B、T細(xì)胞、CD8+T細(xì)胞和NK細(xì)胞表面CD62L表達(dá)水平顯著低于對照組[(32.62±5.73)%vs(92.31±0.49)%,(2.60±0.50)%vs(76.33±8.34)%,(1.80±0.51)%vs(88.07±2.63)%,(0.25±0.06)%vs(14.69±2.37)%,均P<0.001,圖4]。

注:A. 兩組小鼠外周血B細(xì)胞、T細(xì)胞和CD8+T細(xì)胞表面CD62L表達(dá)水平比較;B. 兩組小鼠外周血NK細(xì)胞表面CD62L表達(dá)水平比較;C. 兩組小鼠外周血免疫細(xì)胞表面CD62L表達(dá)水平統(tǒng)計(jì)結(jié)果。***P<0.001。
3 討論
有研究表明,在感染伯氏或約氏瘧原蟲后,小鼠脾臟T細(xì)胞百分比明顯下降[18-19]。本研究中,小鼠外周血T細(xì)胞百分比下降不顯著,筆者考慮可能是T細(xì)胞在不同組織中的免疫功能狀態(tài)存在差異所致。另外,CD4+T細(xì)胞與CD8+T細(xì)胞比值的合理是機(jī)體免疫功能穩(wěn)定的一個(gè)重要支點(diǎn)[20]。在同樣感染伯氏瘧原蟲的條件下,小鼠脾臟CD8+T細(xì)胞水平明顯下降,其表達(dá)的CD69水平上升而CD62L下降[18]。本研究中,外周血CD8+T細(xì)胞變化不明顯,可能與組織樣本不同有關(guān),而外周血CD8+T細(xì)胞表達(dá)的CD69、CD62L變化趨勢與其相同,有關(guān)因素還需進(jìn)一步研究。此外,CD4+T細(xì)胞和B細(xì)胞協(xié)同作用產(chǎn)生的抗體是機(jī)體抵抗瘧原蟲紅內(nèi)期感染的關(guān)鍵免疫成分[21]。本研究中,小鼠感染伯氏瘧原蟲后外周血B細(xì)胞百分比顯著下降(P<0.01),而其他細(xì)胞沒有明顯變化,考慮伯氏瘧原蟲感染后D6外周血B細(xì)胞可能增殖受抑而不能有效發(fā)揮抗感染免疫。
在伯氏瘧原蟲ANKA蟲株感染模型中,脾臟會(huì)一定程度上調(diào)T細(xì)胞表面分子CXCR3表達(dá)[6]。本研究中,小鼠感染伯氏瘧原蟲后外周血B細(xì)胞和T細(xì)胞的CXCR3分子表達(dá)水平顯著提高(均P<0.05),而其在NK細(xì)胞中表達(dá)則顯著下降(P<0.05),提示感染伯氏瘧原蟲后,機(jī)體可通過特異性提高免疫細(xì)胞CXCR3表達(dá)發(fā)揮一定的抗感染作用。
之前有研究證實(shí),小鼠腸系膜淋巴結(jié)可提高NK細(xì)胞、NKT細(xì)胞等分泌CD69抵抗日本血吸蟲感染[22]。B細(xì)胞可在多種致病菌感染條件下表達(dá)CD69,如金黃色葡萄球菌感染[23];且有研究表明,外周血免疫細(xì)胞CD69表達(dá)水平與新生兒早期感染有一定關(guān)系[24-25]。本研究表明,感染伯氏瘧原蟲后小鼠外周血T細(xì)胞、CD8+T細(xì)胞和NK細(xì)胞等CD69表達(dá)水平顯著提高(均P<0.001),提示機(jī)體可能通過促進(jìn)固有和適應(yīng)性免疫細(xì)胞表面CD69的表達(dá)抵抗瘧原蟲感染。在蘭巧芬等[26]的研究結(jié)果中,類風(fēng)濕關(guān)節(jié)炎患者體內(nèi)CD62L表達(dá)水平提高,其促進(jìn)了嗜堿性粒細(xì)胞向特定組織遷移從而參與致病。此外研究表明,CD62L可能對臨床應(yīng)用中T細(xì)胞的篩選有積極幫助,或可拓寬CAR-T細(xì)胞的應(yīng)用范圍并有利于抗腫瘤治療[26]。
由本研究可知,伯氏瘧原蟲感染后小鼠外周血B細(xì)胞、T細(xì)胞、CD8+T細(xì)胞和NK細(xì)胞表面CD62L表達(dá)水平顯著降低(均P<0.001),提示寄生蟲感染后機(jī)體或通過下調(diào)免疫細(xì)胞CD62L表達(dá)一定程度上抑制免疫細(xì)胞的免疫功能和遷移過程。

