差速離心法提取血小板來源的外泌體及其鑒定
陳文科,操龍斌,陳雨薇,馮杰娥
南方醫科大學南海醫院醫學檢驗科,廣東佛山 528244
多種細胞在正常及病理狀態下均可分泌外泌體。其主要來源于細胞內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中,主要分布于細胞上清液,例如血漿、血清等。外泌體內含有豐富的蛋白質、mRNA等,因此能夠廣泛參與細胞間的物質交換。人體正常狀態下,血液中血小板來源的微粒占據所有微粒的70%以上。近年來,成分輸血逐漸引起了醫學界的重視和關注,成為了治療腫瘤患者的重要措施,外泌體不僅在細胞間信息傳遞發揮著重要作用,而且在腫瘤治療、藥效研究等眾多領域具有關鍵作用[2]。對于血小板來源外泌體的提取與鑒定的研究具有重要價值,對于日后血小板的研究具有借鑒指導意義[3]。該次于2020年6—9月期間,方便選取實驗樣本100份展開研究,現報道如下。
1 材料與方法
1.1 檢測儀器
該次實驗所需的檢測儀器以及試劑:超速離心機:WX100;離心水平轉頭:SW32TI;透射電鏡:LVEM25;全能型化學發光成像系統;血小板震葛儀:PL-11;BCA蛋白質定量試劑盒;HSP70抗體ALXI抗體。
1.2 樣本來源
方便選取該市血站2019年內獻血志愿者捐贈的單采血小板,獻血者均符合中華人民共和國衛生部所規定的獻血者健康標準,檢驗合格后在血小板震蕩儀上進行保存留用[4]。
1.3 樣本處理
選擇當天采集的同一單采血小板樣本,分A、B、C、D、E共5組,3袋/組, 其中A、B組分別標為A1、A2、A3、B1、B2、B3號。A組在血小板振蕩器上存放1 d后進行提取,B組在血小板振蕩器上震蕩存放3 d后進行提取;C、D、E組在振蕩器存放1 d,離心,C組上直接提取外泌體,D組(不加任何試劑)、E組(加入5%的DMSO)-80℃凍存3 d后提取外泌體[5]。
1.4 外泌體提取
①將震蕩的血小板裝入15 mL無菌離心管中,4℃,500 g離心力條件下離心10 min,棄沉淀;
②將上一步離心所得的上清裝入新的15 mL無菌離心管中,4℃,1 500 g離心力離心10 min,棄沉淀[6]。
③將上一步離心所得的上清液裝入新的15 mL無菌離心管中,4℃,3 200 g離心15 min,可見血小板沉淀至管底,棄上清。
④將上一步離心所得的沉淀用1 mL PBS溶液重懸,再裝入新的1 mL無菌離心管中,加入0.1 U/mL凝血酶,37℃孵育15 min,得到完全激活的血小板。
⑤將激活的血小板4℃,3 200 g離心15 min,可見血小板沉淀于離心管底,取上清[7]。
⑥將上一步離心所得的上清液放入1 mL無菌離心管中,用預冷的PBS溶液1 mLA重懸后,4℃,110 000 g離心力條件下離心90 min,棄上清后,用200 L的PBS溶液重懸,-80℃保存備用[8]。
1.5 外泌體鑒定
1.5.1 透射電鏡檢測外泌體形態及大小 取分離提取的外泌體各20μl重懸液于塑料薄膜上。將銅網狀物翻轉到液滴表面,放置10 min[9]。然后,將銅網狀物轉移到1%的戊二醛液滴中,液體慢慢地被濾紙吸收,用雙蒸餾水滴將銅網清洗3次,3 min/次,再用濾紙將銅網上的液體慢慢吸收,此時液體不能完全吸收干凈,對此使用白熾燈照射10 min。等銅網充分干燥時將銅網轉移到樣品區,并在80 kV透射電子顯微鏡下觀察[10]。
1.5.2 免疫印跡法驗證 首先,選取之前分離備好的外泌體20μl,兩管分別加入體積相同的RIPA細胞裂解液(含1%PMSF),裂解30 min后進行離心操作,時長5 min。隨后取適量上清液加人適量的4×蛋白上樣緩沖液,煮沸10 min。取處理后外泌體樣本各10μl于12%SDS-PAGE凝膠上電泳,結束后轉移蛋白至PVDF膜上,采用200 mA的恒定電流,轉膜80 min[11]。轉膜結東后,用5%脫脂奶粉封閉PVDF膜2 h,再加入HSP70抗體ALXI抗體一抗。搖床上孵育1 h,再TBST洗膜4次,每次清洗4 min加二抗,最后在膜上加入適量ECL化學發光液,并用全能型化學發光成像系統分析即可。
1.5.3 外泌體總蛋白濃度測定 取分離提取的外泌體各20μl,并分別加入20μl RIPA細胞裂解液(含1%PMSF),冰上裂解30 min,1 000 rpm離心5 min;分別取25μl新鮮配置的BSA標準液和處理后外泌體樣本,加入到96孔板中;再每孔加入200μl新鮮配置的BCA工作液;加蓋,37C孵育30 min,在562 nm處檢測各孔的吸光度值后換算。
2 結果
2.1 透射電鏡下外泌體的形態
隨著保存時間的增加,單采血小板來源外泌體的含量也在增加。見圖1。
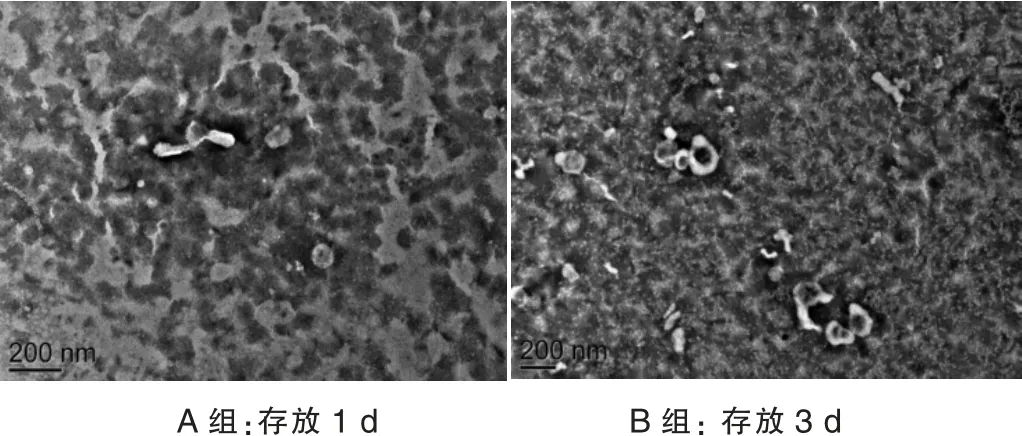
圖1 透射電鏡下血小板源外泌體的形態
2.2 外泌體免疫印跡法驗證結果
血小板來源外泌體蛋白標志驗證。見圖2。
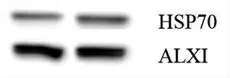
圖2 血小板源外泌體蛋白標志驗證
2.3 不同保存時間對單采血小板來源外泌體的蛋白濃度的影響
實驗樣本100份。存放3 d的血小板源外泌體蛋白質的濃度為(1 096.1±10.5)μg/mL,存放1 d的的血小板源外泌體蛋白質的濃度為(709.5±9.5)μg/mL,存放時間長的血小板來源外泌體的蛋白質濃度明顯高于存放天數短的。差異有統計學意義(t=273.030,P<0.001),見圖3。未凍存組蛋白濃度(1 820.1±10.5)μg/mL明顯高于不含DMSO凍存組(1 155.3±2.5)μg/mL和含5%DMSO凍存組(1 402.5±6.2)μg/mL,差異有統計學意義(t=615.930、342.470,P<0.05),見圖4。
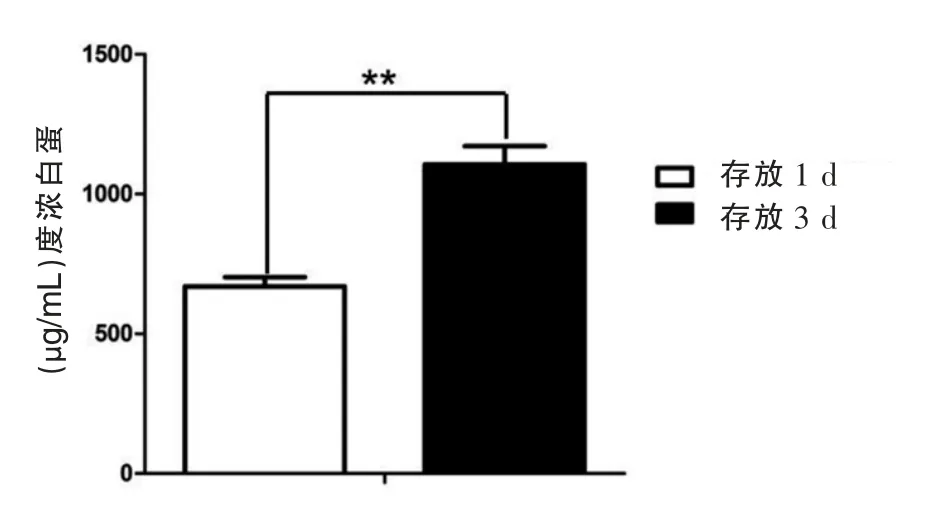
圖3 不同保存時間的血小板源外泌體總蛋白提取量
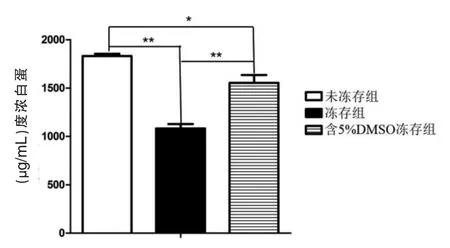
圖4 不同樣本保存方式下血小板源外泌體總蛋白提取量
3 討論
外泌體的提取方式有許多,其中超速離心法提取物的提取純度比較大,提取量可觀,同時便于操作且成本低廉,因此該研究采用超速離心法進行提取,對于影響單采血小板來源外泌體的影響因素進行了探討,其他方式不予探究。
在外泌體的提取過程中,處理提取純度,提取量也是關鍵問題。在該次實驗中,首先研究了不同存放時間對于血小板來源外泌液的影響,實驗結果得存放3 d的血小板源外泌體蛋白質的濃度為 (1 096.1±10.5)μg/mL,存放1 d的的血小板源外泌體蛋白質的濃度為(709.5±9.5)μg/mL,顯示存放1 d的單采血小板的外泌液濃度明顯低于存放3 d的(P<0.05)。程驍赪等人[11]研究結果顯示存放3 d的血小板源外泌體蛋白質的濃度為(1 100.4土9.6)μg/mL,存放1 d的的血小板源外泌體蛋白質的濃度為(707.3±9.6)μg/mL。表明實驗結果較為準確。這是由于在存放過程中,血小板不斷釋放外泌液。也就是隨著存放時間的增加,血小板活化增加,釋放的微粒也隨之增加[12]。
在醫學操作中,所有樣本不可能做到取樣后直接完全采取使用,因此凍存樣本是必不可少的過程,但是目前還沒有關于凍存對樣品的影響相關方面的報道。所以,在該次研究中進行了關于冷凍條件對外泌液提取產量的影響,實驗結果表明,經過冷凍處理的樣本其外泌體提取產量會明顯少于冷凍之前。其原因是冷凍后融化會導致外泌體破裂,超速離心法又難以得到破碎后的外泌體,使得提取產量嚴重較少。細胞凍存是細胞培養、引種、保種和保證實驗順利進行的重要技術手段。DMSO是一種常見的細胞凍存液的組成成分,DMSO在4℃時對細胞無明顯毒性,分子量小、溶解度大、易透過細胞膜,降低細胞外未結冰溶液中溶質濃度,使細胞免受高濃度溶質的損傷,細胞內水分也不會過分外滲,避免了細胞過分脫水皺縮;DMSO與水分子結合,可使冰點下降,減少細胞內冰晶的形成,從而減少冰晶損傷。在該次研究中加入5%的DMSO能夠有效保護細胞,提升血小板分泌液提取物產量。
綜上所述,樣本保存時間越長,外泌體的提取量越多;冷存處理會降低外泌體的提取量,而DMSO能夠有效保護細胞。該次研究對于血小板來源外泌體提取與鑒定的影響因素做出了指示,為日后線管工作的開展指明了道路。

