多參數彌散加權成像在直腸癌術前T分期中的應用價值
陳玉坤 張紹婷 沈 浮 王敏杰 陸建平
結直腸癌(colorectal cancer,CRC)是最常見的消化道惡性腫瘤之一。過去10年中,隨著結腸鏡檢查的普及,CRC在發達國家中的發病率迅速下降,但是55歲以下成年人的發病率卻在以每年2%的速度增長,并且在中國其總體發病率呈上升趨勢[1-3],其中直腸癌是我國CRC中比例最高的一種類型,占49.66%[1]。直腸癌的術前評估非常重要,術前準確判斷直腸癌的T分期是合理制訂治療方案的關鍵,目前主要依靠MRI檢查,一般僅在形態學上對腫瘤進行術前評估。但MRI常規序列在區分T2期(侵犯固有肌層)與早期T3期(侵出肌層并侵犯直腸系膜)直腸癌時并無優勢[4],不能明確區分腸周索條狀異常信號是腫瘤腸外侵犯還是局部結締組織增生性反應[5],因此這類分期錯誤是最為常見的。
彌散加權成像(diffusion weighted imaging,DWI)是目前唯一能無創反映活體組織內水分子彌散特性的成像技術,可以間接反映腫瘤組織細胞密度、腫瘤新生血管、基質含量及細胞膜完整性等組織病理狀態,在直腸癌的診斷、預后評估、新輔助治療療效檢測方面有重要作用。DWI可以分為兩類:①高斯DWI,主要包括單指數模型和體素內不相干運動(intravoxel incoherent motion,IVIM); ②非 高 斯DWI,近年來主要關注于彌散峰度成像(diffusion kurtosis imaging,DKI) 的研究[6-7]。基于不同模型可計算得到多參數DWI(multiparametric DWI,MPDWI)指標,從而對組織內水分子的不同彌散模式加以區分,可以更為準確地描述不同組織的特性。目前MP-DWI在乳腺病變的診斷及預后評估、肝癌治療后評估等方面有較成熟的應用[8-9],但在直腸癌術前分期方面并沒有太多研究報道。因此,本研究基于MPDWI建立多參數聯合模型,探討其對直腸癌術前T分期的評估價值。
方 法
1.臨床資料
回顧性分析2017年7月至2019年10月在我院術前行直腸MP-DWI檢查且經手術病理證實的直腸癌患者共167例。納入標準:①行根治性手術,經組織病理學證實為直腸腺癌;②有完整詳細的術后病理檢查報告;③術前行直腸MP-DWI檢查且圖像質量良好;④單發病灶。排除標準:①MRI偽影較多,圖像質量欠佳(12例);②MRI檢查及術前接受過其他任何全身或局部治療(26例);③患者既往有其他盆腔手術治療史(2例)。病理診斷根據美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)第8版的標準,將術后病理T1-2期歸為未突破肌層組,T3-4期歸為突破肌層組。
2.成像方法
所有患者均使用Siemens Skyra 3.0 T磁共振儀,采用仰臥體位及腹部相控陣體線圈。患者檢查前使用1支開塞露(20 ml甘油)清潔腸道。常規掃描序列:矢狀位T2加權成像(WI)、斜軸位DWI序列、斜軸位T2WI及T1WI(平掃+增強,橫軸位、矢狀位、冠狀位)。MP-DWI序列參數:重復時間(TR)6 300 ms,回波時間(TE)89 ms,層厚5 mm,層數20,視野(FOV)380 mm×380 mm,矩陣150×150,體素1.3 mm×1.3 mm×5.0 mm,帶寬2 084 Hz/像素,b值(平均次數)為0(1)、50(1)、100(1)、150(1)、200(2)、250(2)、500(2)、1 000(2)、1 500(3)、2 000(3)s/mm2。采集時間347 s。
3.圖像分析
所有DICOM格式的圖像均使用后處理軟件(Body Diffusion Toolbox,Siemens)對多b值DWI數據進行擬合,采用單指數模型計算表觀彌散系數(ADC)值;IVIM模型推導出真彌散系數(Dt),灌注分數(PF),假彌散系數(D*);采用DKI模型計算非高斯分布的校正表觀彌散系數(Dapp)值及表觀彌散峰度(Kapp)值。所有定量參數均由2名有5年以上工作經驗的放射科醫師在不知道患者手術及病理結果的情況下共同分析并測量,若出現意見分歧,由第3位有10年以上工作經驗的醫師閱片決定。同時參考高分辨T2WI,在ADC圖上選取病灶實質部分最大的區域勾畫感興趣區(ROI),同步測量病灶各參數值,ROI盡量包括腫瘤的實性部分,避開氣體、出血、壞死、囊變區,所有數據測量3次并取其平均值。其他病理數據包括性別、年齡、體重指數(BMI)、腫瘤位置、N分期、分化程度、神經侵犯、脈管癌栓、癌結節、癌胚抗原(CEA)、糖抗原(CA)19-9。
4.統計學分析
所有資料的統計學分析均采用SPSS 25.0軟件,P<0.05為差異有統計學意義。采用兩獨立樣本t檢驗比較2組各參數間有無差異。使用二元logistic回歸尋找有助于鑒別2組患者的獨立因素并建立聯合模型,分別計算各指標及聯合模型的受試者操作特征(ROC)曲線,計算ROC曲線下面積(AUC)、最佳閾值及其相應的靈敏度和特異度,DeLong檢驗比較模型間的差異。同時計算各指標的cut-off值及凈重新分類指數(NRI)。
結 果
1.臨床資料
最終納入127例直腸癌患者,其中男性90例,女性37例,年齡28~74歲,平均(57.0±9.9)歲。未突破肌層(T1-2期)組39例,突破肌層(T3-4期)組88例,環周切緣均為陰性。2組患者詳細臨床資料及比較結果見表1,DWI測量數據見表2。
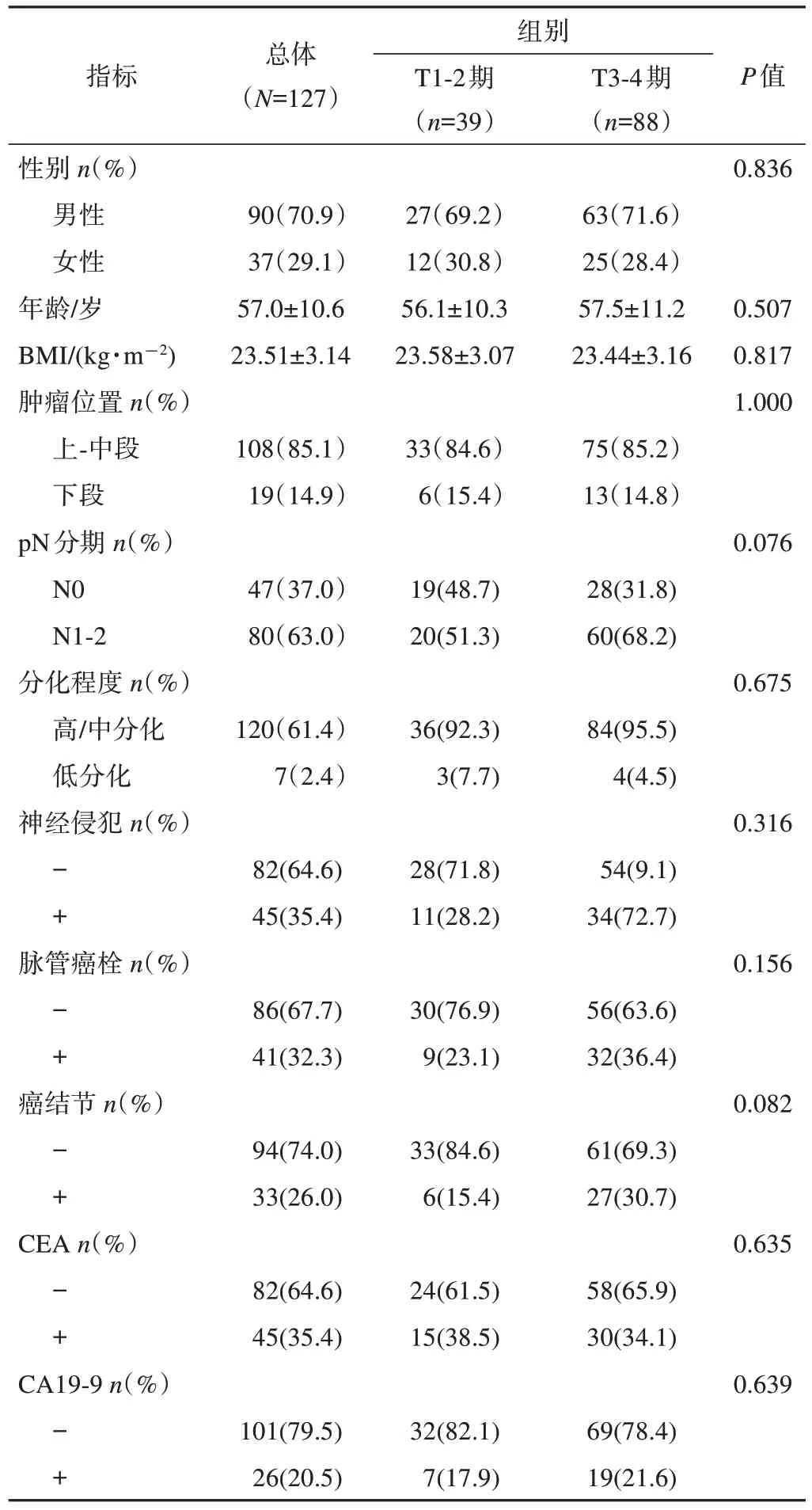
表1 直腸癌患者臨床資料特征
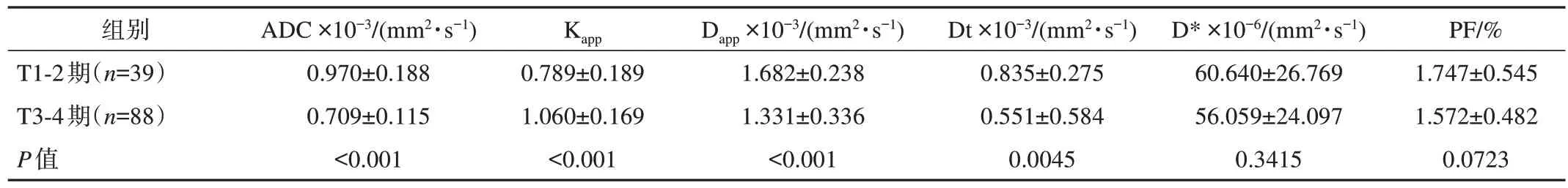
表2 直腸癌患者DWI測量數據
2.多參數logistic回歸分析結果
單因素logistic回歸分析結果(表3)顯示,PF、D*值組間差異無統計學意義 (P>0.05),Dt、Dapp、Kapp、ADC值的組間差異均有統計學意義,與T分期相關(P<0.05)。以上述4項指標為自變量,行多因素logistic回歸并建立回歸模型,結果(表3)顯示,Dt(OR=3.277,P=0.042)、Dapp(OR=3.778,P=0.041)、Kapp(OR=8.199,P=0.001)、ADC(OR=85.241,P<0.000 1)值均與直腸癌T分期相關。
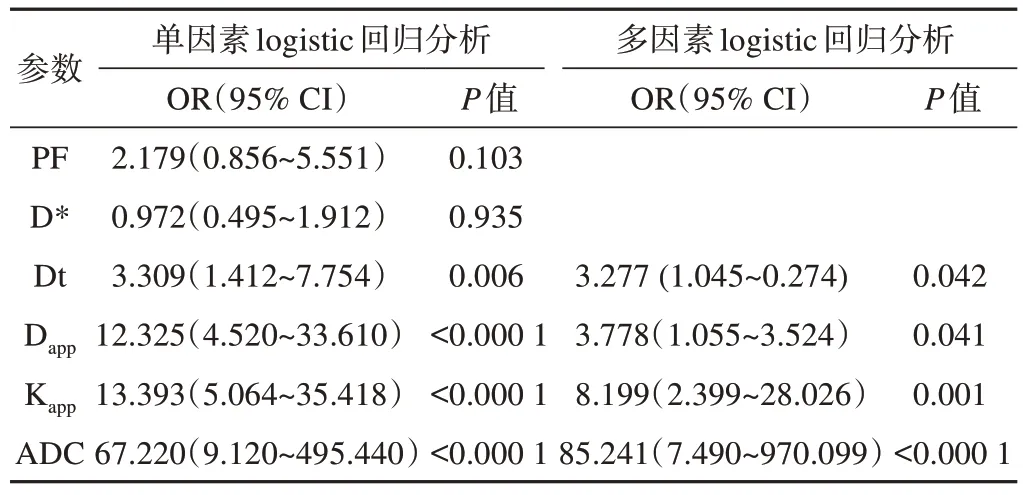
表3 T分期的影響因素及統計學結果
3.多參數聯合模型對術前T分期的診斷效能
單個參數指標及聯合模型的ROC曲線顯示,聯合模型的AUC最大(均P<0.05),靈敏度及特異度較其他單個指標更為合理,NRI均大于0,此時可認為聯合模型優于單個參數模型(表4、圖1)。進一步計算各指標cut-off值,分別為ADC 0.845×10-3mm2/s、Kapp0.918、Dapp1.675×10-3mm2/s、Dt 0.656×10-3mm2/s。當病灶ADC<0.845×10-3mm2/s、Kapp>0.918、Dapp<1.675×10-3mm2/s、Dt<0.656×10-3mm2/s時,癌灶更傾向于T3-4期,反之則更傾向于T1-2期(圖2)。
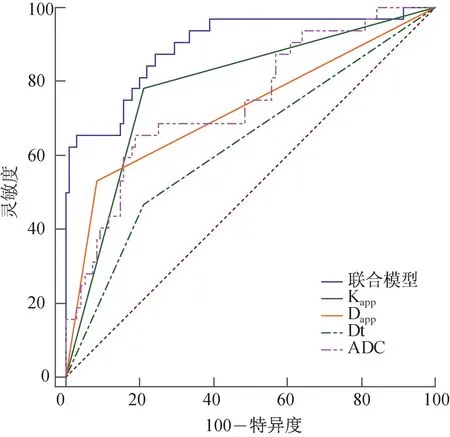
圖1 多參數指標及聯合模型的ROC曲線
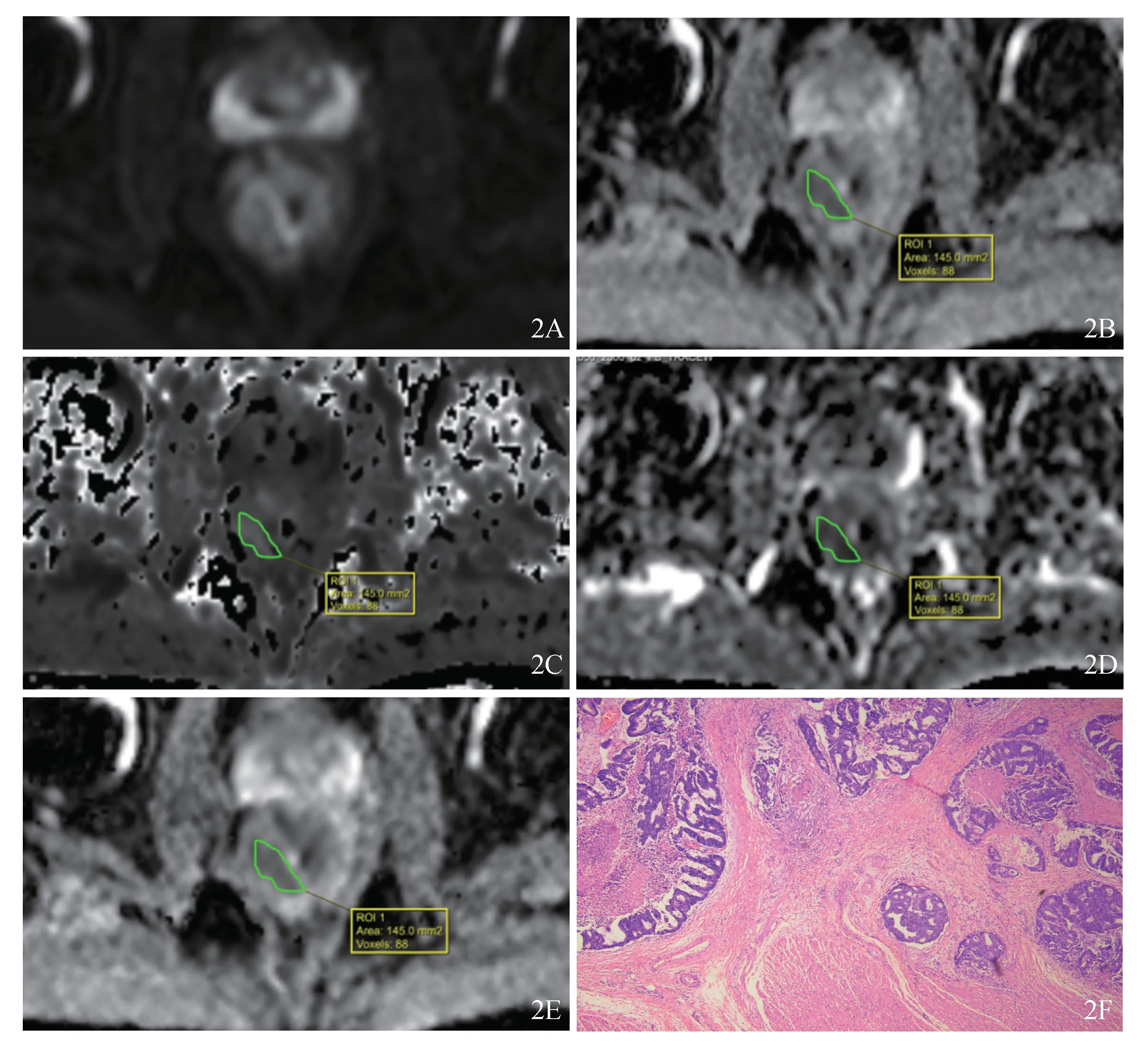
圖2 多參數聯合模型診斷示例
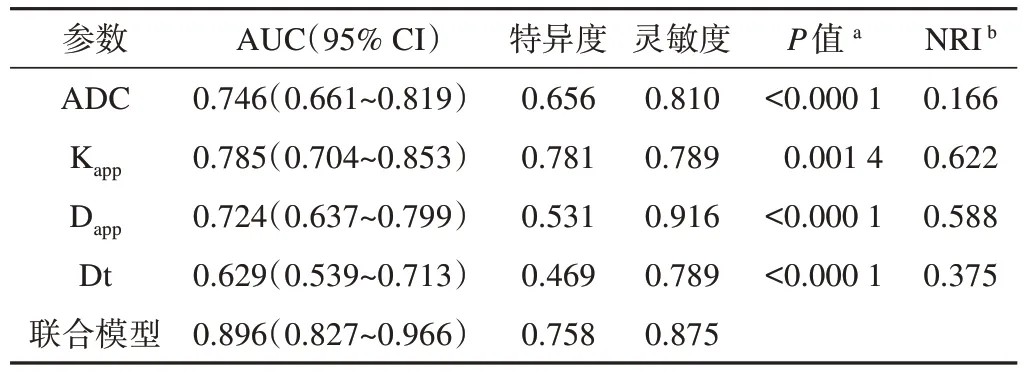
表4 單個指標及聯合模型的ROC曲線結果
討 論
本研究的數據表明,Dt、Dapp、Kapp、ADC值4項指標在鑒別直腸癌為T1-2期及T3-4期時差異有統計學意義,PF及D*在鑒別兩者間差異無統計學意義。聯合模型的AUC最大,與單個指標的模型相比,NRI均大于0,表明聯合模型較單個指標更有助于術前判斷病灶T分期。
DWI能夠反映人體組織內水分子的隨機布朗運動,測量水分子彌散運動過程中局部受限的程度和方向,間接反映ROI組織微觀結構的變化及特點。然而,在活體組織中,除組織內水分子的彌散外,微觀運動形式還包括微循環毛細血管灌注的影響。基于高斯分布單指數模型得出的ADC值可以定量反映組織中水分子的彌散特性,ADC值越大,水分子的彌散程度越大。但該結果為水分子彌散及毛細血管微循環的共同影響,不能準確地反映腫瘤內的微觀變化。基于IVIM模型可以得到反映微循環灌注的定量參數D*、PF以及反映水分子彌散的真實彌散系數Dt[10]。Dt值越大,水分子的彌散程度越大;D*值反映微循環灌注中血管內血流速度及毛細血管平均長度,代表了血管內水(人體內流動血液中的水)的運動,這種水隨血液流動,速度很快,稱為假彌散,反映組織的灌注信息;PF指微循環灌注相關的彌散占總彌散的比重,與毛細血管血容量有關[11]。但在實體組織內,水分子彌散受局部組織結構和病變區域特殊細胞形態的影響呈非高斯彌散,而DKI模型可以得到考慮非高斯彌散因素后的校正彌散系數Dapp值及表觀彌散峰度Kapp值,其中Kapp值反映了偏離高斯分布的程度,Kapp值越大代表組織結構越復雜[12]。
本研究發現,隨著直腸癌病灶T分期的增加,反映水分彌擴散特性的ADC、Dapp及Dt值均呈下降趨勢,而Kapp值則呈升高趨勢,與其他研究[13-15]結果部分一致。這可能是因為隨著腫瘤T分期的增加,其浸潤性增高,腫瘤細胞的密集度隨之升高,導致細胞外間隙不斷減小,水分子的彌散程度會受到越來越多的限制,從而引起ADC、Dapp及Dt值的下降。伴隨著腫瘤侵襲性的升高,腫瘤內細胞排列、微血管結構等更加復雜,病灶內易出現囊變、壞死、出血等變化,更進一步加劇了其內部的復雜程度,導致Kapp值的升高。ROC曲線分析顯示,在4個單項指標中,Kapp值的AUC較高,特異度最高,意味著過度分期的可能性降低;而Dapp值靈敏度最高,但特異度較低,即有過度分期的風險。我們的研究中4項指標建立的聯合模型的AUC最大,差異具有統計學意義(均P<0.05),且與單項指標比較NRI均大于0。以最佳閾值判斷病灶是否突破固有肌層的靈敏度及特異度分別為87.5%及75.8%,靈敏度僅次于Dapp,特異度略低于Kapp,但是靈敏度及特異度的組合最合理,綜合診斷效能優于單項指標,低估或過度分期的風險均較低,因此聯合模型的應用可以幫助臨床醫生在術前對直腸癌的T分期作出更準確的判斷,從而制訂更合理的治療方案。對高風險患者術前行新輔助放療從而提高預后,對低分期的患者避免不必要的術前放化療,提高手術治愈率,減輕患者負擔。
在本研究中,T1-2組與T3-4組患者PF和D*值的組間差異均無統計學意義,故沒有將兩者納入聯合模型。關于這2項指標與直腸癌病理特征的相關性并沒有統一的定論。謝輝等[16]和韓帥等[17]認為PF、D*值與直腸癌T分期均無顯著相關性;Sun等[18]則認為PF、D*值隨著直腸癌分化程度的降低呈下降趨勢。Lu等[19]發現D*值與直腸癌T分期無顯著相關性,而PF值與分化程度相關,低分化直腸癌的PF值顯著降低。這可能是因為低分化的腫瘤往往正常腺體結構較少,而腺體結構可能有助于PF的測量;也可能是因為分化程度差的腫瘤細胞生長快,血管壁分化差,導致病灶微循環內灌注減低所致,因此PF值的影響因素很多,需要開展更大樣本、更規范的前瞻研究進行分析。而目前多數研究表明,參數D*值對噪聲敏感,測量可重復性差,其可能的原因包括腫瘤本身的異質性、乏血供、信噪比低以及低b值掃描時獲得的灌注信息有限[20]。
我們的研究存在以下局限性。①本研究系單中心回顧性研究,可能存在選擇偏倚,納入的T1-2期直腸癌患者相對較少,這也可能是PF值、D*值的診斷效能不理想的原因之一。未來有必要擴大數據量,進一步進行外部驗證及前瞻性多中心研究。②IVIM和DKI的圖像分辨率較低,且容易出現主觀錯誤,所以我們選擇在顯示腫瘤的最佳單層面上勾畫ROI,這可能會忽視病灶的異質性。在將來的研究中,應該考慮采用全病灶直方圖來進一步研究,并驗證各參數測量的一致性。③本研究僅基于DWI參數分析,未加入動態增強等其他MRI序列參數分析。未來研究還可以結合多種臨床預后指標,構建多模態模型,有可能進一步提高判斷直腸癌術前分期的準確度。
綜上所述,磁共振MP-DWI有助于判斷腫瘤浸潤深度,Dt、Dapp、Kapp和ADC這4項指標對直腸癌術前T分期的診斷具有價值,且4項指標的聯合應用可以更好地作為直腸癌術前評估的有效手段。

