膠體金免疫層析法測定菲律賓蛤仔中氯霉素殘留變化
鄭澤洋,林丹*,張家意,朱惠綿,黃敏豐,丘韶麟,周英雅,陳乘
(1.廣東省食品工業研究所有限公司,廣東 廣州 511442;2.食品企業質量安全檢測技術示范中心,廣東 廣州 511442;3.珠海市香洲區市場監督管理局,廣東 珠海 519000)
氯霉素(Chloramphenicol,CAP)是一種廣譜抗生素,其效高價廉,曾在畜牧業、水產養殖業中廣為應用。抗生素的使用不僅給海洋環境帶來不利影響,包括抑制沉積物中有益微生物的活性,影響生物地球化學循環,且長期使用會引起病原生物的抗藥性增強和水生生物體藥物殘留等問題[1]。我國自2002年起已明確禁止氯霉素及其鹽、酯添加或用于所有食品動物中,規定在所有動物可食部分中不得檢出[2]。但近年來在各省市的食品安全監督抽查中,頻繁在水產品中檢出氯霉素,嚴重危害了消費者的健康。
食品快速檢測技術具有快速、簡便、靈敏等特點,已廣泛用于食品安全監管中[3]。膠體金免疫層析法(Colloidal gold immunochromatography assay,GICA)是常用的快速檢測方法之一,是以膠體金作為示蹤標志物應用于抗原抗體的一種新型的免疫標記技術。目前,膠體金免疫層析法已廣泛應用于動物產品中氯霉素殘留初篩,能在短時間內檢測幾十甚至上百個樣品,并且不需用到復雜儀器設備,樣品處理簡單。與傳統的儀器法相比,膠體金免疫層析法具有快速、操作簡單、結果準確、重復性好的特點。劉文珍等[4]應用膠體金免疫層析法快速檢測9種水產品中殘留的氯霉素,表明方法具有良好的穩定性,特異性較好,與國標方法相比,試驗結果基本一致。王媛等[5]分析比較了3種測定水產品中氯霉素殘留的商品化膠體金快速檢測產品,其靈敏度、精密度、符合性和穩定性均能滿足目前對氯霉素監控的限量要求,適合水產品中氯霉素殘留的現場篩選。
現以膠體金免疫層析快速檢測方法作為檢測手段,以菲律賓蛤仔為試驗對象,探究其氯霉素殘留變化規律,為推進快速檢測方法在基礎研究中的應用提供參考,也為提高消費者的貝類食用安全提供依據。
1 研究方法
1.1 試劑與樣品
氯霉素(CAS號:56-75-7)純度為99%,購自德國Dr.Ehrenstorfer公司;氯霉素殘留檢測試紙條,購自北京勤邦生物技術有限公司;菲律賓蛤仔由廣州市某市場購得。
1.2 靈敏度與精密度試驗
(1)靈敏度。對產品進行加標試驗,該氯霉素試劑盒產品檢出限為0.1μg/kg。采用空白菲律賓蛤仔樣品添加0.1、0.5和1μg/kg CAP標準溶液,每個濃度做6次平行。
(2)精密度。采用空白菲律賓蛤仔樣品添加0.1μg/kg CAP標準溶液,用同一批號的產品在同一時間測定10次,判斷產品的精密度。
1.3 試驗設計
(1)停藥處理。將菲律賓蛤仔分別暫養于低中高3個質量濃度(0.25,1.5,5 mg/L)的CAP溶液中;4 h后置于海水中暫養24 h,并于第1,3,6,9,12,18和24 h取樣;采用膠體金免疫層析法測定其CAP殘留。
(2)換水處理。將菲律賓蛤仔暫養于5 mg/L的CAP溶液中,暫養4 h;停藥后,在海水暫養24 h內,每1、3和6 h換一次水,并于第1,3,6,9,12,18和24 h取樣;采用膠體金免疫層析法測定其CAP殘留。
(3)換水和預煮協同處理。將菲律賓蛤仔暫養于5 mg/L的CAP溶液中,暫養4 h。停藥后,在海水暫養24 h內,每1,3,6 h換一次水,并于第1,3,6,9,12,18和24 h取樣,在沸水中處理10 min,采用膠體金免疫層析法測定菲律賓蛤仔中CAP殘留情況。
1.4 樣品處理
參考氯霉素殘留檢測試紙條說明書方法,取5~10個菲律賓蛤仔,去殼,勻漿。稱取(2.00±0.02)g勻漿好的組織樣本至10 mL聚苯乙烯離心管中,加入4 mL提取劑,渦旋混勻,劇烈震蕩約2 min后,3 000 r/min離心5 min;移取3 mL上層有機相至10 mL聚苯乙烯離心管中,于50~60℃水浴氮氣流或空氣流下吹干;加入樣本復溶液,用渦旋儀渦動20 s后待檢。
1.5 樣品測定
取出試紙條回溫至室溫(即開即用),置于平整的臺面上。吸取1.4中待測樣本溶液75μL垂直滴加于加樣孔中,液體流動時開始計時,在10 min內讀取結果。以磷酸鹽緩沖液代替樣品提取液作為空白進行對照試驗。
1.6 結果判定
參考氯霉素殘留檢測試紙條說明書結果判定方法。
(1)試劑板有效性判定。如果空白對照控制線(以下簡稱C線)沒有出現紅色條帶,見圖1(c),則說明檢測試劑條已經失效,不能進行檢測;如果C線和檢測線(以下簡稱T線)均出現紅色條帶,而且檢測線比空白對照線顏色深或一樣深,見圖1(a)(b)。說明檢測試劑板有效,可進行檢測。
(2)結果讀取。肉眼觀察樣品檢測結果,如果未出現C線,則表明操作不當或試劑條已失效,見圖1(c);當待檢樣品T線出現紅色條帶,且顏色比C線深或一樣深則表示待檢樣品為陰性,見圖1(a),未檢測到樣品含有氯霉素﹔當待檢樣品T線無顯色或比C線顏色淺,則表示待檢樣品為陽性,見圖1(b),檢測到樣品含有氯霉素。
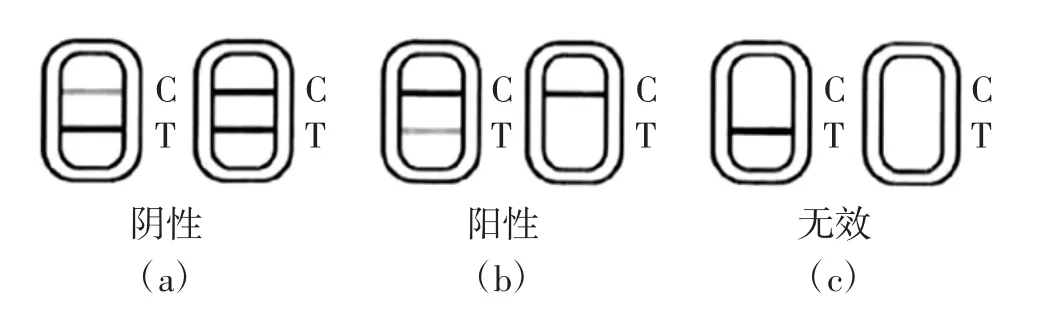
圖1 氯霉素殘留檢測試紙條判定結果
2 結果與討論
2.1 靈敏度與精密度試驗
(1)靈敏度。按照氯霉素檢測試劑盒說明書,以靈敏度試驗進行測定,依據判定方法,測定結果見表1。由表1可見,該氯霉素檢測試劑盒產品在0.1,0.5和1μg/kg CAP加標量下均可以得出測定結果,且6次測定結果一致,檢出率為100%,假陰性率為0。
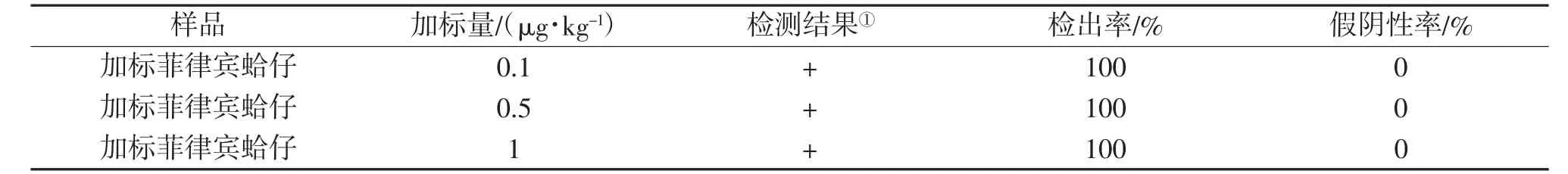
表1 氯霉素快速檢測試劑盒產品的靈敏度測試結果(n=6)
(2)精密度。該氯霉素檢測試劑盒檢測限為0.1μg/kg,在精密度試驗中將檢測限作為測定濃度,在空白菲律賓蛤仔中加入0.1μg/kg CAP,用同一批號產品在同一時間平行測定10次,測定結果見表2。由表2可見,在檢測限點,該氯霉素試劑盒產品10次平行測定的結果均一致,檢出率為100%,假陰性率為0。

表2 氯霉素快速檢測試劑盒產品的精密度測試結果(n=10)
2.2 停藥后菲律賓蛤仔中氯霉素殘留量變化
停藥后菲律賓蛤仔中氯霉素殘留量判定結果見表3。由表3可見,經低質量濃度CAP(0.25 mg/L)處理的菲律賓蛤仔在海水暫養的24 h內,氯霉素殘留檢測試紙條判定結果均為陰性;經中質量濃度CAP(1.5 mg/L)處理的菲律賓蛤仔在海水暫養的24 h內,在0~18 h時,氯霉素殘留檢測試紙條判定結果均為陽性,在第24 h時,檢測結果為陰性;經高質量濃度CAP(5 mg/L)處理的菲律賓蛤仔在海水暫養的24 h內,氯霉素殘留檢測試紙條判定結果均為陽性。另外,菲律賓蛤仔經0.25 mg/L氯霉素處理4 h后,其體內未能檢出CAP殘留;經1.5和5 mg/L CAP處理后,其體內檢出CAP初始殘留。
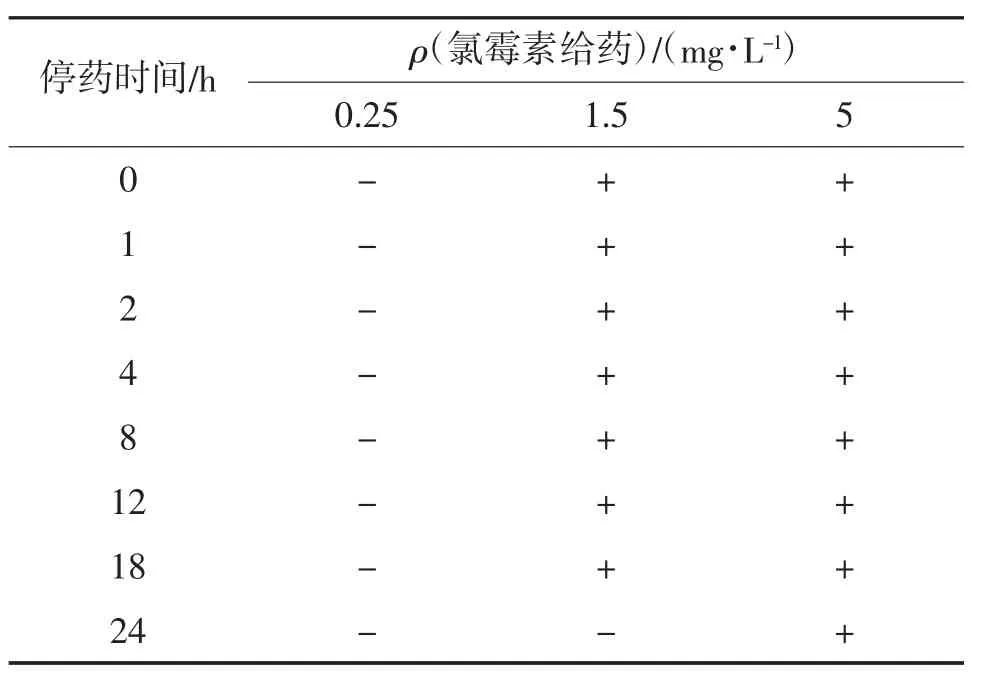
表3 停藥后菲律賓蛤仔中氯霉素殘留量判定結果①
菲律賓蛤仔中CAP初始殘留量隨氯霉素給藥濃度的增加而增加,且CAP殘留量隨暫養時間的增加而減少。李愛等[6]做了相關研究,發現菲律賓蛤仔組織中氯霉素初始殘留量隨氯霉素給藥量的增加而增加,并且氯霉素殘留量隨停藥時間的延長而降低,該結果與文章結論相符,說明快速檢測方法在基礎理論研究中有一定的實際意義,可作為樣品條件篩選的依據。
2.3 換水處理后菲律賓蛤仔中氯霉素殘留量變化
經5 mg/L CAP溶液處理停藥后,菲律賓蛤仔采用換水處理暫養24 h,換水頻率分別為間隔1,3和6 h/次。換水后菲律賓蛤仔中氯霉素殘留量判定結果見表4。由表4可見,未換水的菲律賓蛤仔在24 h內,氯霉素殘留檢測試紙條判定結果均為陽性;換水頻率為間隔1,3,6 h/次,在第0~12 h時,氯霉素殘留檢測試紙條判定結果均為陽性;從第18 h開始,判定結果轉為陰性。
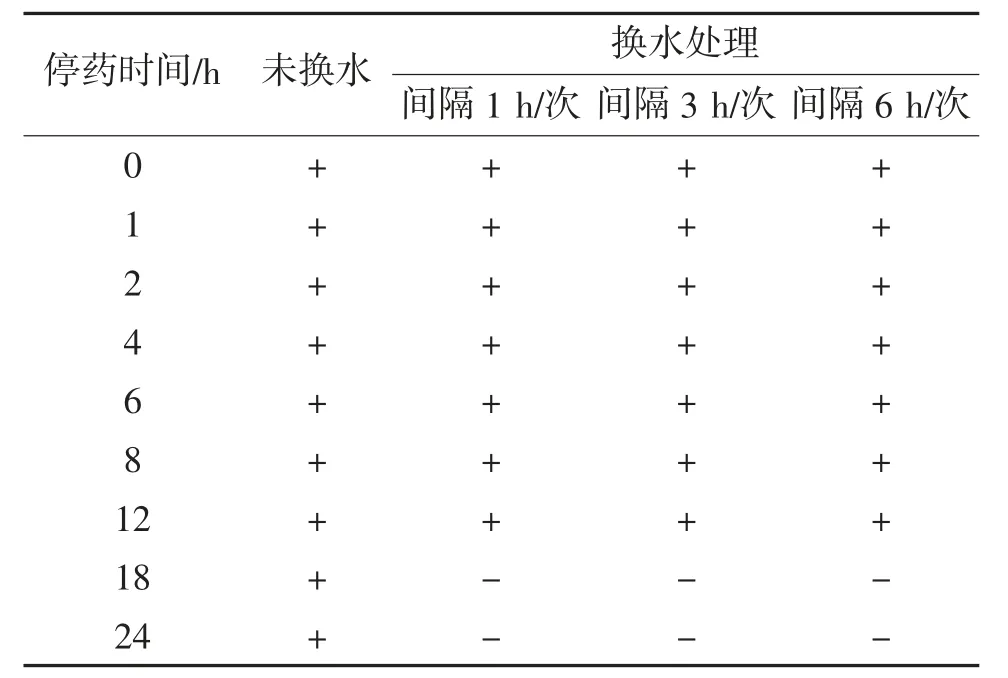
表4 換水后菲律賓蛤仔中氯霉素殘留量判定結果①
在CAP初始殘留量一致的情況下,換水可有效降低菲律賓蛤仔中CAP殘留量,但換水頻率對CAP殘留量影響不大。原因可能是換水處理能保證菲律賓蛤仔的正常生命活動,保持其代謝能力。而未換水處理的菲律賓蛤仔在24 h暫養過程中產生的代謝物流入海水溶液中,隨著時間的延長,代謝物增加,生存環境變得惡劣,其本身的代謝能力降低,從而影響氯霉素代謝。
2.4 換水和預煮協同處理后菲律賓蛤仔中氯霉素殘留量變化
經5 mg/L CAP溶液處理停藥后,菲律賓蛤仔采用換水處理暫養24 h,測定前采用沸水預煮處理10 min。換水和預煮協同處理后菲律賓蛤仔中氯霉素殘留量判定結果見表5。
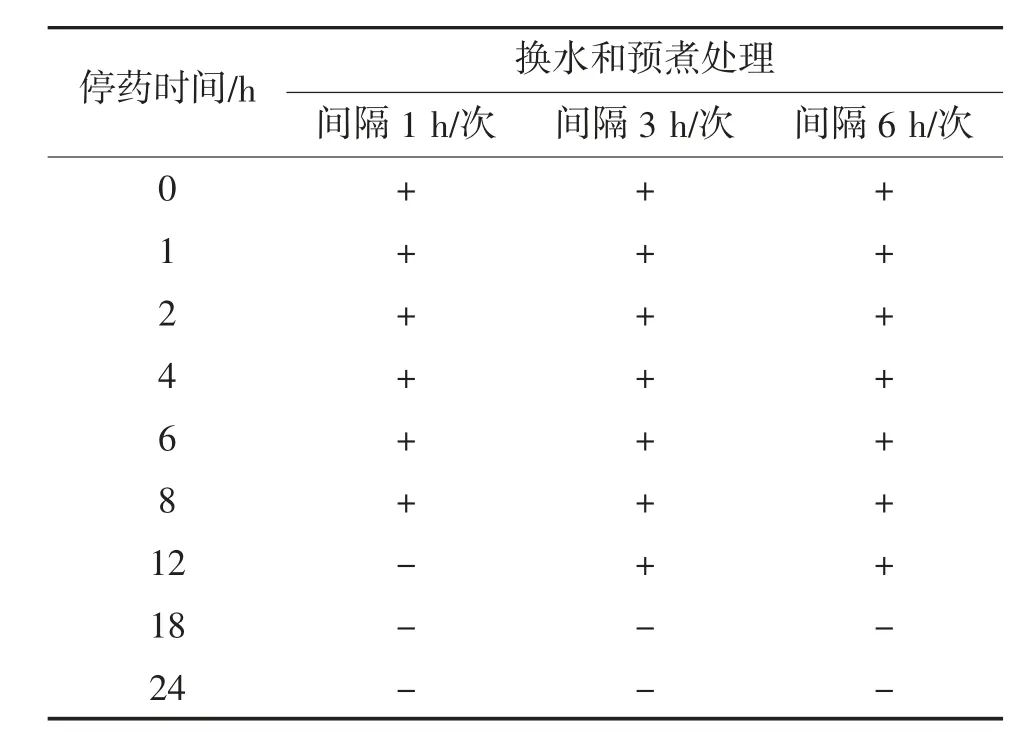
表5 換水和預煮協同處理后菲律賓蛤仔中氯霉素殘留量判定結果①
由表5可見,經過間隔1 h換一次水后,在第0~8 h沸水預煮10 min時,檢測結果均為陽性;從第12 h開始,檢測結果轉為陰性。經過間隔3和6 h換一次水后,在第0~12 h沸水預煮10 min時,檢測結果均為陽性;從第18 h開始,檢測結果轉為陰性。
在CAP初始殘留量一致的情況下,當換水頻率較高(間隔1 h/次)時,與換水處理相比換水和預煮協同處理能明顯降低殘留量,在處理的第12 h氯霉素檢測結果已為陰性。當換水頻率相對較低(間隔3、6 h/次)時,換水和預煮協同處理對氯霉素殘留量影響較小。
3 結論
氯霉素快速檢測試劑盒具有高靈敏度和高精確度,其檢測限基本滿足目前對氯霉素監控的限量要求。用膠體金免疫層析法測定菲律賓蛤仔中氯霉素殘留量的變化,發現氯霉素初始殘留量隨氯霉素給藥濃度的增加而增加,且氯霉素殘留量隨暫養時間的增加而減少;在氯霉素初始殘留量一致的情況下,換水能有效降低菲律賓蛤仔中氯霉素殘留量,但換水頻率對氯霉素殘留量影響不大;當換水頻率較高時,換水和預煮協同處理能明顯降低氯霉素殘留量。
試驗結果表明,快速檢測方法在基礎理論研究中具有一定的實際意義,可作為樣品條件篩選的依據。

