環狀RNA circ-COPA在胃癌組織中表達的臨床意義及其對胃癌細胞生物學行為的影響
吳 菁,蔣志勇,李奎生,劉 芳,呂志武,黃明沂,肖 瑤
(1. 深圳市寶安區福永人民醫院消化內科,廣東 深圳 518103 ;2. 武漢大學中南醫院影像科,湖北 武漢 430071 ;3. 南方醫科大學附屬深圳寶安醫院消化內科,廣東 深圳 518101)
胃癌是一種常見的消化系統惡性腫瘤,具有易轉移、易復發的特點[1]。此病患者的預后通常較差,近年來其病死率呈逐年上升的趨勢[2]。尋找有效的胃癌分子標志物及治療靶點是臨床上研究的熱點。環狀RNA(circular RNA,circRNA)是一類呈閉環結構的小分子非編碼RNA。此類RNA 可通過多種方式調節靶基因的轉錄及翻譯,從而可在細胞中發揮重要的生物學作用[3]。有研究顯示,circRNA 在結直腸癌組織、肺癌組織等多種癌組織中呈異常表達,并會參與調控腫瘤細胞的增殖、侵襲、凋亡、衰老等過程[4]。circ-COPA 是一種新明確的circRNA,由5044 個堿基組成,其在胃癌組織中的表達情況及參與胃癌發生的機制尚不清楚。本文主要是分析circ-COPA 在胃癌組織中表達的臨床意義及其對胃癌細胞增殖、侵襲及阿片樣物質結合蛋白/細胞黏附分子樣蛋白(opioid binding protein/cell adhesion molecule-like,OPCML)表達的影響。
1 材料與方法
1.1 組織標本
選取2017 年12 月至2021 年3 月期間在我院接受手術治療和病理檢查的52 例胃癌患者作為研究對象。將這些患者的癌組織標本及癌旁組織標本(距腫瘤邊緣>5 cm)均置于液氮罐中保存。這些患者術前均未接受過放療或化療,且均知情并同意參與本研究。
1.2 細胞株與主要試劑
胃癌SGC7901 細胞購于中國科學院上海生科院細胞資源中心;對照序列和circ-COPA 序列購于廣州銳博生物技術公司;胎牛血清、杜爾貝科改良伊格爾培養基(Dulbecco’s Modified Eagle Medium,DMEM)購于美國Gibco 公司;引物購自武漢擎科生物技術公司;Lipofectamine 3000 轉染試劑和Matrigel 基質膠購于美國Invitrogen 公司;Transwell小室購于美國Beaver 公司;逆轉錄試劑盒、定量逆轉錄聚合酶鏈反應(quantitative reverse transcription-PCR,qRTPCR)試劑盒購于日本TaKaRa 公司;細胞計數試劑盒-8(cell counting kit-8,CCK-8)購于武漢碧云天生物科技有限公司;一抗甘油醛-3- 磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、OPCML 購于美國Affinity 公司;辣根過氧化物酶標記的二抗購于武漢博士德生物科技公司。
1.3 檢測52 例患者癌組織及癌旁組織中circ-COPA 和OPCMLmRNA 的表達量
采用qRT-PCR 技術檢測這些患者癌組織及癌旁組織中circ-COPA 和OPCML mRNA 的表達量。采用TRIzol 法提取組織和細胞中的總RNA,使用紫外分光光度計檢測RNA 質量,將RNA 逆轉錄成cDNA,并根據qRT-PCR 試劑盒說明書進行擴增處理。circ-COPA 正向引物序列為5’-GCAGGCATTTCGGATCCATAA-3’,反向引物序列為5’-TCGGAGCAGAGATCACACTAT-3’;GAPDH 上游引物序列為5’-GGAGCGAGATCCCTCCAAAAT-3’,下游引物序列為5’-GGCTGTTGTCATACTTCTCATGG-3’;OPCML上游引物序列為5’-TACCATAGATGACCGGGTAACC-3’,下游引物序列為5’-CGTTTTGGGATGATTGTCTGTCT-3’。以GAPDH 作為內參,采用2-ΔΔCt法計算定量結果。
1.4 SGC7901 細胞的培養和轉染
對凍存于液氮罐中的SGC7901 細胞進行復蘇處理后,將其置于含10% 胎牛血清的DMEM 中,在37℃、5%CO2及飽和濕度條件下進行培養。取對數生長期的SGC7901 細胞接種于24 孔板中,將其分為Control 組和circ-COPA 組。為Control 組細胞和circ-COPA 組細胞分別轉染對照序列、circ-COPA 序列(根據轉染試劑說明書進行轉染)。24 h 后,采用qRT-PCR 技術檢測兩組細胞中circ-COPA 的表達量。
1.5 采用CCK-8 法檢測兩組細胞的增殖能力
將兩組細胞均勻種植于96 孔板中,每孔加100 μL 細胞懸液(將細胞密度調整為6×103個/mL)。在培養箱中分別培養1 d、2 d、3 d、4 d、5 d 后,加入10 μL 的CCK-8試劑。在培養箱中孵育3 h,于波長490 nm 處使用酶標儀檢測并記錄每孔的吸光度。
1.6 采用Transwell 小室實驗檢測兩組細胞的侵襲能力
采用Matrigel 基質膠包被Transwell 上室。取兩組細胞(使用無血清培養基將細胞密度調整為6×104 個/mL)各100 μL,分別加入Transwell 小室上層。在小室下層分別加入含10% 胎牛血清的DMEM 500 μL,然后將其置于培養箱中培養48 h。取出小室,使用棉簽擦去膜上細胞,用4%的多聚甲醛溶液固定30 min。置于0.1% 的結晶紫染料中染色30 min,用流水洗滌并晾干,在顯微鏡下拍照、計數。
1.7 采用Westernblot 技術檢測兩組細胞中OPCML 的表達量
將兩組細胞分別加入到適量的放射免疫沉淀法(radio immuno precipitation assay,RIPA)裂解液中裂解,并提取總蛋白。采用十二烷基硫酸鈉- 聚丙烯酰胺凝膠電泳分離出蛋白,用聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜對其進行轉膜,并用脫脂牛奶對其實施封閉。加入一抗OPCML(濃度為1:1000)、GAPDH(濃度為1:1000),在4℃下孵育過夜。加入辣根過氧化物酶標記的二抗(濃度為1:10 000),在室溫下孵育3 h。使用ECL 發光試劑盒進行顯色、拍照,用Quantity One 軟件檢測OPCML 條帶灰度值(以GAPDH 蛋白為內參)。
1.8 統計學處理
對本研究中的所有數據均采用SPSS 21.0 軟件進行統計學分析,計量資料用均數± 標準差(±s)表示,采用t檢驗,計數資料用百分比(%)表示,采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 52 例患者癌組織及癌旁組織中circ-COPA 的表達量
進行qRT-PCR 檢測的結果顯示,52 例患者癌組織及癌旁組織中circ-COPA 的表達量分別為(1.89±0.48)和(6.02±0.45)。與癌旁組織相比,52 例患者癌組織中circ-COPA 的表達量較低,t=36.24,P<0.01。詳見圖1。
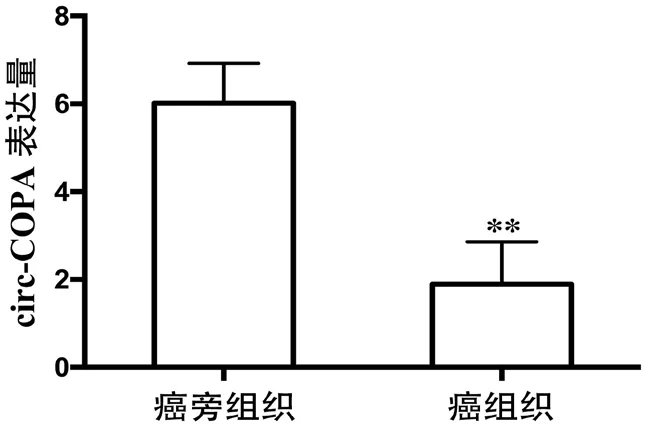
圖1 52 例患者癌組織及癌旁組織中circ-COPA 的表達量(注:** 與癌旁組織相比,P <0.01)
2.2 52 例患者癌組織中circ-COPA 的表達量與其臨床病理特征的關系
以52 例患者癌組織中circ-COPA 表達量的中位數1.51為界值,患者癌組織中circ-COPA 的表達量≥1.51 表示其存在癌組織中circ-COPA 高表達的情況,患者癌組織中circ-COPA 的表達量<1.51 表示其存在癌組織中circ-COPA 低表達的情況。在52 例患者中,年齡≥60 歲患者與年齡<60 歲患者中存在癌組織中circ-COPA 低表達情況患者的占比相比,P>0.05 ;男性患者與女性患者中存在癌組織中circ-COPA 低表達情況患者的占比相比,P>0.05 ;與病灶直徑<5 cm 的患者相比,病灶直徑≥5 cm 患者中存在癌組織中circ-COPA 低表達情況患者的占比較高,P<0.05 ;與腫瘤TNM 分期為Ⅰ期或Ⅱ期的患者相比,腫瘤TNM 分期為Ⅲ期患者中存在癌組織中circ-COPA 低表達情況患者的占比較高,P<0.05 ;與未發生淋巴結轉移的患者相比,發生淋巴結轉移患者中存在癌組織中circ-COPA低表達情況患者的占比較高,P<0.05。詳見表1。
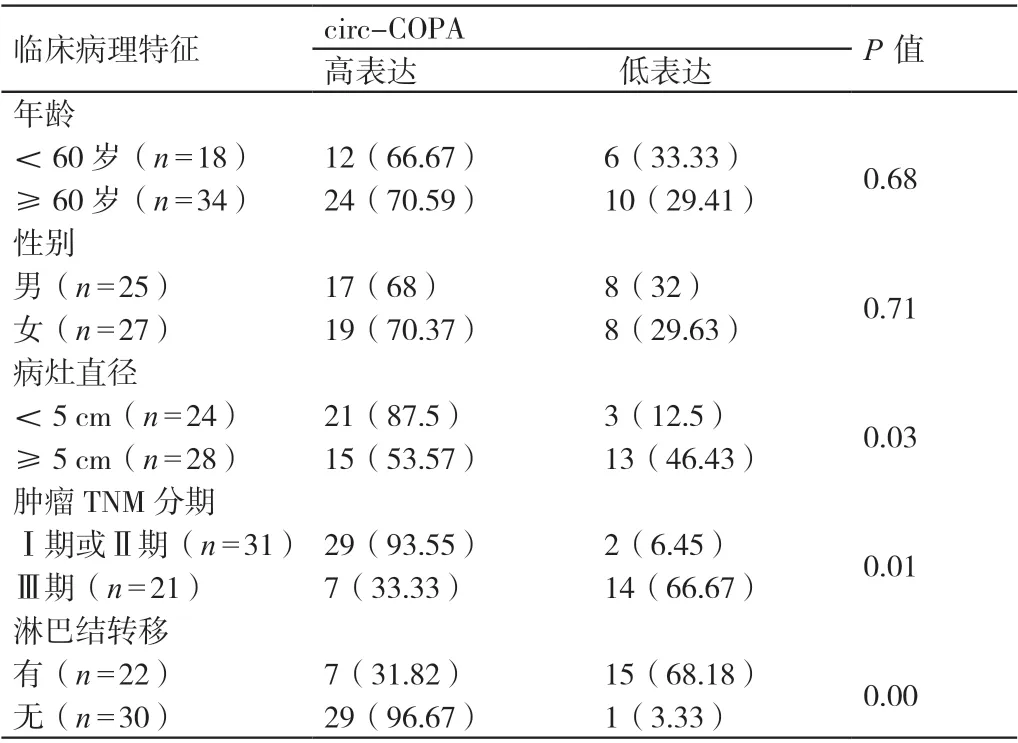
表1 52 例患者癌組織中circ-COPA 的表達量與其臨床病理特征的關系[例(%)]
2.3 兩組細胞中circ-COPA 的表達量
進行qRT-PCR 檢測的結果顯示,Control 組細胞和circ-COPA 組細胞中circ-COPA 的表達量分別為(1.17±0.39) 和(10.79±1.28)。circ-COPA 組 細 胞 中circ-COPA 的表達量是Control 組細胞的9.22 倍,組間差異有統計學意義(t=7.18,P<0.01)。
2.4 兩組細胞增殖能力的比較
在培養2 d、3 d、4 d、5 d 后,circ-COPA 組細胞的吸光度均低于Control 組細胞,P<0.05。詳見表2。
表2 兩組細胞培養后不同時間吸光度的比較(± s )
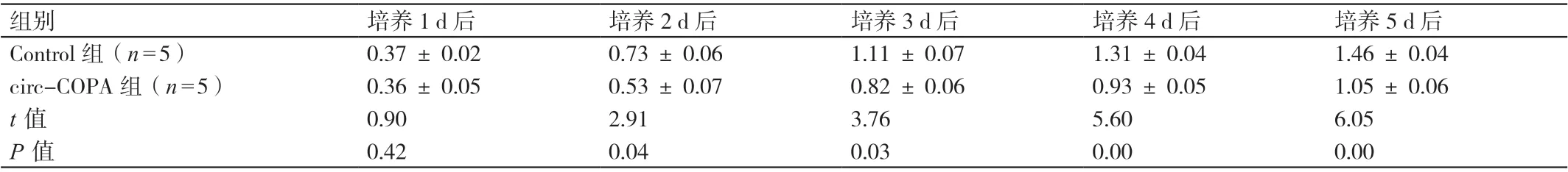
表2 兩組細胞培養后不同時間吸光度的比較(± s )
組別 培養1 d 后 培養2 d 后 培養3 d 后 培養4 d 后 培養5 d 后Control 組(n=5) 0.37 ± 0.02 0.73 ± 0.06 1.11 ± 0.07 1.31 ± 0.04 1.46 ± 0.04 circ-COPA 組(n=5) 0.36 ± 0.05 0.53 ± 0.07 0.82 ± 0.06 0.93 ± 0.05 1.05 ± 0.06 t 值 0.90 2.91 3.76 5.60 6.05 P 值 0.42 0.04 0.03 0.00 0.00
2.5 兩組細胞侵襲能力的比較
進行Transwell 小室實驗的結果顯示,Control 組細胞和circ-COPA 組細胞的侵襲數分別為(48.29±4.93)個和(18.88±3.75)個;與Control 組細胞相比,circ-COPA 組細胞的侵襲數較低,t=4.75,P<0.01。詳見圖2。
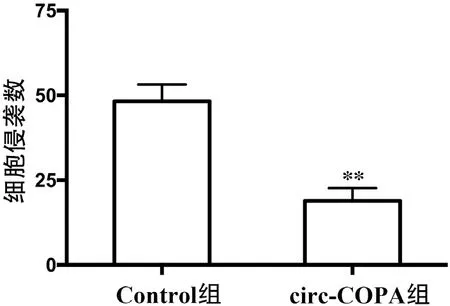
圖2 兩組細胞侵襲數的比較(注:** 與Control 組相比,P <0.01)
2.6 兩組細胞中OPCMLmRNA 表達量的比較
進行qRT-PCR 檢測的結果顯示,Control 組細胞和circ-COPA 組細胞中OPCML mRNA 的表達量分別為(1.09±0.26)和(5.62±0.61),組間差異有統計學意義(t=6.89,P<0.01)。
2.7 兩組細胞中OPCML 表達量的比較
進行Western blot 檢測的結果顯示,Control 組細胞和circ-COPA 組細胞中OPCML 的表達量分別為(1.19±0.21)和(5.22±0.88), 組 間 差 異 有 統 計 學 意 義(t=4.46,P<0.01)。詳見圖3。
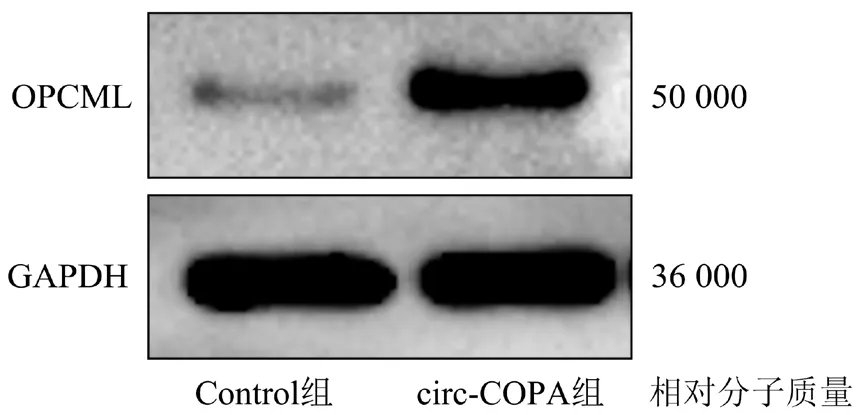
圖3 兩組細胞中OPCML表達量的比較
3 討論
有研究指出,circRNA 在胃癌組織和癌旁組織中的表達水平存在較大差異,其表達水平可能與胃癌的發生、發展密切相關[5]。相關的研究顯示,跨膜蛋白87A(transmembrane protein 87A,TMEM87A)、circ_0032821等circRNA 在胃癌組織中表達水平的變化情況與胃癌的發生密切相關[6-8]。本研究的結果顯示,與癌旁組織相比,52例患者癌組織中circ-COPA 的表達量較低,P<0.05。在52 例患者中,年齡≥60 歲患者與年齡<60 歲患者中存在癌組織中circ-COPA 低表達情況患者的占比相比,P>0.05;男性患者與女性患者中存在癌組織中circ-COPA 低表達情況患者的占比相比,P>0.05 ;與病灶直徑<5 cm 的患者相比,病灶直徑≥5 cm 患者中存在癌組織中circ-COPA低表達情況患者的占比較高,P<0.05 ;與腫瘤TNM 分期為Ⅰ期或Ⅱ期的患者相比,腫瘤TNM 分期為Ⅲ期患者中存在癌組織中circ-COPA 低表達情況患者的占比較高,P<0.05 ;與未發生淋巴結轉移的患者相比,發生淋巴結轉移患者中存在癌組織中circ-COPA 低表達情況患者的占比較高,P<0.05。這表明,胃癌患者癌組織中circ-COPA 的表達水平與其腫瘤的TNM 分期、病灶直徑及淋巴結轉移的情況有關,circ-COPA 在診斷胃癌及判斷胃癌患者預后方面的應用價值較高。本研究的結果顯示,在培養2 d、3 d、4 d、5 d 后,circ-COPA 組細胞的吸光度均低于Control 組細胞,P<0.05。進行Transwell 小室實驗的結果顯示,與Control 組細胞相比,circ-COPA 組細胞的侵襲數較低,P<0.05。這表明,上調胃癌SGC7901 細胞中circ-COPA 的表達水平能夠抑制其增殖和侵襲能力。有研究指出,circRNA 可通過增強靶基因mRNA 的穩定性來調控腫瘤細胞的生物學行為[9]。相關的研究表明,circ-COPA 的可能靶基因為OPCML 基因。OPCML 基因位于染色體11q25,基因長度為600 kb,由7 個外顯子組成[10]。OPCML 屬于免疫球蛋白超家族,可參與調控細胞的識別和黏附,在細胞分化、發育方面發揮著重要的作用[11]。有研究指出,胃癌患者癌組織中OPCML 的表達水平與其腫瘤分期和分級有顯著的相關性,上調其OPCML 的表達水平可抑制其體內癌細胞的增殖和侵襲[12]。本研究的結果顯示,Control 組細胞和circ-COPA 組細胞中OPCML mRNA 的表達量分別為(1.09±0.26)和(5.62±0.61),組間差異有統計學意義(t=6.89,P<0.01)。Control 組細胞和circ-COPA 組細胞中OPCML 的表達量分別為(1.19±0.21)和(5.22±0.88),組間差異有統計學意義(t=4.46,P<0.01)。這表明,上調胃癌SGC7901 細胞中circ-COPA 的表達水平能夠促進OPCML mRNA 和OPCML 的表達。有研究指出,circ-COPA 能夠增強OPCML mRNA 的穩定性,其對胃癌細胞增殖和侵襲的影響可能與其能夠促進OPCML 基因表達有關。
綜上所述,與癌旁組織相比,胃癌組織中circ-COPA的表達水平較低。上調胃癌SGC7901 細胞中circ-COPA的表達水平能夠抑制其增殖和侵襲能力。circ-COPA 對胃癌SGC7901 細胞增殖和侵襲能力的影響可能與其能夠促進OPCML 基因的表達有關。

