1 例尿毒癥合并耐碳青霉烯肺炎克雷伯菌感染患者的藥學監護
姜 楠,任海霞,莫廣艷 (. 中國人民解放軍總醫院第七醫學中心藥理科,北京 00700;. 天津市第一中心醫院藥學部,天津 009;. 廣西壯族自治區人民醫院臨床藥學科,廣西 南寧 500)
在美國疾病預防控制中心耐碳青霉烯類腸桿菌(CRE)控制指南(2012 年版)中,定義耐碳青霉烯肺炎克雷伯菌 (CRKP),是指在藥敏試驗中至少對厄他培南、美羅培南或亞胺培南其中之一者耐藥,且對頭孢曲松、頭孢噻肟及頭孢他啶耐藥的肺炎克雷伯菌(KP)。CRKP 引發的血流感染 (BSI)因藥物選擇有限,致死率高達54.3%[1]。長期規律血液透析(HD)的尿毒癥患者CRKP 血流感染時,因HD 的特殊性,更增加了治療難度,特別是使用氨基糖苷類藥物開展治療時。臨床藥師需要根據HD 患者代謝和排出的實際情況,結合藥動學/藥效學(PK/PD)理論對藥物選擇、劑量計算、以及給藥時間進行優化。本文以1 例 HD 尿毒癥患者為例,探討阿米卡星在治療合并CRKP 血流感染的透析患者時的經驗和體會。
1 病史簡介
1.1 基本信息
患者男性,64 歲,農民,身高176 cm,體重65 kg。主訴“間斷發熱2 d”,于2019 年10 月21 日入院。既往高血壓病史20 余年,多囊腎、多囊肝病史30 余年,癲癇病史1 年余,尿毒癥病史4 年,無尿狀態,規律血液透析4 年(每周一、三、五,2 次血液透析+1 次血液透析濾過),右側頸靜脈留置導管。2019 年1 月至9 月,患者因“多囊肝伴感染”多次入院治療,血培養多次報告超廣譜β 內酰胺酶(ESBLs)陽性的KP,曾多次接受哌拉西林他唑巴坦、替加環素、米諾環素、美羅培南、法羅培南等治療。入院前2 d,患者再次無明顯誘因出現發熱,體溫最高37.5 ℃,伴畏寒寒戰,腰痛及呃逆,無明顯咳嗽咳痰,服用“法羅培南”無明顯改善,為求進一步診治再次入院。入院查體:體溫(T)38.6 ℃、脈搏(P)112 次/min、呼吸頻率(R)22 次/min、血壓(BP)117/97 mmHg。患者呈慢病面容,被動體位,查體欠合作,雙肺呼吸音清,未聞及干濕啰音,腹部膨隆,無壓痛及反跳痛,移動性濁音陽性,肝腎區無叩痛。輔助檢查:血常規:白細胞計數(WBC) 10.74×109/L、中性粒細胞百分比(N%) 85.8%、血紅蛋白(Hb) 109 g/L、血小板(PLT) 117×109/L;血生化:尿素氮(BUN) 30.8 mmol/L、肌酐(Cr) 912μmol/L、丙氨酸氨基轉移酶(ALT) 6 U/L、天冬氨酸氨基轉移酶(AST) 8 U/L;C-反應蛋白(CRP) 254 mg/L、降鈣素原(PCT) 17.35 ng/ml、血沉(ESR) 95 mm/h。腹部核磁示肝右葉多發片狀DWI 異常信號影,多囊肝,雙側多囊腎。胸部CT 未見異常。入院診斷:肝囊腫合并感染、尿毒癥、血液透析狀態、慢性左心功能不全、心功能Ⅲ級、心律失常、陣發性房顫。
1.2 治療經過
入院當日抽取靜脈血做細菌培養,經驗性給予美羅培南0.5 g,1 次/d。治療期間,患者仍間斷發熱,體溫在37~38 ℃波動。10 月26 日化驗結果顯示:WBC 5.35×109/L、N% 71.2%、BUN 18.41 mmol/L、Cr 631μmol/L、CRP 179 mg/L、PCT 16.97 ng/ml、ESR 96 mm/h。10 月26 日細菌血培養為產絲氨酸碳青霉烯酶(KPC)的CRKP (藥敏見表1)。導管內血培養陰性。臨床藥師對導管相關感染進行評估:患者導管處皮膚干燥,無滲液,考慮血流感染與多囊肝伴發的感染可能性更大。藥敏結果示病原菌對氨基糖苷類藥物敏感。經確認,患者本人及家族成員無氨基糖苷類藥物的過敏史與不良反應史。臨床藥師建議:選擇美羅培南聯合敏感藥物阿米卡星抗感染治療。美羅培南劑量增加至0.5 g 每12 h給藥1 次,延長滴注時間至2 h。阿米卡星首次劑量給予0.8 g,維持劑量0.2 g,于每次透析后給藥,滴注時間不少于30 min。
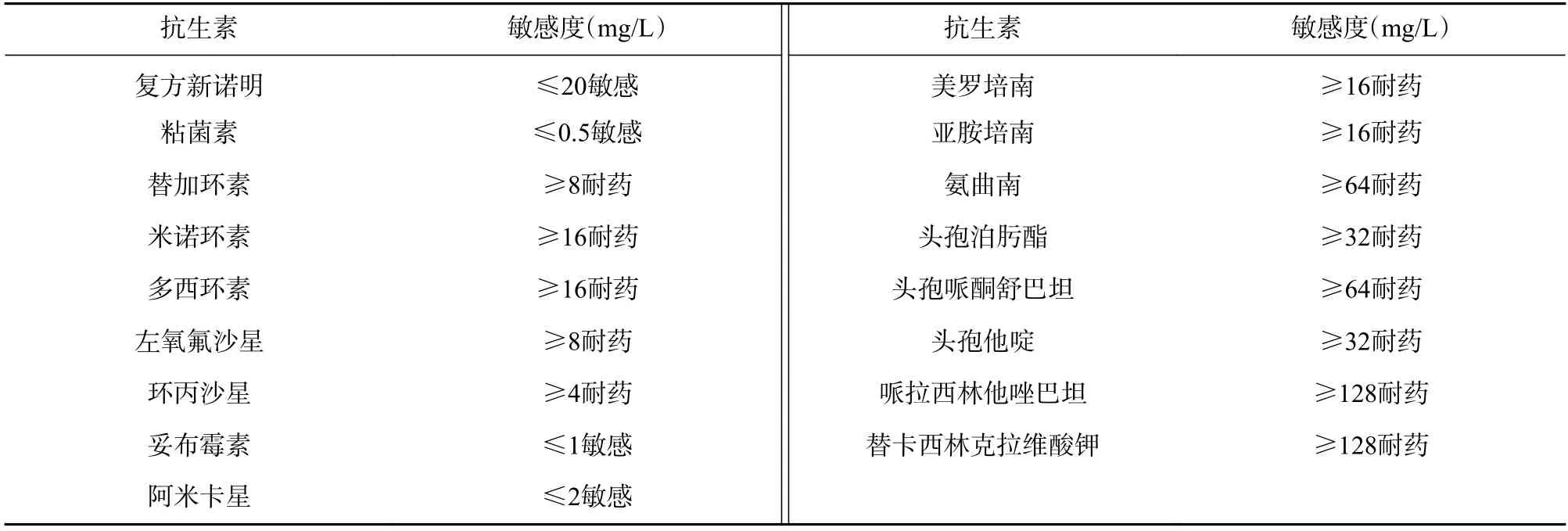
表1 患者肺炎克雷伯菌血培養和藥敏結果
10 月27 日,患者體溫恢復正常,病情緩解,查體:T 35.9 ℃、P 60 次/min、R 16 次/min、BP 148/93 mmHg。10 月29 日WBC 5.7×109/L、N% 59%、CRP 30.25 mg/L、PCT 3.92 ng/ml、ESR 67 mm/h。10 月30 日,患者血培養結果陰性,病情平穩,未訴不適。11 月4 日,患者體溫、炎性指標等檢測指標均正常,在院期間,患者未出現頭暈、耳鳴等不良反應。11 月8 日,患者遵醫囑出院。兩周后電話隨訪,患者未再出現發熱。
2 討論
2.1 氨基糖苷類藥物在CRKP-BSI 中的治療地位
CRKP 是一類具有較厚莢膜且大多數存在菌毛的 G?菌,較厚的莢膜與高耐藥性相關[2]。近5 年來,CRKP 的抗菌治療一般局限于頭孢他啶/阿維巴坦、美羅培南/維博巴坦、多粘菌素、替加環素、磷霉素、碳青霉烯類以及氨基糖苷類等藥物[3-7]。氨基糖苷類藥物因存在神經毒性和腎毒性,較少用于一線治療,因此對許多耐藥菌仍有一定的敏感性,常常用于耐藥 G?菌的聯合治療。多項研究表明,氨基糖苷類與β-內酰胺類藥物聯合治療 G?菌感染的休克患者時,尤其以碳青霉烯類藥物為基礎的聯合方案與任何一種單藥治療方案相比可顯著降低患者病死率[8-9,10-11]。根據藥敏結果,藥師建議美羅培南抗感染治療聯合藥敏敏感且價格低廉的阿米卡星作為治療方案。阿米卡星可破壞KP 胞漿膜的完整性,通過抑制致病菌蛋白質的合成發揮抑菌作用,對KP 的敏感率為85.7%[12]。
2.2 規律血液透析(HD)患者阿米卡星劑量如何調整
2.2.1 氨基糖苷類藥物藥動學/藥效學(PK/PD)特點及給藥方式
氨基糖苷類藥物是濃度依賴性的靜止期殺菌劑,有3 個PK/PD 特點:①預測療效的PK/PD 指標主要為血藥峰濃度/最小抑菌濃度(cmax/MIC)≥8~10[13]或0~24 h 藥時曲線下面積/最小抑菌濃度(AUC0~24/MIC) ≥100[14];②抗菌藥物后效應(PAE)較長,阿米卡星對KP 的PAE>12 h[15];③有耐藥適應性,即接觸藥物暴露后細菌殺滅率降低,可能是細菌對藥物的攝取下調導致的[9]。氨基糖苷類藥物最理想的體內過程,是獲得高的cmax,以及一段時間的無藥期,以減少適應耐藥性。這是氨基糖苷類藥物提高給藥劑量、延長給藥間隔的理論基礎。對于腎臟功能正常的人群,氨基糖苷類藥物推薦的給藥方式多為每日劑量一次給予[9,14]。
2.2.2 氨基糖苷類藥物HD 患者的給藥時機選擇
氨基糖苷類藥物是中等分子量(465~600)的化合物,蛋白結合低,分布體積較小。HD 可以有效清除氨基糖苷類藥物。HD 患者,傳統的給藥方式是首劑給予腎功能正常患者的推薦劑量,每次透析后補充正常劑量的一半。有新的觀點提倡,每次HD 之前給予正常劑量[16-17],或在透析過程中給藥,以獲得體內較高的cmax,隨后由透析過程將體內藥物濃度降低。但是這種給藥方式也有局限性:①必須依賴于準確的HD 療程將藥物濃度降低,否則,會導致藥物蓄積,加重不良反應。②對于可能因意外情況而中斷HD 的患者以及不能進行血藥濃度監測的醫療機構,有一定的風險。③HD 患者無法完全排出體內的氨基糖苷類藥物,不存在無藥期,不能減少細菌獲得性耐藥產生[18]。臨床藥師結合本例患者的癲癇病史,且我院尚未開展阿米卡星血藥濃度監測的實際情況,仍建議選擇傳統的透析后補充低劑量的策略,醫生采納。
2.2.3 阿米卡星HD 患者給藥劑量計算
根據桑德福《抗微生物指南》(第48 版)推薦,阿米卡星尿毒癥患者行血液透析的給藥方案為:①2 次/d 給藥方案:7.5 mg/kg,間隔48 h 再次給藥,做透析后額外增加3.75 mg/kg。②1 次/d 給藥方案:首劑(推薦劑量15 mg/kg),間隔72 h+透析后額外補充3 mg/kg。根據PK/PD 理論,本例患者選擇1 次/d 的給藥方式。
Hideo[19]等對阿米卡星PK/PD 評價發現:對于MIC≤2 mg/L,10 mg/kg 可獲得>90%的治療目標。本例患者校正體重68.8 kg,負荷劑量選擇10 mg/kg給藥,給藥劑量0.69 g。根據制劑規格0.2 g/支,給予0.8 g(11.6 mg/kg),每日一次。維持劑量:每周一、三、五規律血透,每次透析后給藥0.2 g(3 mg/kg)。患者用藥后,第2 天體溫下降至正常。
2.3 尿毒癥患者使用阿米卡星安全性及相關監護指標
氨基糖苷類藥物可導致聽覺、前庭毒性和腎臟毒性以及神經肌肉阻滯。氨基糖苷類耳毒性發生率為15%~20%,通常表現為聽力下降或損失,以及前庭損害,同時使用其他腎毒性藥物時[20],須關注耳毒性反應。
氨基糖苷類藥物存在腎損害、神經肌肉病、食物中毒、低鈣血癥,同時使用肌松藥時,需關注可能出現呼吸衰竭等嚴重不良反應[21]。神經肌肉阻滯的發生與滴速有關,滴注時間至少30 min 以上。本例患者未出現聽力損傷及神經肌肉阻滯不良反應。

