噬血細胞綜合征合并橋腦中央髓鞘溶解癥1例報道
張礫丹,張紅賓
(重慶醫科大學附屬第一醫院血液科 400016)
噬血細胞綜合征(HLH)又稱噬血細胞性淋巴組織細胞增多癥,是由原發或繼發性免疫異常引起的淋巴細胞,單核細胞和巨噬細胞系統異常激活、增殖,分泌大量炎性細胞因子而引起的一系列炎性反應,最終導致組織浸潤和多器官系統衰竭[1]。HLH可根據觸發因素不同而分為原發性(遺傳性)和繼發性(獲得性)。原發性HLH中常由基因缺陷所引起。繼發性HLH可繼發于各種感染、腫瘤、自身免疫性疾病等,其中感染相關HLH是最常見的形式[2]。臨床上以持續發熱、肝脾腫大、全血細胞減少、凝血功能障礙、肝功能不全、神經功能紊亂、高甘油三酯血癥、高鐵蛋白血癥以及在骨髓、肝、脾、淋巴結組織中發現噬血現象為主要特征[3]。HLH是一種進展迅速的高致死性疾病,即使積極接受治療的患者死亡率也較高。
橋腦中央髓鞘溶解癥(CPM)是一種由腦干神經細胞髓鞘損傷引起的神經系統疾病,是橋腦中央罕見的對稱性脫髓鞘疾病。CPM主要的病理特征為橋腦中央髓鞘破壞和少突膠質細胞丟失,并伴有充滿脂肪的巨噬細胞,其病灶多為對稱且界限清晰。CPM在普通人群中的患病率為0.25%~0.50%,其病因最初被認為是酒精性中毒和慢性營養缺乏,但后來發現低鈉血癥快速糾正以及過度糾正是其主要原因,其他原因常為高滲透壓血癥以及滲透壓波動較大[4-5]。臨床癥狀可能存在多樣,常見的臨床表現為意識障礙、假性球麻痹和四肢癱瘓。此病進展迅速,預后較差,可能導致永久性認知功能損害。在此,報道1例在HLH治療過程中出現CPN的患者。
1 病例資料
患者,女,51歲,2019年8月患者因間斷發熱入院,入院后相關檢查示三酰甘油(TG)2.81 mmol/L,鐵蛋白8 763 ng/mL,可溶性CD25>7 500 U/mL,NK細胞活性減低,骨髓穿刺涂片:骨髓增生活躍,可見少量異常淋巴細胞,易見組織吞噬以及噬血現象。根據患者臨床癥狀以及實驗室檢查,該患者可明確診斷為HLH,明確診斷后予以HLH-2004方案治療,治療期間復查患者鐵蛋白較初診時有下降趨勢。患者使用依托泊苷化療8次后,于2019年11月8日再次入院。入院后相關檢查結果示,WBC 0.3×109,血紅蛋白60 g/L,血小板計數160×109,TG 2.01 mmol/L,鐵蛋白25 921 ng/mL,鉀3.3 mmol/L,鈉120 mmol/L,氯86 mmol/L。入院后立即予以口服以及靜脈輸注10%氯化鈉,次日復查電解質示:鈉132 mmol/L,氯104 mmol/L。結合患者白細胞和血紅蛋白降低,TG以及鐵蛋白均較前有升高,復查骨髓涂片示:骨髓增生欠缺,粒系核漿發育不平衡伴成熟受阻,組織細胞占8%,可見吞噬現象,異性淋巴細胞占5%,考慮HLH復發,予以靜注人免疫球蛋白0.4 mg·kg-1·d-1連續沖擊治療3 d,并予以亞胺培南西司他丁鈉、替考拉寧、氟康唑聯合抗感染,后于2019年11月19日再次予以EP(依托泊苷+甲潑尼龍)+環孢素治療。患者于住院期間(2019年11月26日)訴雙下肢乏力,伴肌肉萎縮,查體:神志清醒,滿月面容,雙側瞳孔等大等圓,對光反射靈敏。頸阻(-),雙側腱反射對稱,雙上肢腱反射(++),雙下肢腱反射(+)。四肢肌肉容積減少,以近端肌肉為主,四肢肌力5級,無感覺障礙,雙側病理征(-)。追問患者病史,患者訴于確診HLH并使用激素后,逐漸開始出現四肢乏力伴肌萎縮,以雙下肢為主。完善頭顱MRI檢查示(圖1):腦橋內見斑片狀長T1、長T2、flair高信號影,DWI呈稍高信號,增強后未見明顯強化,考慮腦橋中央髓鞘溶解綜合征可能,炎癥待排。但因患者既往未行頭顱CT/MRI檢查,故暫無法明確患者雙下肢乏力癥狀為CPN引起或因長期使用激素所致。遂繼續予以甲潑尼龍治療,后患者于住院期間病情加重,多次復查TG以及鐵蛋白水平均較高,復查胸部CT提示雙肺彌漫分布大片狀致密影,后患者出現呼吸衰竭,最終死亡。
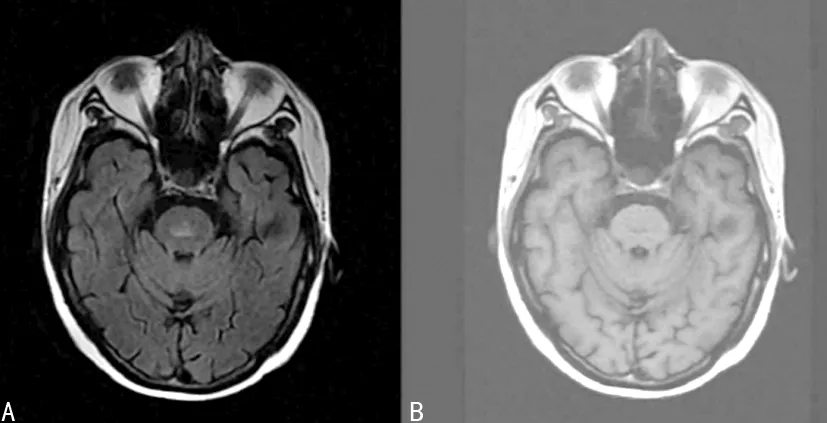
A:T1FLAir;B:T2Flair。
2 討 論
HLH患者當其出現累及中樞神經系統的癥狀時,其中較常見的包括:頭痛、腦腦膜炎、意識障礙、癲癇發作、共濟失調、肢體癱瘓、顱神經受損、眼震、顱內壓增高、易怒、記憶力減退等[6-7]。但出現橋腦中央溶解癥的患者在國內外較少有報道。橋腦中央溶解癥發病率低,臨床上罕見,與年齡、性別無明顯關系。CPM特征性病理變化是位于橋腦基底部中央的病灶脫髓鞘改變,而神經細胞、軸突和血管結構相對保留完整,病變呈對稱性分布[8]。目前CPM的發病機制尚未完全明確,其發病原因可能與電解質紊亂、低鈉血癥糾正過快、慢性酒精中毒、長期營養不良、自身免疫系統病等,也可能與肝腎衰竭、肝移植、敗血癥、霍奇金病、大面積燒傷和惡性腫瘤有關,其中低鈉血癥為引起CPM最常見的原因[9-11]。CPM通常表現為共濟失調、昏迷、反射減退、構音障礙、言語障礙、嗜睡、眼肌麻痹或者四肢癱瘓,部分患者也可無癥狀[12-13]。目前隨著頭顱CT/MRI的檢查技術的提高以及廣泛應用,CPM的診斷率逐漸提高,MRI檢查對CPM的診斷較CT更準確,MRI對檢測髓鞘溶解癥非常敏感,一些表現為輕度甚至無癥狀的患者通過MRI檢查而被發現[9]。CPM在MRI上表現為橋腦基底部中央區出現對稱分布的異常信號,T1呈等、低信號,T2及T2 FLAIR序列呈高信號,邊緣清楚,形態多樣[14]。CPM的預后與臨床表現嚴重程度、原發病及影像學結果均無關[15]。因CPM發病機制尚未明確,故對于該病暫無有效的治療方式,需以預防為主,并積極處理原發疾病,糾正電解質紊亂等。現已有文獻指出予以糖皮質激素、促甲狀腺素釋放激素、免疫球蛋白、血漿置換以及營養神經等對癥支持治療有一定的療效[16-17]。為預防該疾病的發生,一些學者認為需健康膳食,減少飲酒,如出現低鈉血癥不可糾正過快,慎重應用高滲透性鹽水,限制液體總入量[18]。本例患者有HLH基礎疾病,在疾病治療期間出現雙下肢乏力癥狀以及肌萎縮表現,頭顱MRI檢查提示CPN可能,結合患者考慮診斷為CPN之前存在低鈉血癥,故不除外患者CPN為過快糾正低鈉血癥所引起。該患者在確診為HLH后予以化療后疾病控制尚可,后期HLH進展,且合并嚴重肺部感染,最終患者因呼吸衰竭死亡。雖然患者死亡原因可能并非由CPN引起,但CPN可能在疾病進程中加速了HLH的進展。故臨床醫生需意識到血液系統疾病進程中也可能出現橋腦髓鞘中央溶解綜合征,在其他疾病的治療過程中,需預防橋腦中央溶解綜合征的發生,為患者提供更佳的預后。

