鹽酸安羅替尼或甲磺酸阿帕替尼治療晚期實體惡性腫瘤療效及對患者凝血功能的影響
魏 娜,張曉智
(1.西安交通大學,陜西 西安 710061;2.西安國際醫(yī)學中心醫(yī)院,陜西 西安 710100;3.西安交通大學第一附屬醫(yī)院,陜西 西安 710061)
惡性腫瘤患者常常都合并血液的高凝狀態(tài),容易形成血栓和癌栓,引起嚴重的不良后果,是致其死亡的重要原因之一[1]。最近,越來越多證據(jù)表明:化放療等抗腫瘤治療會導致凝血-纖溶系統(tǒng)的功能紊亂。部分研究者認為惡性腫瘤患者化療以后D-二聚體(D-Dimer,D-D)和纖維蛋白原(Fibrinogen,FIB)水平明顯上升,活化部分凝血活酶時間(Activated partial thromboplastin time,APTT) 、凝血酶原時間(Prothrombin time,PT) 以及凝血酶時間(Prothrombin time,TT) 等指標可變或不變,化療會加重患者的凝血功能障礙[2-3]。然而,更多學者認為化療對患者凝血功能的影響與其療效有關(guān),在化療后療效較好的患者中,化療后D-D和FIB等指標明顯降低,血液的高凝狀態(tài)有所緩解[4-7]。放療與患者凝血功能的相關(guān)性研究還較少,但有文獻報道,放療也能導致患者凝血統(tǒng)的功能紊亂,且隨照射劑量的增加更加明顯[8]。
在腫瘤的發(fā)生、發(fā)展過程中會產(chǎn)生大量的新生血管,產(chǎn)生的這些新生血管為腫瘤的生長提供養(yǎng)分,同時也促進了腫瘤細胞的遠處轉(zhuǎn)移,在體內(nèi)其他部位形成轉(zhuǎn)移灶。Hanahan等[9]的研究發(fā)現(xiàn),在腫瘤新生血管形成過程中有來自“血管生成開關(guān)”的調(diào)節(jié),負責血管生成開關(guān)的增強或抑制因子會發(fā)生相應(yīng)的改變,當“開關(guān)”在開放狀態(tài)時,會有大量的新生血管形成。近些年,針對腫瘤血管生成的研究已從早期的非特異性栓塞、切斷腫瘤血流供應(yīng),進展到了靶向,特異阻斷腫瘤新生血管的新階段。目前為止,還未見抗腫瘤血管生成的靶向藥物對凝血系統(tǒng)影響的相關(guān)研究。本研究擬觀察晚期實體惡性腫瘤患者口服抗血管生成藥物的近期療效,并通過觀察治療期間凝血相關(guān)指標的動態(tài)變化,了解抗血管生成藥物對凝血功能的影響。
1 資料與方法
1.1 一般資料 回顧性分析2018年3月至 2019年12月我院腫瘤內(nèi)科收治的惡性腫瘤患者64例,其中34例患者經(jīng)過了抗血管生成靶向藥物治療作為觀察組,34例中男20例,女14例,年齡 38~86歲,平均63歲;肺癌24 例,胃癌5例,食管癌2例,卵巢癌1例,子宮內(nèi)膜癌1例,滑膜肉瘤1例。同期30例僅接受了單純的姑息對癥治療患者作為對照組,男19例,女11例,年齡 34~83歲,平均67歲;肺癌19 例,胃癌3例,食管癌2例,卵巢癌2例,乳腺癌2例,子宮內(nèi)膜癌2例。所有患者臨床分期均為Ⅳ期。病例納入標準:①病理診斷明確,有完整的病史資料;②Ⅳ期實體惡性腫瘤,有可測量的靶病灶;③經(jīng)放化療等治療后病情進展,無手術(shù)指征。排除標準:①既往或目前存在血栓;②有活動性出血或合并血液病、肝硬化;③3個月內(nèi)曾輸血或使用過影響凝血功能的藥物;④治療期間病情快速進展甚至死亡;⑤依從性差。兩組患者間年齡、性別構(gòu)成等比較無統(tǒng)計學差異(均P>0.05),具有可比性。
1.2 治療方法 觀察組中23例(肺癌22例,滑膜肉瘤1例)口服鹽酸安羅替尼膠囊10~12 mg,1次/d,3周方案(口服2周、停藥1周);11例(肺癌2例,胃癌5例,食管癌2例,卵巢癌1例,子宮內(nèi)膜癌1例)口服甲磺酸阿帕替尼片0.25~0.5 g,1次/d,連續(xù)服藥直至病情進展或不能耐受不良反應(yīng)。對照組30例僅接受了單純的姑息對癥治療。
1.3 實體瘤患者療效評價 按WHO實體瘤客觀療效評價標準分為完全緩解(CR)、部分緩解(PR)、疾病穩(wěn)定(SD)、疾病進展(PD)。治療6周后評價近期療效。
1.4 檢測指標 患者治療前2~7 d,治療6周后,均空腹采集患者靜脈血。標本以3.8%枸櫞酸鈉1∶9抗凝,3000 r/min離心 10 min,分離上清液置-20 ℃冰箱待測。檢測凝血指標:凝血酶原時間(PT)、活化部分凝血活酶時間 (APTT)、纖維蛋白原濃度(FIB)、D-二 聚 體(D-D)、國際標準化比值(INR)和纖維蛋白原降解產(chǎn)物(FDP)。正常參考范圍:PT 11~15 s, APTT 22~34 s,INR 0.80~1.24,F(xiàn)IB 2.00~4.00 g/L,D-D 0~0.55 mg/L,F(xiàn)DP 0~5.00 μg/ml。

2 結(jié) 果
2.1 兩組患者治療前凝血功能指標變化情況 52例(82%)治療前基礎(chǔ)D-D值升高(范圍:0.15~12.2 mg /L),33例(52%)基礎(chǔ)FIB升高(范圍:2.43~6.52 g /L),33例(52%)基礎(chǔ)FDP升高(范圍:1.38~12.2 μg /ml),22例(35%)基礎(chǔ)PT縮短(范圍:9.8~14.5 s),7例(11%)基礎(chǔ)APTT 延長,7例(11%)基礎(chǔ)APTT 縮短(范圍:21.1~34.6 s)。
2.2 兩組患者治療6周后療效 觀察組口服抗血管生成藥物6周后療效評估,CR 0例,PR 12例(肺癌9例、胃癌2例、子宮內(nèi)膜癌1例),SD 12例(肺癌8例、胃癌2例、食管癌2例),PD 10例(肺癌7例、滑膜肉瘤1例、胃癌1例、卵巢癌1例),客觀緩解率(ORR)35%,疾病控制率(DCR)70%。觀察組不良反應(yīng)中高血壓7例(20.5%)、乏力9例(26.4%)、口腔黏膜炎5例(14.7%)、消化道反應(yīng)10例(29.4%)、出血2例(5.8%)、蛋白尿6例(17.6%),除1例發(fā)生3級上消化道出血外,其余患者不良反應(yīng)程度均較輕,對癥治療后緩解。對照組患者姑息治療6周后療效評估,CR 0例,PR 0例,SD 6例(肺癌3例、食管癌1例、乳腺癌1例、胃癌1例),PD 24例(肺癌16例、胃癌2例、食管癌1例、卵巢癌2例、乳腺癌1例、子宮內(nèi)膜癌2例),ORR 0%,DCR 20%。觀察組患者的近期療效明顯好于對照組,差異具有統(tǒng)計學意義(χ2=19.5912,P<0.01)。見表1。

表1 兩組患者治療6周后療效[例(%)]
2.3 兩組患者治療6周后凝血功能動態(tài) 觀察組PR亞組治療前與治療后比較APTT值升高,D-D 值降低,治療前后比較差異具有統(tǒng)計學意義(P<0.05);PT、INR、FIB以及 FDP值治療前后比較沒有統(tǒng)計學差異(均P>0.05),見表2。SD及PD亞組人群治療前后PT、APTT、INR、FIB、D-D 和FDP比較均沒有統(tǒng)計學差異(P>0.05)。對照組凝血指標結(jié)果顯示,D-D和FDP值較治療前比較有所增高(均P<0.05),其余指標比較均沒有統(tǒng)計學差異(均P>0.05)。觀察組PR亞組與對照組相比,治療前各凝血指標比較無明顯差異,治療后APTT值升高,D-D 值降低,差異具有統(tǒng)計學意義(均P<0.05),見表3。
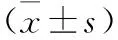
表2 觀察組PR亞組患者治療前后凝血功能指標變化

表3 觀察組PR亞組與對照組患者治療前后凝血功能指標變化
3 討 論
惡性腫瘤患者血液常常處于高凝的狀態(tài),有很多原因引起這種狀態(tài)[10]。首先,腫瘤細胞通過對血管的直接浸潤,凝血酶的產(chǎn)生,分泌血管相關(guān)通透因子,從而誘導相應(yīng)淋巴細胞、巨噬細胞細胞因子的產(chǎn)生,從而破壞血管內(nèi)皮細胞,導致血小板的聚集和黏附,活化后的血小板會表達P-選擇素,P-選擇素作用于血小板,使其產(chǎn)生組織因子,組織因子與FXⅡa結(jié)合形成復合物,凝血活化過程可使血液產(chǎn)生高凝狀態(tài),從而激活繼發(fā)的纖溶系統(tǒng),血管內(nèi)皮的損傷也會導致促凝血物質(zhì)增多、抗凝物質(zhì)減低,這些因素均會引起D-D聚體的水平上升[11]。
血液的高凝狀態(tài)可促進腫瘤的進展與轉(zhuǎn)移[12]。例如,活化后的血小板能分泌多種因子,如血小板源性生長因子(PDGF)、血管內(nèi)皮生長因子(VEGF)等,從而促進新生血管形成,同時腫瘤細胞也能誘導血小板聚集,可以將血小板誘導到周圍,協(xié)助腫瘤細胞黏附于血管,形成轉(zhuǎn)移病灶[13]。1971年,F(xiàn)olkman 教授首次提出“腫瘤的生長與轉(zhuǎn)移依賴于其新生血管的生成”這一理論,該理論的提出也為腫瘤抗血管生成藥物的出現(xiàn)提供了新的研究方向和理論基礎(chǔ)。目前廣泛應(yīng)用于臨床的抗血管生成藥物主要包括血管內(nèi)皮生長因子抑制劑,如貝伐珠單抗、恩度、阿帕替尼、安羅替尼,小分子受體酪氨酸激酶抑制劑,如索拉非尼、舒尼替尼等[14]。
抗腫瘤治療如化、放療也對凝血——纖溶系統(tǒng)的功能有所影響。化療導致的患者骨髓抑制可引起血小板的生成減少,增多活化型血小板,從而影響凝血功能,一些化療藥物也能直接對血管內(nèi)皮細胞造成損傷,引起內(nèi)源性凝血過程。然而越來越多的證據(jù)證實反應(yīng)凝血功能指標的改變與患者化療的療效相關(guān)。Wang等[15]的研究報道了非小細胞肺癌患者基礎(chǔ)D-D聚體和FIB升高,PT、APTT、TT 延長,化療后D-D聚體和FIB進一步升高,PT 延長、APTT 和 TT 縮短,加重了凝血功能障礙;然而更多的研究發(fā)現(xiàn)凝血指標的變化與化療療效相關(guān),Yu等[4]報道了非霍奇金淋巴瘤患者化療期間PT、APTT變化不明顯,FIB隨病情好轉(zhuǎn)而降低。Geng等[16]報道單次大劑量照射不會影響全身凝血功能。而Gao等[17]的研究則認為三維適型放療過程中,隨著照射劑量的累積,D-D聚體和FIB水平明顯升高,PT、APTT、TT 等指標則無顯著變化。潘巍等[18]研究報道局部晚期實體惡性腫瘤同步放化療會引起D-D聚體、TpP 動態(tài)升高。
目前為止尚無抗血管生成靶向治療對實體惡性腫瘤患者凝血功能的影響的相關(guān)研究報道,本研究回顧性分析對比了64例Ⅳ期實體惡性腫瘤患者治療前后各項凝血指標,其中34例口服抗血管生成藥物、30例姑息對癥治療,結(jié)果表明:①D-D聚體水平較正常人明顯升高(82%),與多項文獻報道相似,治療后療效PR組的患者血漿D-D聚體水平較前下降,差異有統(tǒng)計學意義(P>0.05),這說明晚期腫瘤患者本身存在出、凝血機制的紊亂,血液常處于高凝狀態(tài),經(jīng)抗血管靶向治療瘤體縮小,病情好轉(zhuǎn)時出、凝血機制的紊亂得已糾正,D-D聚體水平下降,病情穩(wěn)定或進展的患者D-D聚體水平治療前后相比無統(tǒng)計學差異。②療效PR亞組患者的APTT水平較前延長,差異有統(tǒng)計學意義(P>0.05),甚至部分患者APTT明顯高于正常水平,一方面說明對于治療有效的腫瘤患者,APTT和D-D聚體水平變化的臨床意義保持一致,都提示血液高凝狀態(tài)得以改善[19];另一方面,APTT延長提示有出血風險,截至目前抗血管生成藥物所致出血機制尚不完全清楚,對于先天性或獲得性凝血功能障礙者,應(yīng)用抗血管生成藥物的安全性資料少之又少。本組患者使用抗血管生成藥物后,對內(nèi)源性凝血途徑的活化部分凝血活酶時間影響較大,增加了出血風險,然而,病情穩(wěn)定及進展患者APTT比較無統(tǒng)計學差異(P>0.05)。
綜上所述,惡性腫瘤患者血液常處于高凝狀態(tài),血漿 D-D聚體水平的測定,可以作為判斷療效的指標之一[20]。當D-D聚體顯著高于正常值時應(yīng)密切關(guān)注,及時抗凝治療以降低血栓事件的發(fā)生。APTT也可作為判斷療效的一個指標,但對于顯著高于正常值者,應(yīng)考慮暫停抗血管生成藥物治療及抗凝治療,預防出血事件發(fā)生。但因本研究病例數(shù)偏少,抗血管生成靶向治療時間較短,觀察到的數(shù)據(jù)結(jié)論不十分確切,建議進行多中心、大樣本的臨床試驗驗證。

