基于溝眶象屬兩近緣種不同蟲態轉錄組的氣味受體基因鑒定及表達分析
路 藝, 王 倩, 溫俊寶
(北京林業大學林學院, 林木有害生物防治北京市重點實驗室, 北京100083)
昆蟲的嗅覺過程是氣味分子作用下多種蛋白協同運作并通過神經系統產生感知的過程,其中外周神經系統中的氣味受體(odorant receptor, OR)被認為是嗅覺系統高選擇性的主要影響因素(Songetal., 2008)。昆蟲的氣味受體由多種典型氣味受體(typical odorant receptor, ORx)和一高度保守的氣味受體共受體(odorant receptor-co receptor, Orco)組成,前者在嗅感神經元(olfactory receptor neurons, ORNs)的樹突膜上專一性表達,即每種嗅感神經元只表達一種或少數幾種配體結合受體,負責識別氣味分子,而后者在大多數嗅感神經元中與配體結合受體共表達,兩者形成配體門控陽離子通道實現信號轉導(Vosshalletal., 1999; Larssonetal., 2004; Coutoetal., 2005; Satoetal., 2008; Wicheretal., 2008)。通過基因組或轉錄組分析,已經有許多昆蟲的OR基因得到了鑒定,不同物種的OR基因數量存在很大差異,大多數物種的OR基因數量少于100個,但在螞蟻、蜜蜂等膜翅目昆蟲中發現不少氣味受體基因擴張的例子,如在畢氏卵角蟻Ooceraeabiroi中注釋了503個候選的功能性OR基因,表明營社會生活的昆蟲對群居環境的一種適應性進化(McKenzie and Kronauer, 2018; Yanetal., 2020)。在鞘翅目的一種非社會性昆蟲赤擬谷盜Triboliumcastaneum中也鑒定出數量龐大的OR基因(341個OR基因,雖然數量是周期性修正的),該物種作為雜食性的倉儲害蟲需要應對人類糧倉中各種復雜氣味(Engsontiaetal., 2008; Dippeletal., 2016)。氣味受體基因的數量眾多使得后續的表達調控及功能研究成為一個漫長的過程,qPCR技術為基因在mRNA水平上的組織或時序表達分析提供了一個高效的方法。不同昆蟲的組織表達特征都顯示出觸角(最主要的嗅覺器官)中高表達的OR基因數量最多,但某些OR基因在非嗅覺組織高表達,如岡比亞按蚊AnophelesgambiaeAgOr7在味覺器官喙中觀察到顯著水平的表達,東亞飛蝗Locustamigratoria的11個OR基因在足和翅中高表達,10個OR基因在幾種內部組織(腦、睪丸、卵巢或脂肪體)中高表達,這些表達模式暗示氣味受體具有嗅覺之外的功能(Pittsetal., 2004; Lealetal., 2013; Wangetal., 2015)。OR基因在時間上的表達變化也與其功能相關,如中華蜜蜂ApisceranaceranaAcerOr167在工蜂羽化后的20日齡時表達量達到最高,此時期的工蜂需要外出采蜜,大豆食心蟲Leguminivoraglycinivorella的各齡幼蟲中均有Orco表達,但前3齡表達量顯著高于4和5齡,推測與3齡蛀莢行為有關(王宇等, 2016; 杜亞麗等, 2017)。研究OR基因在不同組織和不同階段的表達特征有助于全面了解該類基因的功能。
溝眶象Eucryptorrhynchusscrobiculatus和臭椿溝眶象E.brandti同是臭椿Ailanthusaltissima樹上的專一性蛀干害蟲,且為近緣種(陳雅媛, 2016),從分子生物學的角度對比研究其嗅覺識別機制具有一定的代表性。目前,通過觸角轉錄組分析已經在溝眶象和臭椿溝眶象中篩選出6類嗅覺相關基因,其中OR基因分別為49和45個(Wenetal., 2018)。某些氣味受體的表達具有時空差異性,所以在觸角轉錄組中未見報道,且尚未公布兩種象甲的基因組數據。因此基于溝眶象和臭椿溝眶象不同蟲態轉錄組的數據進行OR基因的鑒定及表達特征分析,補充兩種象甲的氣味受體信息,為后續的功能研究提供理論依據。
1 材料與方法
1.1 供試昆蟲和樣品收集
溝眶象和臭椿溝眶象幼蟲及成蟲于2019年4-7月采集自寧夏回族自治區石嘴山市平羅縣小興墩村(38°51′24″N, 106°31′38″E)的野外種群。在人工氣候箱(溫度26±2℃,相對濕度60%,光周期14L∶10D)中將采集的部分臭椿溝眶象成蟲雌雄配對置于塑料盒(d=5 cm)中進行短期飼養,用蘋果塊提供營養并作為產卵場所以收集卵期樣品。對采集的臭椿溝眶象幼蟲根據頭殼寬度挑選出末齡幼蟲(Luoetal., 2016),相同環境下使用半人工飼料(楊鵬, 2015)進行短期飼養直至化蛹以收集蛹期樣品。收集溝眶象和臭椿溝眶象雌、雄成蟲的觸角、喙、頭(去除觸角及喙)和足,并將腹部細化解剖為主要的內生殖器(睪丸/卵巢)、外生殖器和剩余腹部組織3部分,獲得雌、雄共14種部位的樣品。每種樣品取3個生物學重復,每重復收集數量根據組織或個體大小從1~90不等,用液氮速凍分裝儲存在-80℃冰箱中備用。
1.2 氣味受體基因ORs的鑒定和分析
從溝眶象3種蟲態(幼蟲、蛹和成蟲)轉錄組(登錄號: PRJNA689057)(武政梅, 2016)和臭椿溝眶象4種蟲態(卵、幼蟲、蛹和成蟲)轉錄組(登錄號: PRJNA688600)的數據庫中初步篩選出所有注釋為氣味受體基因的序列,通過ORFfinder(https:∥www.ncbi.nlm.nih.gov/orffinder)對初篩基因進行開放閱讀框(open reading frame, ORF)預測和蛋白質翻譯,并對翻譯得到的氨基酸序列進行Smart BLAST快速驗證,保留驗證為氣味受體的基因再次進行BLASTX(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)比對確認候選的OR基因。使用TMpred(https:∥embnet.vital-it.ch/software/TMPRED_form.html)在線工具對候選的OR基因進行跨膜區預測。在BioEdit 7.0.9軟件(Hall, 1999)中基于兩種象甲觸角轉錄組(登錄號: SRP155112)中鑒定得到的ORs(Wenetal., 2018)分別創建本地蛋白質數據庫,對兩種象甲蟲態轉錄組中的候選ORs分別進行Local BLAST,對比象甲種內ORs的序列相似性,并搜尋可能相同的ORs。通過BLASTP(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)比對兩種象甲種間ORs的序列相似性,尋找可能的同源基因。根據兩種象甲不同蟲態轉錄組數據中OR基因的FPKM(fragments per kilobase per million mapped fragments)值對其進行表達豐度分析。
1.3 系統發育分析
使用MEGA X軟件(Kumaretal., 2018)比對氨基酸序列,通過IQ-TREE 2.1.1軟件(Nguyenetal., 2015)的最大似然(maximum likelihood)法(Guindonetal., 2010)構建系統發育樹。系統發育樹包含了赤擬谷盜T.castaneum(Engsontiaetal., 2008)、中歐山松大小蠹Dendroctonusponderosae(Anderssonetal., 2019)、白蠟窄吉丁Agrilusplanipennis(Anderssonetal., 2019)和兩種象甲的194條ORs氨基酸序列。分支支持度通過1 000次超快自展Ultrafast(Minhetal., 2013)bootstraps計算,以5種昆蟲的Orco作為樹根,并根據前人的鞘翅目ORs亞家族分類對分支進行命名(Mitchelletal., 2020)。
1.4 總RNA提取和cDNA合成
按照RNApure高純總RNA快速提取試劑盒(艾德萊,北京)的步驟提取1.1節溝眶象和臭椿溝眶象各個樣品的RNA。取1 μL RNA溶液利用超微量紫外分光光度計NanoDrop 8000(Thermo,美國)檢測濃度和純度。對純度合格的RNA樣品按照反轉錄試劑盒TRUEscript 1st Strand cDNA Synthesis Kit(艾德萊,北京)的說明合成cDNA第1鏈,并置于-20℃冰箱中保存備用。
1.5 引物設計
根據溝眶象和臭椿溝眶象不同蟲態轉錄組數據,用Primer3Plus在線軟件(http:∥www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)設計OR基因特異性引物,分別選擇α-Tubulin(GenBank登錄號: MW459097)和ribosomalprotein(RPS11)(GenBank登錄號: MW459096)作為溝眶象和臭椿溝眶象的內參基因并設計引物(表1)。引物的合成由北京睿博興科生物技術有限公司完成。

表1 qPCR引物
1.6 qPCR檢測
將1.4節合成的cDNA樣品作為模板,根據TB Green?PremixExTaqTMⅡ試劑盒(寶生物,大連)進行qPCR檢測。實驗設置無模板的陰性對照,每種樣品含3次生物學重復,每生物學重復進行3次技術重復,通過熔解曲線評估引物的特異性。qPCR反應體系(25 μL): TB Green Premix Ex TaqⅡ 12.5 μL, 上下游引物(10 pmol/μL)各1 μL, cDNA模板2 μL, 滅菌水8.5 μL。在CFX96 Real-Time PCR Detection System (Bio-Rad, 美國)中進行qPCR反應,運行條件: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 循環40次。
1.7 數據分析
采用2-ΔΔCt方法(Livak and Schmittgen, 2001)計算基因相對表達量,通過SPSS 26.0軟件進行統計學分析,對OR基因在不同組織、不同發育階段的表達量差異進行單因素方差分析(ANOVA),并用Duncan氏新復極差法進行多重比較;使用Origin 2018繪制基因的組織表達譜。
2 結果
2.1 溝眶象氣味受體基因的鑒定
從溝眶象3種蟲態轉錄組數據庫中鑒定出6個候選的氣味受體基因EscrORs,都具有完整的開放閱讀框。通過與溝眶象觸角轉錄組的ORs進行序列比對,發現其中2個EscrOR基因是已發表的EscrOR42(GenBank登錄號: MW419358)和EscrOR38(GenBank登錄號: MW419354)(Wenetal., 2018)(氨基酸序列一致性達到100%)。另外4個EscrOR基因是新鑒定的基因(表2),依照觸角轉錄組的EscrOR基因名稱按順序命名為EscrOR50-53(GenBank登錄號: MW170367-MW170370),它們的編碼長度范圍為122~187個氨基酸,有1~2個跨膜結構域,與溝眶象其他ORs的氨基酸序列一致性都在60%以下。在與臭椿溝眶象的ORs進行種間氨基酸序列比對時發現,EscrOR53與觸角轉錄組中注釋的EbraOR45(GenBank登錄號: MW419410)的序列一致性為90%,EscrOR53和EbraOR45可能是一對同源基因。EscrOR50-53的BLASTX比對結果顯示它們與其他昆蟲的序列一致性為37%~39%(表2)。
溝眶象4個新鑒定的OR基因在幼蟲、蛹和成蟲中的FPKM值<10,屬于低表達基因(表2)。其中,EscrOR50和EscrOR51在蛹期表達量相對較高,EscrOR52和EscrOR53在成蟲期表達量相對較高(表2)。
2.2 臭椿溝眶象氣味受體基因的鑒定
從臭椿溝眶象4種蟲態轉錄組數據庫中鑒定出4個候選的氣味受體基因EbraORs,都具有完整的開放閱讀框。通過與臭椿溝眶象觸角轉錄組的ORs進行序列比對,發現其中2個EbraOR基因是已發表的EbraOR5(GenBank登錄號: MW419370)和EbraOR37(GenBank登錄號: MW419402)(Wenetal.,2018)。 另外2個EbraOR基因是新鑒定的基因(表2),根據觸角轉錄組已發表的EbraOR1-45繼續命名為EbraOR46(GenBank登錄號: MW170372)和EbraOR47(GenBank登錄號: MW170374),它們分別編碼312和118個氨基酸,跨膜結構域分別為5和1個。EbraOR47與臭椿溝眶象觸角轉錄組中鑒定出的EbraOR29(GenBank登錄號: MW419394)具有較高的序列一致性;而EbraOR46與臭椿溝眶象其他ORs的氨基酸序列一致性在37%以下;EbraOR46和EbraOR47與溝眶象的ORs進行氨基酸序列比對未發現其同源基因。通過BLASTX比對發現EbraOR46和EbraOR47與其他昆蟲的OR序列一致性為32%~48%(表2)。
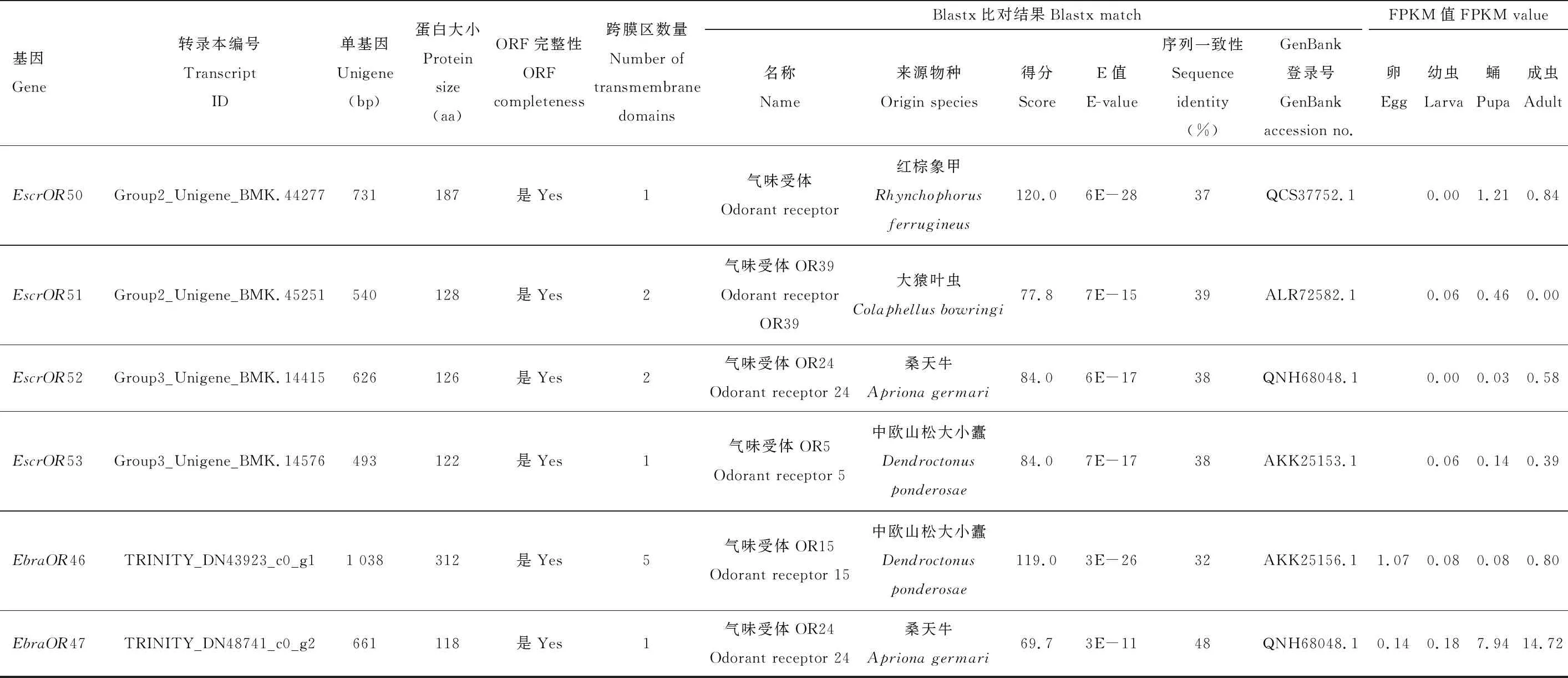
表2 溝眶象和臭椿溝眶象不同蟲態轉錄組中新鑒定的氣味受體基因
臭椿溝眶象2個新鑒定OR基因的FPKM值差異較大,EbraOR46在卵、幼蟲、蛹和成蟲中的FPKM值都較低,而EbraOR47在成蟲中的FPKM值>10,它在蛹期的表達量也較高(表2)。
2.3 溝眶象和臭椿溝眶象新鑒定氣味受體(Ors)的系統發育
系統發育分析(圖1)表明,新鑒定的6個ORs分布于2個亞家族,其中EscrOR51分布于亞家族2B,其余5個ORs(EbraOR46, EbraOR47, EscrOR50, EscrOR52和EscrOR53)都位于亞家族7。4個已發表的ORs中,EscrOR38和EbraOR37屬于亞家族1,EbraOR5屬于亞家族2A,EscrOR42屬于亞家族7。
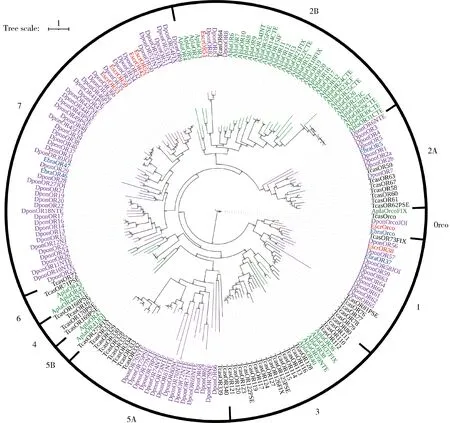
圖1 最大似然法構建的基于氨基酸序列的昆蟲氣味受體的系統發育樹
2.4 溝眶象新鑒定到的氣味受體基因的組織表達譜
EscrOR53在成蟲各組織中均幾乎無表達,EscrOR50,EscrOR51和EscrOR52 3個基因的表達譜如圖2(A-C)所示。這3個OR基因都在非嗅覺組織中高表達,其中EscrOR50和EscrOR52在雄蟲睪丸中特異高表達,在其他組織中幾乎無表達(圖2: A, C);EscrOR51在雄蟲頭部(去除觸角和喙)的表達量較高,是在其他組織中表達量的2倍以上,差異顯著(P<0.05)(圖2: B)。
2.5 臭椿溝眶象新鑒定到的氣味受體基因的時序及組織表達譜
臭椿溝眶象2個OR基因EbraOR46和EbraOR47的時序表達譜(圖3: A-B)與轉錄組數據基本一致,得到了很好的驗證。EbraOR46在卵期表達量顯著高于其他時期(P<0.05),在雌成蟲期和蛹期有少量表達,但在幼蟲期和雄成蟲期幾乎無表達(圖3: A);EbraOR47在雄成蟲期特異高表達,是蛹期表達量的7.7倍,且在卵、幼蟲和雌成蟲期未檢測到表達(圖3: B)。
臭椿溝眶象2個OR基因的組織表達譜見圖3(C-D)。EbraOR46和EbraOR47都在成蟲非嗅覺組織中高表達,EbraOR46在雌成蟲卵巢中的表達量顯著高于在其他組織中的(P<0.05),其次在雌、雄觸角及雌成蟲外生殖器中表達,在其他組織中的表達量極低或沒有檢測到(圖3: C);而EbraOR47在雄成蟲睪丸中特異高表達(P<0.05),在其他各組織中幾乎無表達(圖3: D)。
3 討論
基于本實驗室測得的蟲態轉錄組數據,在溝眶象和臭椿溝眶象中分別鑒定了4和2個新的OR基因(EscrOR50-EscrOR53,EbraOR46-EbraOR47),除EbraOR46編碼312個氨基酸,其他基因的編碼長度都低于昆蟲氣味受體的普遍長度(申思凡等, 2020),但都具有完整的開放閱讀框。在溝眶象和臭椿溝眶象ORs的種間序列比對中,發現了一對可能的同源基因EscrOR53和EbraOR45(氨基酸序列一致性為90%),兩者可能參與識別共同的信息化合物。溝眶象和臭椿溝眶象的ORs與其他昆蟲物種的ORs序列相似性都較低,體現昆蟲種間ORs的快速進化(Yanetal., 2020)。系統發育分析表明6個新鑒定的ORs分屬于鞘翅目ORs亞家族2B和7(圖1)。典型氣味受體只在嗅覺神經元中有選擇的表達,且表達量較低(喬奇等, 2008),在表達豐度分析中,大部分新鑒定的OR基因在各個蟲態中的FPKM值都小于10(表2),屬于低表達基因。
通過表達譜測定,發現溝眶象3個和臭椿溝眶象2個新鑒定的OR基因都在非嗅覺組織中高表達(圖2和3),分為睪丸特異性OR基因(EscrOR50,EscrOR52和EbraOR47)、卵巢特異性OR基因(EbraOR46)以及雄蟲頭部(去除觸角及喙)特異性OR基因(EscrOR51)。觸角和下顎須是昆蟲主要的嗅覺器官,但近年來對多種昆蟲的研究表明氣味受體會在非嗅覺組織中表達。東亞飛蝗有11個OR基因在翅和足中高表達(Wangetal., 2015)。西非蛀莖夜蛾Sesamianonagrioides(Glaseretal., 2013)、二化螟Chilosuppressalis(Xiaetal., 2015)、煙草天蛾Manducasexta(Klinneretal., 2016)和煙青蟲Helicoverpaassulta(Lietal., 2020)等蛾類的產卵器中報道了OR基因的表達。對岡比亞按蚊(Pittsetal., 2014)、東亞飛蝗(Wangetal., 2015)和中華蜜蜂(Guoetal., 2018)等多種昆蟲的研究表明在內部組織睪丸中也存在高表達的OR基因。盡管如此,我們對氣味受體在這些組織中表達的功能意義依然知之甚少。只有一些昆蟲的生殖組織中的OR基因功能得到驗證(Pittsetal., 2014; Guoetal., 2018; Lietal., 2020)。Li等(2020)在煙青蟲中進行的一系列研究首次揭示了昆蟲產卵器中表達的OR基因的功能,發現產卵器中高表達的HassOR31與寄主植物揮發物的檢測有關。昆蟲的產卵器表面常分布有感受器,其中毛形感器是最重要的化學感受器,與接收氣味分子有關(張璐, 2015),而昆蟲的內生殖器中不具備這樣的結構。Pitts等(2014)在岡比亞按蚊睪丸中鑒定出高表達的OR基因,然后提出其介導精子對內源性信號分子的反應的可能性,通過免疫組織化學發現高度保守的Orco蛋白同源物存在于多種全變態昆蟲的精子中,在岡比亞按蚊中進一步通過生物測定證明了AgOR-AgOrco異聚復合物是介導精子激活的其中一種潛在的信號通路。Guo等(2018)也推測中華蜜蜂AcerOR2(Orco)可能通過Ca2+/CaM/CaMKII信號對精子進行調控。這些研究表明Orco在昆蟲睪丸/精子中的表達很可能是保守的,OR-Orco復合物發揮的精子活化/調控功能可能是昆蟲繁殖的普遍特征,因此我們推測溝眶象和臭椿溝眶象的睪丸中也可能存在非嗅覺的功能性的ORs。臭椿溝眶象EbraOR46在雌蟲卵巢中高表達(圖3: C),這類OR基因是否相應地影響雌性生殖細胞的發育或其他生殖過程還有待探索。例如,Ma等(2019)通過RNAi沉默了廣聚螢葉甲Ophraellacommuna在卵巢中特異高表達的化學感覺基因OcomCSP12,發現雌蟲產卵量顯著降低。結合蟲態轉錄組的FPKM數據和時序表達譜可以得知,這些OR基因除在成蟲階段的生殖器官中表達,在卵、幼蟲或蛹中也有少量或較多表達,如2個睪丸特異性OR基因(EscrOR50和EbraOR47)在蛹中的表達量都較高,卵巢特異性OR基因(EbraOR46)在卵期擁有最高表達量,表明這些ORs可能在發育的早期階段就已發揮功能。
在某些昆蟲中也曾報道過頭部高表達的ORs,例如中華蜜蜂和綠盲蝽,但兩者所用的頭部均只去除了觸角,實際還包含口器附肢,所以表面仍然存在大量的感受器(安興奎, 2019; 馮宇佳等, 2020)。而我們實驗所用的象甲頭部去除了觸角和喙,應該不包含任何嗅覺和味覺組織,目前還沒有在臭椿溝眶象或者其他昆蟲報道中發現類似的情況,這可能是溝眶象氣味受體基因功能分化的一個特殊例子。這種在非嗅覺組織特異高表達的OR不太可能在氣味檢測中發揮作用,它們可能參與除嗅覺外的其他生理過程(Lealetal., 2013; Lietal., 2017)。昆蟲的頭部結構包括外部的堅硬頭殼、內部的腦和肌肉組織,而腦部又包含著嗅覺中樞觸角葉和嗅覺信息處理的基本功能單位嗅小球,未來可對頭部高表達的ORs進行具體的細胞/組織定位和功能研究。

