羊瘤胃源乳酸菌的分離鑒定及其生物學特性分析
何江波 姚志芳 吳國芳 楊雨鑫* 王 磊*
(1.西北農林科技大學動物科技學院,楊凌712100;2.青海大學畜牧獸醫科學院,西寧810016)
抗生素作為生長促進劑曾被廣泛應用于畜禽養殖。但是,隨著抗生素濫用導致的食品安全問題、生態環境問題日益凸顯,其對人類健康存在潛在威脅。《中華人民共和國農業農村部公告 第194號》公告的發布,意味著抗生素類飼料添加劑在2020年7月1日后將成為歷史[1]。因此,在無抗養殖后時代探尋抗生素替代品意義重大[2]。有研究指出,益生菌制劑可以作為抗生素的有效替代物,發揮優化動物消化道菌群、改善飼料營養代謝、增強動物免疫力的作用[3]。目前應用較廣泛的益生菌主要包括乳酸菌、酵母菌、芽孢桿菌等[4]。
目前,乳酸菌類微生態制劑應用最為廣泛,它是指一類在厭氧或兼性厭氧條件下能發酵碳水化合物產生大量乳酸的革蘭氏陽性、無芽孢細菌的總稱[5]。有報道稱乳酸菌在動物消化道內能夠抑制致病菌的生長繁殖,阻止其代謝活動,還能夠減少血清膽固醇和內毒素含量,維持消化道內微生態平衡,提高機體免疫功能[6]。而目前市場上乳酸菌制劑混亂,質量參差不齊,通常由于活菌數不夠、活性弱、抗逆性不強、同源性差等原因,導致產品性能不穩定、應用效果不明顯等諸多問題[7]。而且從菌制劑對宿主發揮作用的效果而言,同源性益生菌最佳[8],但其相關機理還有待進一步研究。因此,根據實際動物生產需要,篩選同源性并在益生功能及抗逆性方面表現良好的菌株是益生菌研究的關鍵問題,決定了乳酸菌制劑的使用效果[9]。
鑒于此,本研究擬從健康羊瘤胃內容物中分離篩選出生長速率、產酸能力、耐酸和耐膽鹽性能、抑菌能力及自凝集率等方面表現良好的菌株,同時還應考慮菌株安全特性,通過對菌株的抗生素敏感性檢測,避免抗性基因傳播,為開發適應養羊生產的乳酸菌制劑提供理論和試驗基礎。
1 材料與方法
1.1 試驗材料
1.1.1 樣品采集
分別從青海省貴南縣以及西藏拉薩地區自然放牧羊群中各隨機挑選3只1歲、體重在30~35 kg、健康的黑藏羊和白絨山羊,放血致死后取出瘤胃,快速無菌采集新鮮瘤胃內容物于50 mL滅菌離心管中,冷藏并迅速送回實驗室進行菌株分離。
1.1.2 培養基
本試驗涉及的培養基配制主要參照凌代文[10]試驗方法。MRS肉湯培養基:乙酸鈉5 g、檸檬酸三胺2 g、磷酸氫二鉀2 g、四水合硫酸錳0.25 g、硫酸鎂0.58 g、吐溫-80 1 mL、蛋白胨10 g、酵母抽提物5 g、牛肉膏10 g、葡萄糖20 g,加蒸餾水至1 L;含有碳酸鈣的MRS瓊脂培養基:在MRS肉湯中加入瓊脂20 g、碳酸鈣10 g,加蒸餾水至1 L;PY基礎培養基:蛋白胨0.5 g、酵母提取物1.0 g、胰酶解酪胨0.5 g、鹽溶液4.0 mL、蒸餾水1 L。
1.1.3 試劑盒
細菌DNA提取試劑盒購自OMEGA公司,PCR反應試劑購自TaKaRa公司。
1.2 試驗方法
1.2.1 乳酸菌的分離純化
參照王利紅[11]試驗方法,將瘤胃內容物用生理鹽水按10-2、10-3、10-4、10-5、10-6、10-7梯度稀釋,取各梯度稀釋液均勻涂布MRS-CaCO3瓊脂培養基平板,37 ℃恒溫培養箱培養24~48 h,待平板上出現單菌落,挑取具有明顯溶鈣圈且形狀、大小、顏色各異的單菌落擴大培養,純化3~4次,編號標記,并于30%甘油中-80 ℃保存,作為初步篩選試驗的菌株。
1.2.2 菌株初篩
參照王利紅[11]試驗方法,取干凈玻片,用接種環取1環菌液于玻片上,涂勻,待干燥后,固定,進行革蘭氏染色。油鏡(10×100)鏡檢,觀察記錄菌株形態,經革蘭氏染色后呈紫色,為陽性菌,呈紅色為革蘭氏陰性菌。同時菌株進行過氧化氫酶試驗,觀察是否有氣泡產生,如有氣泡,則為過氧化氫酶陽性菌,沒有氣泡,則為過氧化氫酶陰性菌,若革蘭氏染色陽性,過氧化氫酶接觸陰性則可初步確定為乳酸菌。
1.2.3 菌株種屬鑒定
將初篩純化的菌種保存液充分活化后,離心收集菌體,根據細菌DNA提取試劑盒方法提取菌體DNA,以提取DNA為模板,PCR擴增16S rRNA基因片段,擴增產物經1%的瓊脂糖凝膠電泳檢測,擴增子送往生物公司進行測序,以鑒定乳酸菌的種屬。PCR引物采用16S通用引物序列[12]:16S-F:5′-AGAGTTTGATCCTGGTCAGAACGC-3′,16S-R:5′-TACGGCTACCTTGTTACGACTTCACCCC-3′。PCR擴增程序:94 ℃預變性2 min;94 ℃變性30 S;55 ℃退火1 min;72 ℃延伸1.5 min;30個循環;72 ℃終延伸10 min。
1.3 優良乳酸菌的篩選
1.3.1 乳酸菌發酵葡萄糖產酸產氣試驗
參照程麗娟等[13]試驗方法,PY基礎培養基內加入30 g/L葡萄糖和0.5 mL/L吐溫-80,以16 g/L的溴甲酚紫作指示劑,分裝至試管,在試管內倒置杜氏試管,121 ℃滅菌20~30 min,接種乳酸菌后置于37 ℃恒溫培養24 h。培養基的顏色由紫色變為黃色表示產酸,培養基中杜氏試管頂端出現氣泡,表明其產氣,為異型發酵乳酸菌,未出現氣泡,為同型發酵乳酸菌。
1.3.2 乳酸菌生長特性及產酸能力測定
參照崔棹茗等[14]試驗方法進行乳酸菌生長及產酸能力測定,對篩選出的同型發酵乳酸菌,經活化后按照1%接種量接種于5 mL MRS培養基中,37 ℃恒溫培養,分別在0、2、4、6、8、12、16、24、36、48 h,隨機抽取3管,以空白培養基為對照,測定600 nm波長下的吸光度(OD),同時測定菌液的pH,以菌液培養時間為橫坐標,OD和pH為縱坐標分別繪制生長曲線和產酸曲線。
1.3.3 耐酸和耐膽鹽性能測定
參照李利等[15]試驗方法進行耐酸和耐膽鹽性能測定。
耐酸性能:將供試菌株接種于MRS培養基中,厭氧條件下37 ℃培養24 h。用6 mol/L的鹽酸分別調節MRS液體培養基pH至4.0、3.0、2.5。將活化的乳酸菌分別接種未調pH培養基及調pH至4.0、3.0、2.5的MRS培養基中,并調整其初始OD在0.025±0.005,37 ℃培養24 h,以相應pH未接種的培養基為空白對照,于600 nm波長下測定各組菌液的OD。
耐膽鹽性能:與耐酸性能測定相似,將活化的乳酸菌分別轉接至含0、1、2和3 g/L的牛膽鹽MRS培養基,并調整其初始OD在0.025±0.005,37 ℃厭氧條件下培養24 h,以未接種的相應膽鹽濃度培養基為空白對照,于600 nm波長下測定各組菌液的OD。
1.3.4 菌株上清液抑菌性能測定
參照崔素素[12]抑菌性試驗方法,以沙門氏菌、金黃色葡萄球菌和大腸桿菌為指示菌,牛津杯法進行抑菌試驗。將候選菌株于MRS培養基培養活化2代,將活化好的菌液離心(8 000×g)2 min,上清液經濾膜過濾,收集后分為等量的2份,1份不調pH,1份將pH調至6.8,吸取150 μL加入牛津杯中,37 ℃培養24 h后檢測有機酸是否對指示菌產生抑制作用,抑菌能力根據抑菌圈大小判定,判定方法參考高擎燏[16]的試驗研究。
1.3.5 自凝集試驗
參照李龍等[17]試驗方法,將候選菌株活化24 h后離心(8 000×g)5 min,用無菌磷酸鹽緩沖液(PBS)清洗2次,PBS重懸,調整菌懸液的OD為0.25±0.05,記錄起始OD(A0),吸取4 mL已調整OD的菌懸液加入試管中,靜置于室溫下20 h后測定該菌懸液上清在600 nm波長下的OD(At),計算自凝集率(A,%)=[(A0-At)/A0]×100。
1.3.6 藥敏性試驗
參照封曄等[18]的藥敏性試驗方法,將候選菌株制成菌懸液,均勻涂布于MRS平板培養基上,將青霉素、四環素、鏈霉素、氧氟沙星、多黏菌素B、紅霉素、環丙沙星、妥布霉素8類抗菌藥物藥敏片均勻置于平板上,37 ℃培養24 h,觀察并記錄抑菌圈大小,根據抑菌圈大小判定藥敏性,判定標準參考美國NCCLS文件及文獻[19]進行制定(表1)。
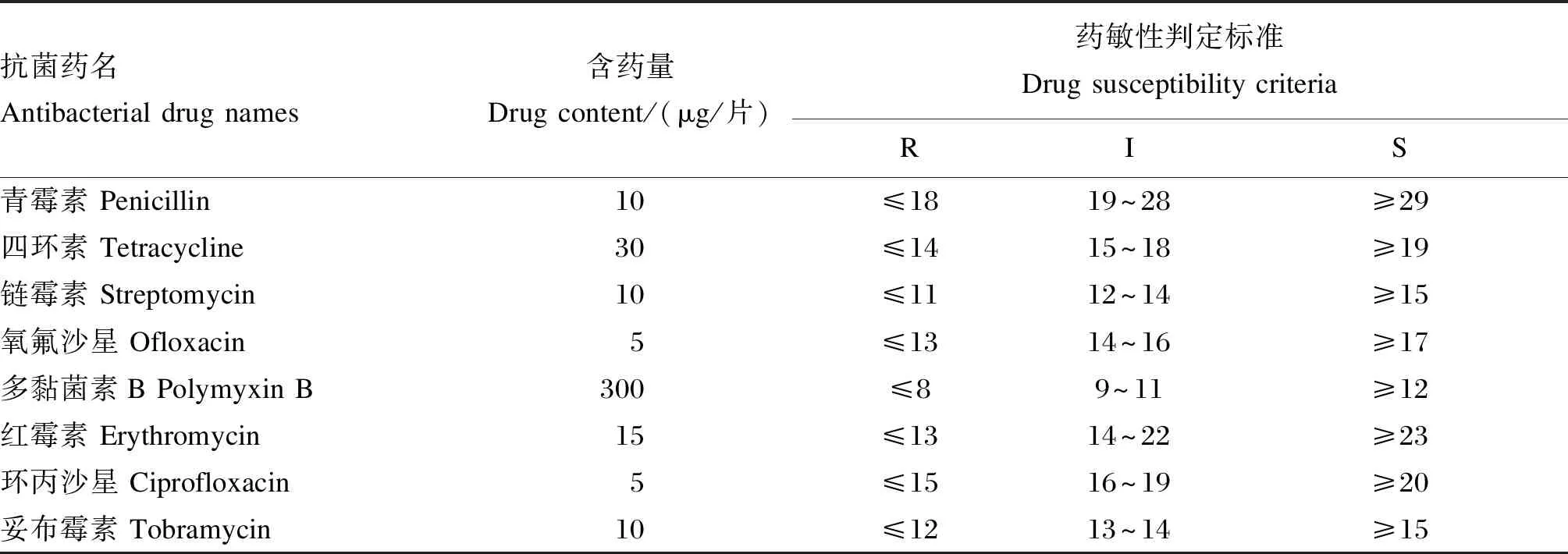
表1 不同抗生素藥敏性判定標準
1.4 統計分析
利用Excel 2010對試驗數據進行初步整理,采用SPSS 20和GraphPad Prism 8軟件對試驗數據進行統計分析和圖表繪制。
2 結果與分析
2.1 菌株分離純化
共分離純化得到疑似乳酸菌101株,所有菌株革蘭氏染色均呈陽性,過氧化氫酶觸反應均呈陰性,部分菌株在MRS平板培養的菌落特征和革蘭氏染色見圖1所示。

A1、A2、A3分別為不同菌株菌落形態;B1、B2、B3分別為對應菌株革蘭氏染色。
2.2 16S rRNA測序鑒定
分別提取101株經革蘭氏染色呈陽性,過氧化氫酶觸反應呈陰性菌株的DNA,經16S rRNA引物進行PCR擴增,擴增得到的片段大小均在1 500 bp處出現單一熒光條帶,沒有明顯拖尾現象,符合測序要求,部分菌株的PCR擴增電泳圖如圖2所示。隨后將PCR產物進行測序后,測序結果登陸NCBI網站進行BLAST序列比對,根據其相似度確定得到25株乳酸菌,如表2所示,分離得到的25株乳酸菌中8株戊糖片球菌和2株短乳桿菌均分離自黑藏羊瘤胃內容物,明串株菌分離自白絨山羊瘤胃內容物,在黑藏羊和白絨山羊瘤胃內容物中均分離出了戊糖乳桿菌、糞腸球菌、海氏腸球菌、蒙氏腸球菌。
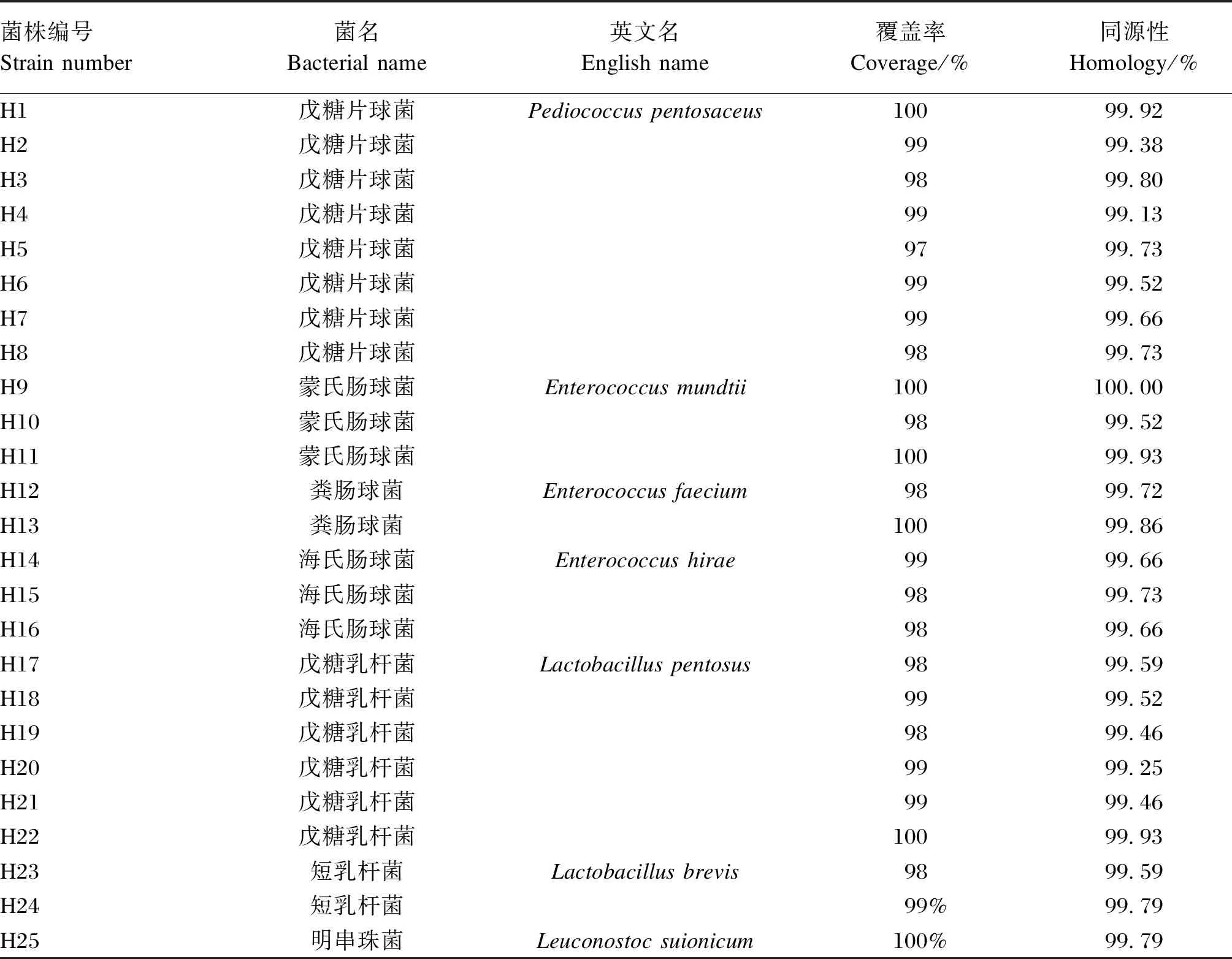
表2 25株乳酸菌16S rRNA序列相似性比對
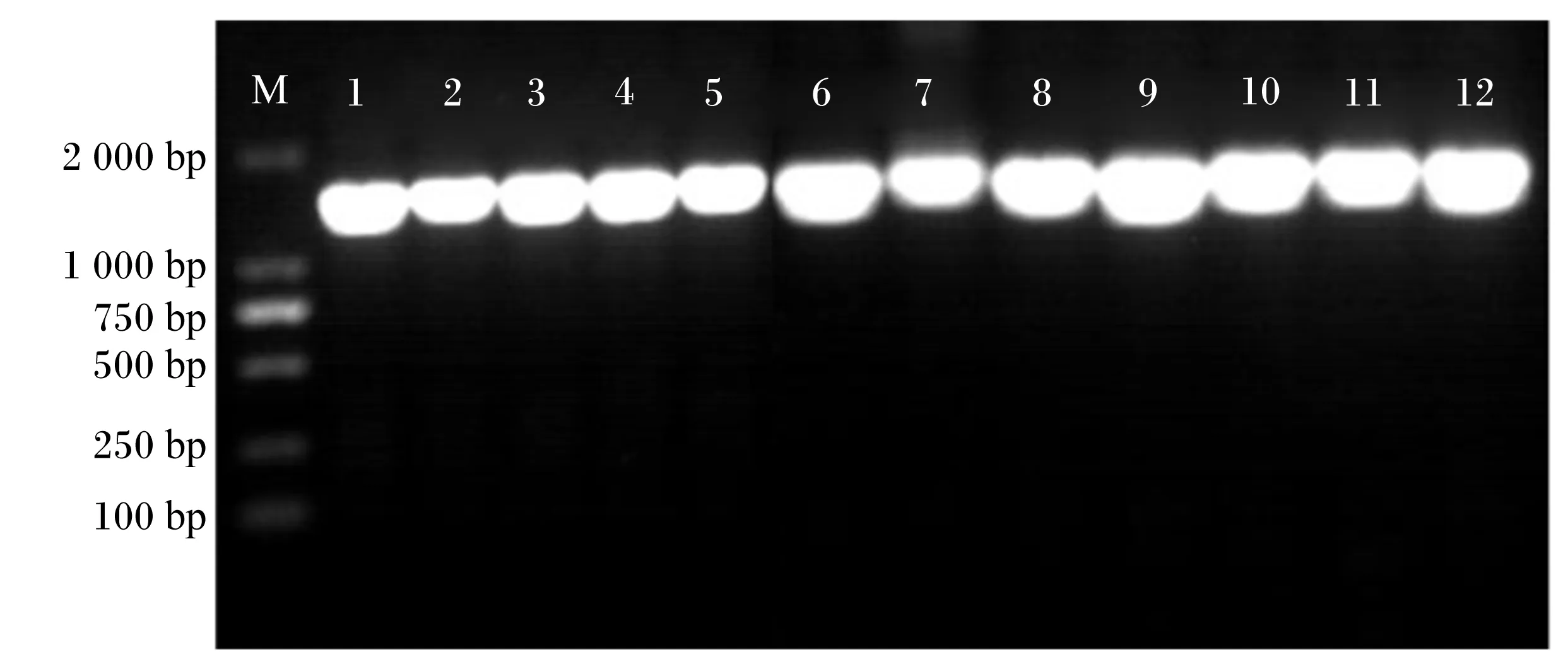
M:DL2000 DNA標記物;1~12號依次是菌株H1、H2、H7、H9、H12、H15、H17、H18、H20、H23、H24、H25的基因組DNA。
2.3 優良乳酸菌篩選
2.3.1 發酵葡萄糖產酸產氣
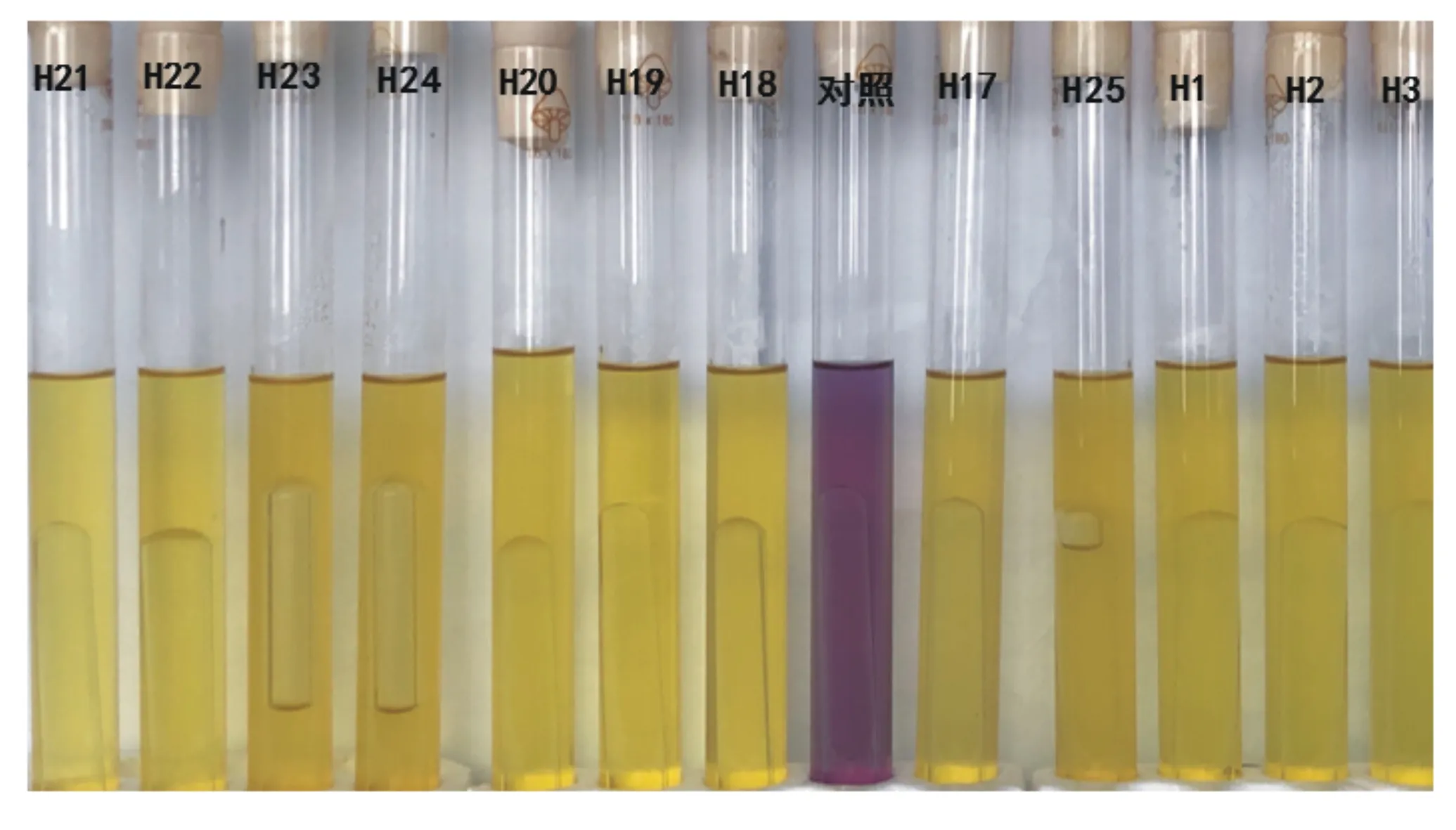
圖3 部分菌株產酸產氣結果
2.3.2 生長曲線
如圖4-A所示,8株戊糖片球菌中菌株H1、H2、H3、H5、H6、H7、H8均在接種4 h后進入對數生長期,菌株H4在接種6 h后進入對數生長期,均在16 h后進入穩定期,48 h時的OD600在2.2~2.3;由圖4-B可知,8株腸球菌均在接種2 h后進入對數生長期,12 h后進入穩定生長期所有菌株均在接種12 h后進入穩定生長期,8株腸球菌在48 h時OD600均在1.5左右,其中菌株H12、H13最高,菌株H9、H10、H11最低;由圖4-C可知,6株戊糖乳桿菌均在接種2 h后進入對數生長期,16 h后進入穩定生長期,48 h時的OD600均接近2.5,其中菌株H22在4和48 h時的OD600均低于其余5株菌。
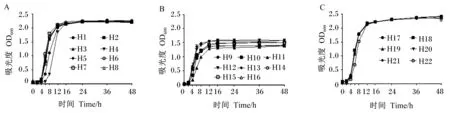
圖A、B、C分別代表8株戊糖片球菌、8株腸球菌、6株戊糖乳桿菌生長曲線。圖5同。
2.3.3 產酸曲線
由圖5可知,所有菌株在培養過程中pH的變化規律基本一致,都呈現先穩定后下降再穩定的階段,綜合圖3生長曲線的結果,乳酸菌處于適應期時,培養基pH變化基本保持穩定,當菌株生長進入對數期,培養基pH開始下降,菌株生長進入穩定期后,pH又開始趨于穩定。由圖5-A可知,8株戊糖片球菌在48 h時的pH均能達到4.0以下,菌株H2、H3、H5、H6、H7、H8在進入對數生長期后pH快速下降,其中菌株H7的pH下降最快,菌株H8的pH下降最慢,菌株H1、H4進入對數生長期后,菌株H1的pH迅速下降,但菌株H4的pH在8 h后開始快速下降;由圖5-B可知,8株腸球菌在48 h時的pH接近,均在4.2~4.5,其中菌株H12、H13的pH下降最快,且48 h時的pH也最低,菌株H9、H10、H11的pH下降最慢,在48 h時的pH高于其余5株菌;由圖5-C可知,6株戊糖乳桿菌均在進入對數生長期后pH快速下降,其中菌株H22的pH下降速率低于其他菌株,但在48 h時的pH接近且均低于4.0。
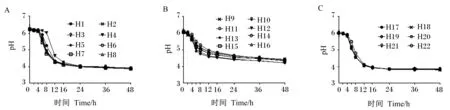
圖5 22株乳酸菌產酸曲線
綜合22株同型發酵乳酸菌的生長曲線和產酸速率的結果得出:戊糖片球菌中菌株H2、H3、H5、H6、H7生長性能和產酸性能較好;腸球菌中菌株H12、H13生長性能和產酸性能最好,H14、H15、H16次之,H9、H10、H11最差,戊糖乳桿菌中菌株H22較差。
2.3.4 耐酸和耐膽鹽性能
由表3可知,所有菌株均能在培養基中正常生長,整體生長速度戊糖乳桿菌優于戊糖片球菌,腸球菌的生長速度較慢。所有菌株在pH 4.0的條件下均能生長,其中戊糖片球菌的生長幾乎不受影響,說明此8株戊糖片球菌均能完全耐受pH 4.0條件;8株腸球菌生長受到抑制作用,其中菌株H9、H10、H11生長微弱,基本不耐受此酸度環境,菌株H12、H13、H14、H15、H16生長較好,說明能耐受此環境條件,其中菌株H13耐受性最好;6株戊糖乳桿菌能完全耐受pH 4.0的環境,生長良好。在pH 3.0條件下,8株戊糖片球菌長勢較好,但也受到一定程度的抑制,其中菌株H6耐受性最差;8株腸球菌的生長被完全抑制不能生長;6株戊糖乳桿菌耐酸性強,長勢較好。pH 2.5條件下,8株戊糖片球菌和6株戊糖乳桿菌生長微弱,基本不能耐受此酸性環境,但戊糖乳桿菌整體耐受能力優于戊糖片球菌。
由表3可知,所有菌株均能很好地耐受0.1%的膽鹽環境。在0.2%的膽鹽條件下,8株戊糖片球菌長勢良好,說明能耐受此膽鹽環境,其中菌株H7的耐受性能最好;8株腸球菌長勢較好,但均受到一定抑制作用;6株戊糖乳桿菌長勢較好,說明其能耐受此膽鹽環境,其中菌株H20最好,H22最差。在0.3%的膽鹽條件下,8株戊糖片球菌能在一定程度上耐受此膽鹽環境,其中菌株H1、H4耐受性能最差;8株腸球菌長勢微弱,其中菌株H12耐受能力最強,H14、H15、H16次之,其余最差;6株戊糖乳桿菌,菌株H17、H18、H19、H20長勢較好,說明這4株菌能耐受此膽鹽環境,菌株H21、H22長勢微弱,說明不能耐受此環境。
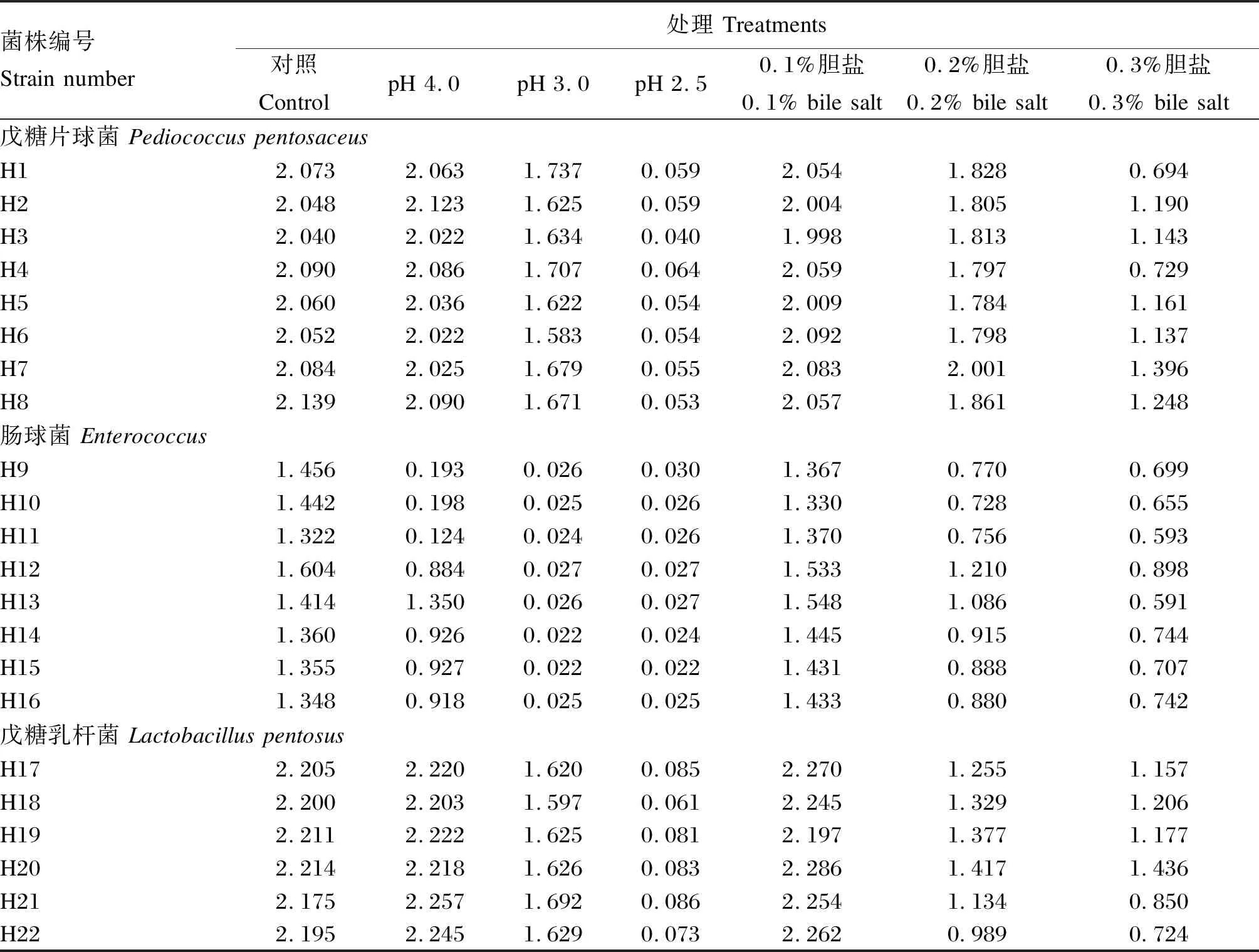
表3 22株乳酸菌在不同pH及膽鹽條件下24 h時OD600的變化
綜合這22株菌對酸和膽鹽的耐受性能結果得出:8株戊糖片球菌中菌株H2、H3、H5、H7、H8對酸和膽鹽耐受性較好;8株腸球菌中菌株中H12、H14、H15、H16對酸和膽鹽耐受性較好;6株戊糖乳桿菌中H17、H18、H19、H20對酸和膽鹽耐受性較好。
?Leana,C.,Appelbaum,E.& Shevchuk,I.,“Work process and quality of care in early childhood education:the role of job crafting”,Academy of Management Journal,2009,52(6),pp.1169~1192.
2.3.5 候選菌株抑菌能力
由表4可知,22株乳酸菌上清原液對指示菌金黃色葡萄球菌和大腸桿菌均產生了抑制作用,除了菌株H5、H6、H11,其余菌株上清液對指示菌沙門氏菌也均產生了抑制作用,但是存在菌株特異性。8株戊糖片球菌中,菌株H2、H3、H7、H8對沙門氏菌、金黃色葡萄球菌和大腸桿菌的抑制作用最強;8株腸球菌中H10、H15沙門氏菌、金黃色葡萄球菌和大腸桿菌的抑制作用最強;6株戊糖乳桿菌中H17、H18、H20對沙門氏菌、金黃色葡萄球菌、大腸桿菌的抑制作用最強。而pH調至6.8的乳酸菌上清液及MRS培養基,均未檢測出對指示菌的抑制作用。部分菌株抑菌效果如圖6所示。
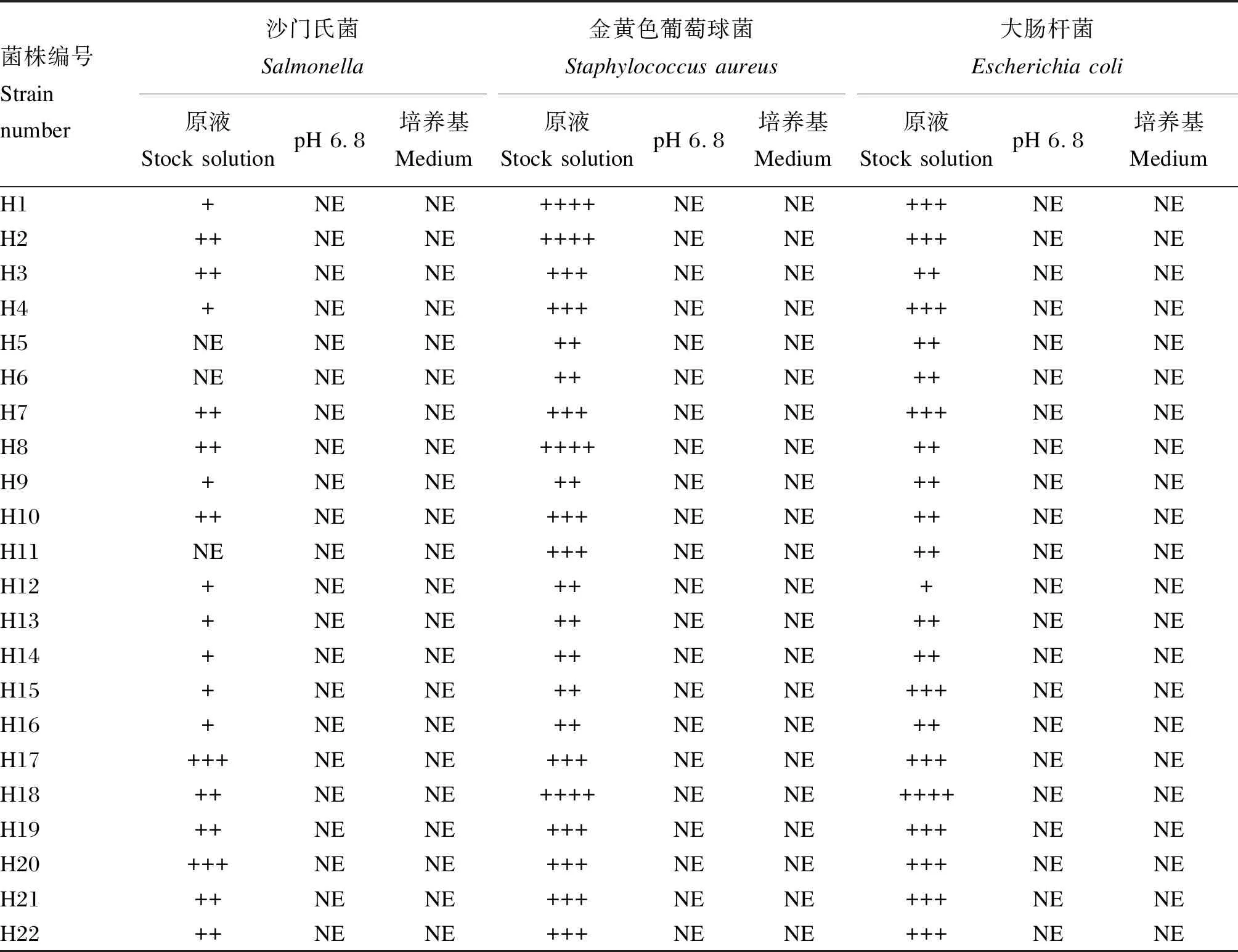
表4 22株乳酸菌對沙門氏菌、金黃色葡萄球菌和大腸桿菌的抑菌能力
2.3.6 自凝集率
22株乳酸菌在靜置20 h后凝集率如圖7所示,菌株特異性明顯,其中菌株H1自凝集率最高,菌株H12自凝集率最低。
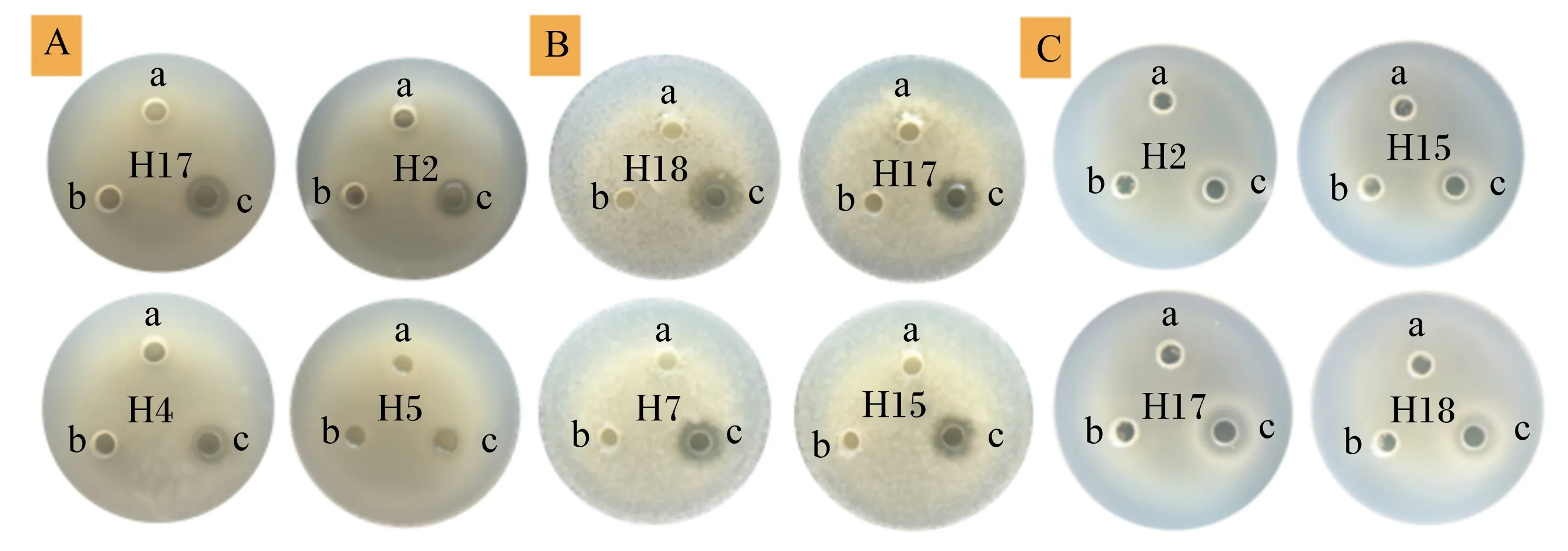
圖A的指示菌為沙門氏菌,菌株分別為H17、H2、H4、H5;圖B的指示菌為金黃色葡萄球菌,菌株分別為H18、H17、H7、H15;圖C的指示菌為大腸桿菌,菌株分別為H2、H15、H17、H18;a、b、c分別為MRS培養基,上清液調pH至6.8,上清液原液。
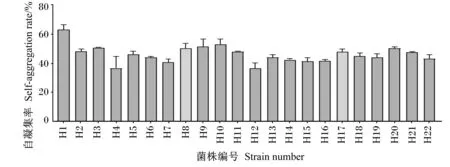
圖7 22株乳酸菌自凝集率
2.3.7 藥敏試驗
藥敏試驗結果(表5)發現,所有菌株對鏈霉素都具有耐藥性。8株戊糖片球菌對青霉素、四環素、紅霉素3種藥物敏感,除了菌株H4對多黏菌素B敏感,8株菌對其余5種藥物均具有耐藥性;8株腸球菌對鏈霉素、多黏菌素B、妥布霉素3種藥物均具有耐藥性,其中菌株H9、H11、H15、H16對4~5種藥物敏感,H12、H13只對四環素敏感;6株戊糖乳桿菌均對鏈霉素、多黏菌素B、環丙沙星具有耐藥性,菌株H18對4種藥物敏感,H20對2種藥物敏感,其余菌株均對3種藥物敏感,部分菌株的抗生素敏感性效果如圖8所示。
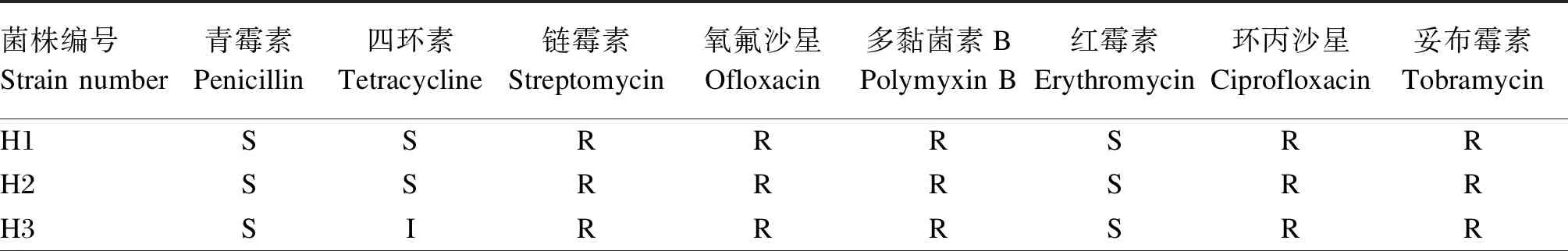
表5 22株乳酸菌對不同抗生素的敏感性判定
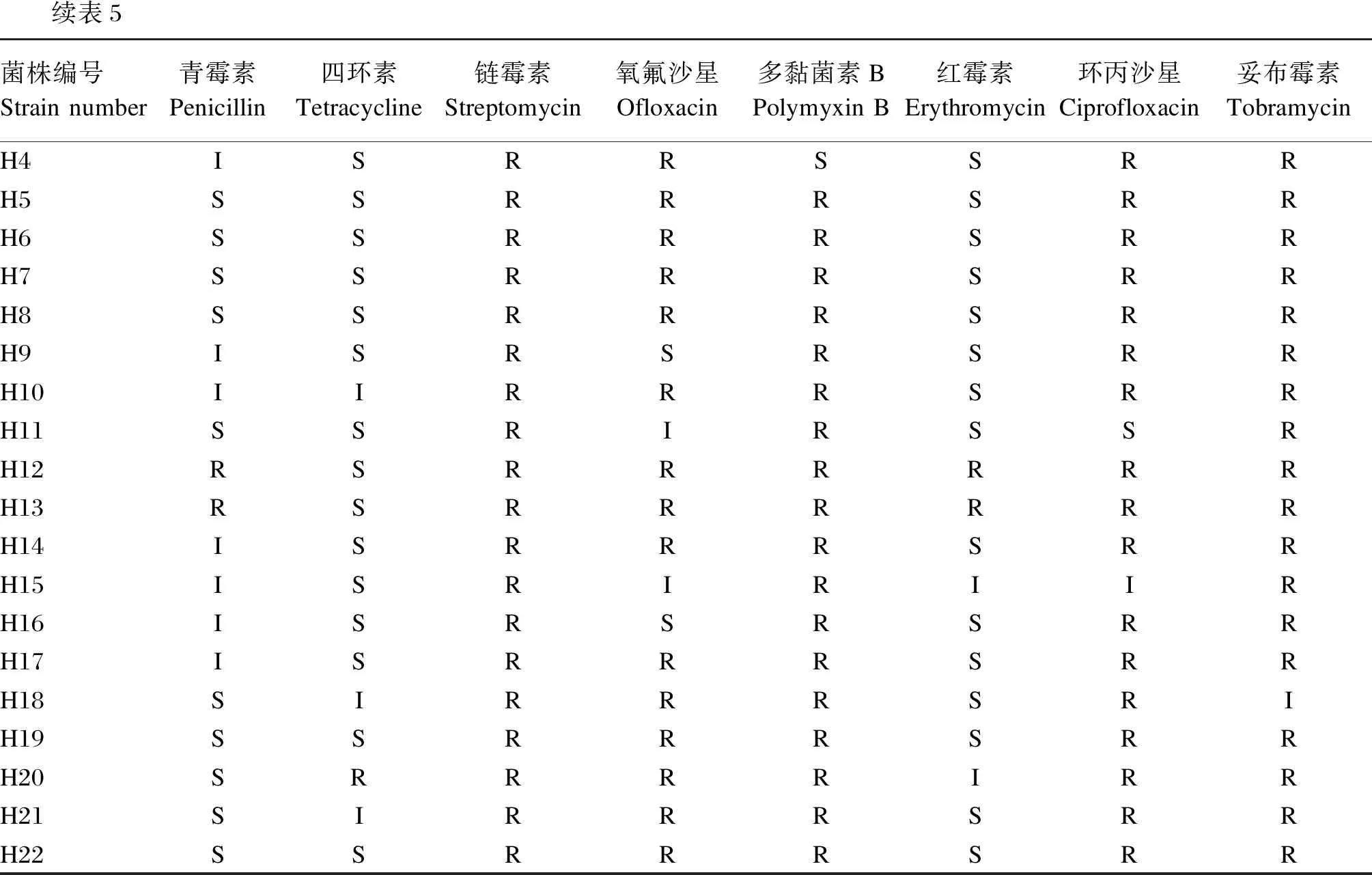
續表5菌株編號Strain number青霉素Penicillin四環素Tetracycline鏈霉素Streptomycin氧氟沙星Ofloxacin多黏菌素BPolymyxin B紅霉素Erythromycin環丙沙星Ciprofloxacin妥布霉素TobramycinH4ISRRSSRRH5SSRRRSRRH6SSRRRSRRH7SSRRRSRRH8SSRRRSRRH9ISRSRSRRH10IIRRRSRRH11SSRIRSSRH12RSRRRRRRH13RSRRRRRRH14ISRRRSRRH15ISRIRIIRH16ISRSRSRRH17ISRRRSRRH18SIRRRSRIH19SSRRRSRRH20SRRRRIRRH21SIRRRSRRH22SSRRRSRR

藥敏紙片a、b、c、d、e、f、g、h分別代表抗生素青霉素、四環素、鏈霉素、氧氟沙星、多黏菌素B、紅霉素、環丙沙星、妥布霉素。
3 討 論
乳酸菌是近年來應用最廣泛的一種安全性較高的新型綠色功能性飼料添加劑,具有提高飼料利用率、改善動物消化道功能、提高免疫力等益生功能[20-21]。針對不同動物而言,其消化道環境以及微生物組成均有所不同[22]。因此,篩選具有高效、穩定等益生特點的同源性益生菌的研究就顯得尤為重要。菌株是否能作為益生菌,需要根據現有益生菌選擇標準和評價規程對其進行安全性評估[23]。而作為直接投喂的菌制劑,首要問題是要考慮其進入動物胃腸道后的存活和定植,所以篩選菌株時應選擇來自同種動物宿主分離的益生菌,使其具有更強的適應能力[24]。在本試驗中對分離自不同品種羊瘤胃中的菌株先通過形態學特征和生理生化特性進行初步鑒定,然后進行了16S rRNA分子生物學鑒定,提高了鑒定的準確率。結果發現篩選獲得的25株乳酸菌,包括4個不同的屬,7個不同的種,其中同型發酵乳酸菌22株,異型發酵乳酸菌3株。戊糖片球菌和短乳桿菌均來自黑藏羊,而明串株菌來自白絨山羊,戊糖乳桿菌、糞腸球菌、蒙氏腸球菌、海氏腸球菌則存在于2種羊瘤胃中,說明不同品種、不同來源的羊瘤胃中乳酸菌分布不同、多樣性也存在差異,分析原因可能是動物胃腸道乳酸菌群的形成主要來源于自然環境中乳酸菌的定植,而不同地域環境、不同氣候條件又孕育了不同乳酸菌資源,同時不同品種的羊消化道環境也可能適應不同乳酸菌的生長,不同乳酸菌之間存在的協同或拮抗作用可能影響乳酸菌的分布,因此導致不同品種、不同來源的羊瘤胃中分離得到的乳酸菌種類不同,宿利亞[25]的研究也說明了不同地域、不同動物腸道或畜產品能分離出一些地域特色的益生菌。隨后對22株同型發酵乳酸菌進行了體外生物學特性評價。乳酸菌的生長速度及產酸能力是篩選益生菌的重要指標,無論是直接投喂還是應用于發酵飼料,生長速度快,能迅速繁殖成為優勢菌群,從而競爭性抑制其他病原微生物的生長;產酸能力強,能快速產生大量乳酸等有機酸,形成低pH環境,抑制有害菌的生長[26-27]。鑒于此,本研究根據養羊生產需要,對分離得到的22株同型發酵乳酸菌進行生長特性和產酸能力研究,結果表明,8株戊糖片球菌中菌株H2、H3、H5、H6、H7生長性能和產酸性能較好;8株腸球菌中菌株H12、H13生長性能和產酸性能最好,H14、H15、H16次之,H9、H10、H11較差,戊糖乳桿菌中菌株H22較差;另外生長速度及產酸能力存在菌株特異性,本試驗中戊糖片球菌和戊糖乳桿菌整體優于腸球菌,所有菌株均在接種2~6 h后進入對數生長期,16 h后進入穩定生長期。王蔚淼等[28]研究結果顯示,乳酸菌的對數生長期一般在接種后12~24 h,這與本研究結果不一致可能原因是菌株不同所致。靳勝男等[29]的研究顯示,乳酸菌在接種4 h后進入對數生長期,14 h后進入穩定期,與本研究結果基本一致。在本研究中分離到的乳酸菌其生長速度不同,部分菌株生長較快,具有作為優良發酵接種菌的潛力。此外在產酸速度方面,不同種屬乳酸菌產酸能力不同,但基本都在發酵4 h后產生大量有機酸,pH快速下降,發酵24 h后pH趨于穩定,戊糖片球菌和戊糖乳桿菌終末pH能達到3.8左右,而腸球菌均在4.0以上。
作為優良益生菌制劑,除了應具有較好的生長和產酸性能外,也應當能適應胃腸道中的苛刻環境。因此對22株乳酸菌進行了耐酸、耐膽鹽試驗,試驗結果表明8株戊糖片球菌在pH 2.5條件下微弱生長,對pH 3.0及膽鹽濃度0.3%的環境均具有較好的耐受性,其中菌株H2、H3、H5、H7、H8表現較好;8株腸球菌均完全不能耐受pH 3.0以下環境,其中菌株H12、H13、H14、H15、H16對pH 4.0耐受性能較好,所有菌株均能在一定程度上耐受0.3%的膽鹽濃度;6株戊糖乳桿菌在pH 2.5條件下微弱生長,均能耐受pH 3.0的酸性條件及0.3%的膽鹽濃度其中H17、H18、H19、H20對酸和膽鹽耐受性較好,結果表明乳酸菌不同種屬及同一種屬不同菌株耐酸和耐膽鹽性能可能不同。Missotten等[30]對10株乳酸菌耐酸性能研究也顯示不同菌株耐酸性能存在差異,這和本研究結果基本一致。在沙門氏菌、金黃色葡萄球菌和大腸桿菌的抑菌能力方面,所有菌株上清液對指示菌金黃色葡萄球菌和大腸桿菌均有不同程度的抑制作用,其中菌株H1、H2、H18抑制作用最強,除了菌株H5、H6、H11其余菌株上清液對沙門氏菌也均有不同程度抑制作用,其中菌株H17、H20抑菌作用最強。在排除酸效應后,所有菌株上清液均未檢測到抑制作用,李雪莉等[31]研究也表明乳酸菌主要通過有機酸來發揮抑制作用,這與本研究結果一致。本試驗結果也說明乳酸菌主要通過代謝產生的有機酸來發揮抑菌作用的,但也有研究表明乳酸菌可通過細菌素、過氧化氫等發揮抑菌效果[32],在本研究中可能原因是除有機酸外沒有其他抑菌物質的產生或者產生的濃度過低所致。
菌株的自凝集是指相同菌株間相互凝集形成多細胞簇的過程,乳酸菌可通過自凝集形成阻礙致病菌在腸道定植和感染的屏障[33]。菌株自凝集應該作為篩選菌株的重要指標,能間接反應菌株的黏附特性,自凝集率高的菌株有高的疏水性和黏附率[34]。在本試驗中大多數菌株的自凝集率都在40%~50%,但是存在菌株特異性,最高可達63.2%,最低為36.7%,本試驗結果表明,大多數菌株具有較強的自凝集能力,這與前人試驗研究結果[17,35]一致。
乳酸菌的使用歷史悠久,通常被認為是一種安全的菌種,但是不合理菌株的使用可能對宿主健康產生危害。而作為益生菌的一個重要安全要求就是不可攜帶可轉移抗性基因[36]。抗性基因可通過橫向轉移,從而使菌株對使用的抗生素產生耐藥性。因此益生菌的候選菌株必須鑒定其抗生素敏感性。本試驗評價了22株乳酸菌對8種常用抗生素的耐藥性。本試驗研究結果表明,戊糖片球菌和戊糖乳桿菌中除了菌株H4對多黏菌素B敏感,菌株H18對妥布霉素中度敏感,都表現出對鏈霉素、氧氟沙星、多黏菌素B、環丙沙星、妥布霉素的耐藥性,腸球菌中菌株H11、H15對鏈霉素、多黏菌素B、妥布霉素出現耐藥性,對其余抗生素敏感,本試驗結果與前人的試驗結果[19,37]基本一致,但因菌株來源及抗生素不同也存在不同之處。分析產生這種結果的原因可能是不同菌株攜帶的天然耐藥基因不同,也可能是由于在畜禽養殖過程中長期低水平抗生素使用刺激相關抗性基因轉移,形成獲得性耐藥,更有可能與菌株來源密切相關。由于目前對于益生菌藥敏性評價還缺乏相應的標準,后期也需要更多的深入研究。
4 結 論
本試驗研究成功篩選出H2、H7、H15、H17、H18 5株優良同型發酵乳酸菌,其中戊糖片球菌2株、海氏腸球菌1株、戊糖乳桿菌2株,均具有良好的生長及產酸能力和抗逆性,后期將對其安全性進行進一步研究,為其作為抗生素替代品在畜禽養殖中應用提供理論依據。

