景寧木蘭PIF轉錄因子的生物信息學分析及極端遮陰條件下的表達模式
陸丹迎,程少禹,章穎佳,劉志高,金夢婷,董 彬,張壽洲,彭 豪,戴夢怡,王卓為,趙宏波,申亞梅
(1.浙江農林大學 風景園林與建筑學院,浙江 杭州 311300;2.深圳市/中國科學院 仙湖植物園,廣東 深圳 518004)
景寧木蘭Magnoliasinostellata是木蘭科Magnoliaceae木蘭屬Magnolia植物,屬于典型的極小種群瀕危樹種。景寧木蘭幼苗生長需要一定的蔭庇環境[1],但過度遮陰會抑制景寧木蘭幼苗的光合速率[2]。自然狀態下,群落所形成的遮陰是影響群落內瀕危植物生長發育的重要因素[3]。景寧木蘭多生長于光照充足的針葉群落,在針闊混交群落和闊葉群落分布較少[4]。據此推斷,群落所形成的遮陰會削弱景寧木蘭的生長勢,是導致景寧木蘭瀕危的重要因素。光是影響植物生長發育的重要環境因子。植物的整個生命周期都受到不斷變化的光環境影響。光敏色素是植物重要的光感受器,能夠感受環境中光信號的變化。光敏色素作用因子(phytochrome interacting factors, PIFs)能夠感知紅光和遠紅光信號,在光信號傳導和植物生長發育中起到重要作用。光信號在通過信號轉導后,能夠誘導一系列生理生化反應。光敏色素作用因子是光信號轉導中的重要調控因子,屬于bHLH超家族的第15亞族,其家族成員都具有高度保守的bHLH結構域。bHLH結構域由約15個氨基酸的堿性結構域(basic region)和60個氨基酸的HLH(helix-loop-helix)結構域組成[5]。目前對PIF家族轉錄因子的研究主要集中在模式植物擬南芥Arabidopsisthaliana中。PIF轉錄因子廣泛參與了擬南芥的光調控反應,并在光敏色素介導的光信號網絡調控中處于主導地位[6]。黑暗條件下,AtPIF1能夠抑制擬南芥種子的萌發,AtPIF3、AtPIF4、AtPIF5能夠促進葉綠素分解并抑制葉綠體活性,從而最終導致葉片衰老[7]。遮陰條件下,AtPIF1能夠通過調控AtHB1的表達來促進下胚軸的伸長[8];AtPIF4、AtPIF5和AtPIF7通過促進AtFT和AtTSF的表達從而促進擬南芥開花[9];AtPIF4、AtBZR1和AtARF6通過整合生長素信號與BR和光敏色素通路來協同促進擬南芥下胚軸的伸長[10]。由此可見,PIF家族轉錄因子是遮陰條件下光信號轉導途徑中的關鍵調控因子。據此推測,PIF家族轉錄因子在光照強度對木蘭屬瀕危樹種生長發育的影響及光受體信號轉導途徑中起到重要作用。因此,本研究對景寧木蘭PIF家族轉錄因子進行分析鑒定,探究其在極端遮陰條件下的表達模式,從而為揭示光介導的景寧木蘭生長發育的分子機制、群落引起的遮陰而導致景寧木蘭瀕危的內在機制奠定基礎,最終為珍稀植物景寧木蘭的保育提供理論依據。
1 材料與方法
1.1 植物材料
景寧木蘭來自浙江省杭州市青山湖花園中心苗圃培育的3年生扦插苗。2019年6月下旬,選擇長勢一致且無病蟲害的扦插苗作為材料,置于溫度為(25±2) ℃、光照強度為2 000~2 500 lx、相對濕度為40%~60%的人工氣候室中進行培養,光照與黑暗時間各12 h,定期澆水保持土壤濕潤。
1.2 實驗設計
3層遮陽網形成的光照強度是景寧木蘭自然生境光照條件之一,會顯著削弱景寧木蘭的生長勢[1]。2019年7月上旬開始遮陰處理,本研究于浙江省杭州市臨安區浙江農林大學人工氣候室內,用3層黑色遮陽網及竹竿搭建極端遮陰處理(25%光照,ST)裝置,以模擬遮陰條件下的景寧木蘭野外生存環境。以100%全光照為對照(ck)。所有盆栽苗葉片之間無重疊。每個處理4個生物學重復。分別自實驗開始處理第0、1、3、5、10、20、30天時,拍照記錄植株表型變化、采集景寧木蘭植株的中層葉片裝入錫紙袋中,并迅速置于液氮中速凍,隨后轉入?80 ℃冰箱中儲存,用于植物RNA的提取及后續實時熒光定量聚合酶鏈式反應(qRT-PCR)實驗。
1.3 方法
1.3.1 景寧木蘭PIF家族轉錄因子的篩選 基于實驗室已有的轉錄組測序數據,在NR、NT、Swiss-Prot這3個數據庫中進行注釋,初步注釋到46個PIF轉錄因子相關基因,將這些基因編碼蛋白質逐個進行NCBI Blast和NCBI CDD預測,去除重復序列及冗余轉錄本后,最終得到9個PIF家族轉錄因子的蛋白質序列。利用MEGA 5.0對景寧木蘭PIF轉錄因子序列與擬南芥PIF轉錄因子序列進行比對分析,根據TOLEDO等[5]命名擬南芥PIF家族的方法對9個景寧木蘭PIF轉錄因子進行命名。擬南芥PIF轉錄因子序列從擬南芥轉錄因子數據庫(https://www.arabidopsis.org/)中獲得。
1.3.2 景寧木蘭 PIF 家族轉錄因子的理化性質分析 采用 Compute pI/Mw 在線工具預測景寧木蘭 PIF 轉錄因子蛋白質的等電點及分子量,采用在線網站Cell-PLoc 2.0預測亞細胞定位,利用NetPhos分析蛋白質磷酸化位點;利用MEME分析蛋白質保守結構域;利用DNAMAN比對分析保守結構域;利用在線軟件heatmapper(http://www2.heatmapper.ca/expression/)繪制熱圖;為研究PIF轉錄因子家族的進化關系,利用MEGA5.0將9個景寧木蘭MsPIF蛋白質序列、15個擬南芥AtPIF蛋白質序列[11]、6個玉米ZeamaysZmPIF蛋白質序列(http://www.plantgdb.org/ZmGDB/)[12]、10個楊樹PopulustrichocarPtPIF蛋白質序列(http://www.Phytozome.net/poplar.php)[13]進行序列比對,并用鄰接法構建系統進化樹,進行Bootstrap 測試,重復設置為 1 000 次。
1.3.3 極端遮陰條件下景寧木蘭PIF家族轉錄因子的表達模式 采用植物RNA提取試劑盒提取樣品總RNA。取 1 μg RNA 進行第 1 鏈 cDNA 的合成。所用定量 PCR 試劑為 BCG qPCR Master Mix。根據景寧木蘭轉錄組數據設計特異性引物(表1)。以景寧木蘭的EF1-α基因作為內參基因[1],利用Light Cycler 480II(Roche)儀器進行目的基因qRT-PCR表達分析。反應程序結束后,65~95 ℃每隔0.2 s作溶解曲線,采用 2???Ct法計算目的基因的相對表達量。每個樣品重復3次。

表 1 實時熒光定量 PCR 引物Table 1 Primers used for qRT-PCR analysis
1.3.4 數據分析 采用 SPSS 19.0 進行方差分析并用 SigmaPlot 14 繪圖,對平均值采用獨立樣本T檢驗進行比較,顯著水平為0.05。
2 結果與分析
2.1 序列鑒定及理化性狀分析
利用ExPASy對9個基因編碼的氨基酸進行理化性質進行分析(表2),發現9個基因編碼的蛋白質大小不等,最小的為MsPIF1,編碼188個氨基酸,最大的為MsPIF3,編碼735個氨基酸。9個蛋白質的理論等電點為5.18(MsbHLH68)~8.22(MsPIF8),表明不同的PIF家族蛋白質在不同的微環境中發揮不同的生物學功能。9個PIF家族蛋白質均屬于不穩定、親水性蛋白質。
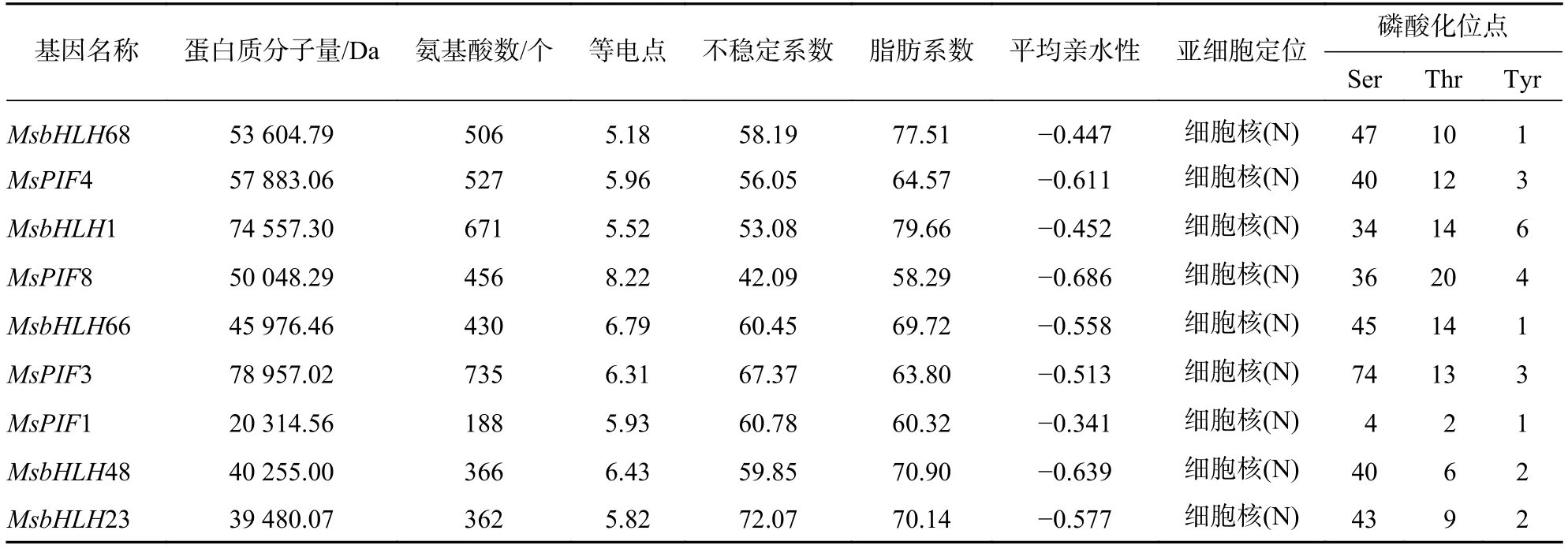
表 2 MsPIF 基因家族Table 2 MsPIF gene family of M.sinostellata
2.2 蛋白質亞細胞定位預測
通過在線軟件Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)對9個PIF基因家族成員的氨基酸序列進行亞細胞定位預測(表2),9個基因編碼的蛋白質均定位于細胞核內,符合其轉錄因子的功能,可能通過調控細胞核基因的轉錄來發揮功能。
2.3 蛋白質磷酸化位點分析
蛋白質磷酸化在很多植物信號轉導過程中起著重要作用[14]。蛋白質磷酸化的可逆性使得植物細胞能夠快速響應外部環境變化[15]。在正常光條件下,PIF家族轉錄因子與光敏色素相互作用,從而導致PIF蛋白質的磷酸化和降解[16]。而在低光照條件下,PIF蛋白質的磷酸化和降解受到抑制[17]。因此,分析PIF蛋白質的磷酸化位點對研究其在信號轉導中的功能有重要意義。利用NetPhos對9個PIF家族蛋白質的磷酸化位點進行分析(表2),發現9個蛋白質均具有絲氨酸(Ser)、蘇氨酸(Thr)和酪氨酸(Tyr)磷酸化位點,且Ser的磷酸化位點最多,Tyr的磷酸化位點最少。其中磷酸化位點最多的是MsPIF3,為94個,MsPIF1的磷酸化位點最少,僅7個。
2.4 蛋白質的基序分析
進一步利用MEME在線軟件分析MsPIF蛋白質[16],共鑒定到6個基序(表3)。結果顯示(圖1):9個蛋白質含有不同數目的基序,MsPIF4和MsPIF8含有的基序最多,為5個,而MsbHLH48中含有的基序最少,僅2個。bHLH家族蛋白質均含有bHLH基序,該基序由位于N端的basic基序(圖2A)和位于C端的HLH基序(圖2B)組成[5]。9個PIF家族蛋白質均含有basic基序及HLH基序。不同蛋白質的同源異型基序之間存在一定差異。MsPIF4、MsPIF3和 MsPIF8 中含有 APB 基序 (active phyB-binding motif)(圖 2C),表明其可以與 PhyB(phytochrome B)相結合,從而對下游基因的表達進行調控[16]。此外,MsPIF4和MsPIF3中還含有APA基序(active phyA-binding motif)(圖2D),表明其既可以與PhyA(phytochrome A)相結合也可以與PhyB相結合。
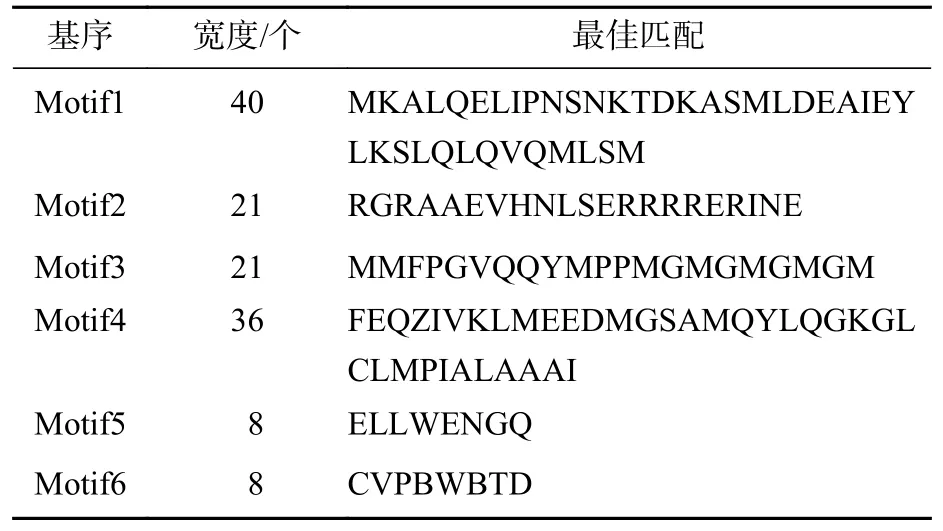
表 3 景寧木蘭 PIF 家族蛋白質的主要 MEME基序 Table 3 Major MEME motif sequences in M.sinostellata PIF protein
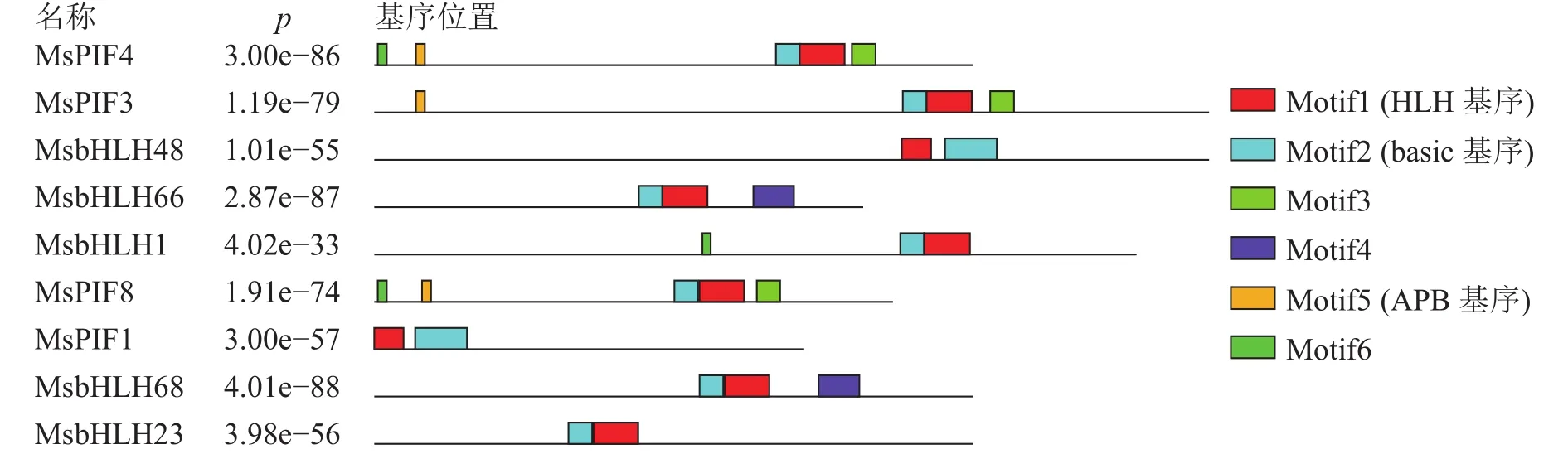
圖 1 MsPIF 蛋白質的基序Figure 1 Motif of MsPIF protein

圖 2 MsPIF家族蛋白質的basic、HLH、APB和APA基序蛋白質序列比對Figure 2 Sequence alignment of basic, HLH, APB and APA motif protein sequences of MsPIF
2.5 系統進化分析
運用MEGA5對所得景寧木蘭的蛋白質序列與擬南芥、玉米、楊樹中的序列對比分析(圖3),采用鄰接法及Bootstrap分析(1 000次重復)構建系統進化樹[18]。結果表明:植物PIF家族蛋白質表現出多樣性,可以分為7個進化分枝。其中,9個MsPIF蛋白質分布在α、β、γ、δ、η、ε等6個進化枝。15個AtPIF蛋白質分布在α、β、γ、δ、ζ、ε等6個進化枝,其中ζ為擬南芥所特有。ZmPIF蛋白質僅分布于β和δ進化枝,10個PtPIF蛋白質分布在α、β、γ、δ、ε等5個進化枝。從進化樹可以看出,MsPIF8、MsPIF4、MsPIF1、MsPIF3及MsbHLH23均與相應的擬南芥蛋白質與楊樹蛋白質聚類在一起,表明其親緣關系較為接近。MsbHLH68、MsbHLH66、MsbHLH48匯聚于η枝,為景寧木蘭所特有。
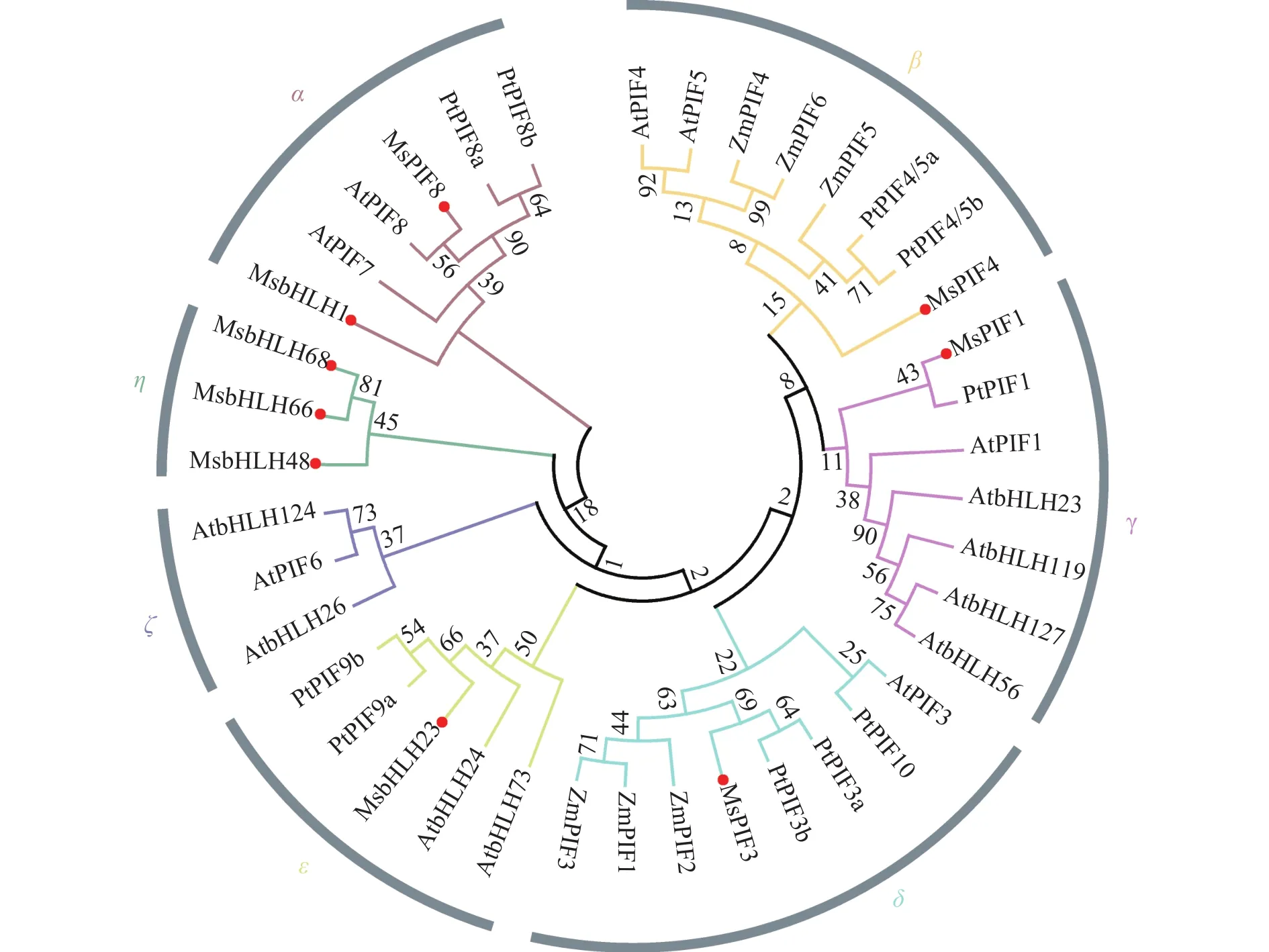
圖 3 景寧木蘭、擬南芥、玉米和楊樹的PIF家族蛋白質的系統進化分析Figure 3 Phylogenetic tree analysis of MsPIF protein and AtPIF protein sequences in M.sinostellata, A.thaliana, Z.mays, P.trichocarpa
2.6 長期極端遮陰條件下MsPIF家族基因的表達
光照是植物生長發育過程中不可或缺的因素,極端遮陰處理過程中,景寧木蘭葉片表型變化十分明顯(圖4)。處理10 d,景寧木蘭葉片出現褐色斑點;處理20 d,褐色斑點面積增大,植株開始萎蔫;處理30 d,大量葉片干枯脫落,植株萎蔫嚴重。

圖 4 遮陰處理過程中景寧木蘭的表型變化Figure 4 Phenotypic changes of M.sinostellata during shading treatment
PCR擴增瓊脂糖凝膠電泳檢測發現9個基因均擴出預期條帶(圖5)。qRT-PCR檢測結果(圖6)表明:遮陰處理1 d時,MsbHLH23和MsbHLH66的表達水平顯著上調,MsbHLH1、MsbHLH48、MsPIF8、MsPIF3的表達水平均顯著下調,其余基因表達水平無顯著變化。遮陰處理3 d時,MsPIF8的表達顯著低于對照,其余基因的表達均顯著上調。遮陰處理5 d時,MsPIF8的表達仍顯著降低,MsbHLH68、MsbHLH23、MsbHLH66、MsbHLH1、MsbHLH48 的表達顯著上調,其余基因的表達無顯著差異。遮陰處理 10 d 時,MsPIF8、MsPIF7、MsPIF3 的表達均顯著下調,MsbHLH68、MsbHLH23、MsbHLH66、MsPIF4的表達顯著上調。遮陰處理20 d時,MsPIF8、MsbHLH23、MsPIF1的表達相對于對照顯著下調,MsbHLH68和MsbHLH66的表達顯著上調,其余基因無顯著差異。遮陰處理30 d時,MsPIF8、MsbHLH23的表達相對于對照顯著下調,MsbHLH68、MsbHLH1、MsbHLH66、MsbHLH48、MsPIF3的表達顯著上調。其中,MsbHLH23的表達變化比其他基因更為明顯,遮陰處理5和10 d時的表達量分別上調為對照的52.77與20.03倍。
圖 5 qRT-PCR 擴增產物特異性Figure 5 Specificity of qRT-PCR amplification products
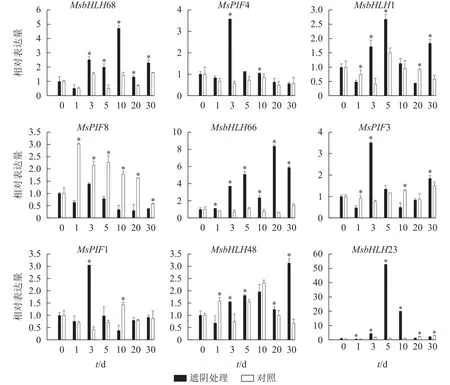
圖 6 遮陰條件下景寧木蘭 PIF 轉錄因子的 qRT-PCR 分析Figure 6 qRT-PCR analysis of PIF transcription factor under shading treatment of M.sinostellata
基因的表達模式與基因功能關系密切,基于獲得的景寧木蘭處理組的qRT-PCR數據,采用heatmap在線軟件對這些基因的差異表達進行分層聚類分析(圖7)。結果發現:MsPIF1、MsPIF3、MsPIF4、MsPIF8的表達模式十分相似,其表達均在處理3 d時明顯升高,隨后逐漸下降。MsbHLH48的表達在處理0~30 d逐漸上調,其中處理30 d時的表達上調最為明顯。MsbHLH1、MsbHLH68、MsbHLH66、MsbHLH23的表達模式均為先逐漸上調后逐漸下調,其中MsbHLH1和MsbHLH23的表達在處理5 d顯著上調,MsbHLH68和MsbHLH66的表達分別在處理10和20 d明顯上調。
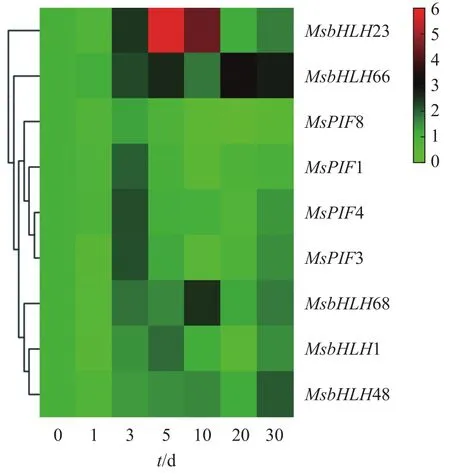
圖 7 長期極端遮陰條件下景寧木蘭 PIF 轉錄因子的表達模式Figure 7 Pattern of expression of PIF family during shading treatment period of M.sinostellata
3 討論
3.1 景寧木蘭中 PIF 家族轉錄因子
PIF家族轉錄因子廣泛存在于植物中。目前PIF家族轉錄因子在擬南芥中研究的最為透徹,共有15個[5]。在其他物種中,楊樹至少存在10個[13],玉米有6個[12],水稻Oryzasativa有6個[19]。本研究從景寧木蘭中僅篩選到9個,這一方面是由于景寧木蘭本身具有特異性,另一方面可能是因為轉錄組數據庫還不夠豐富造成的。NCBI blast及NCBI CDD預測結果表明:9個PIF蛋白質均含bHLH結構域,屬于PIF轉錄因子家族。同源性較高的蛋白質通常功能也相似[18]。因此,本研究用所得9個景寧木蘭PIF家族轉錄因子編碼蛋白質與6個ZmPIFs、10個PtPIFs 和15個功能明確的AtPIFs編碼蛋白質作系統進化樹,主要根據與15個擬南芥PIF家族轉錄因子編碼蛋白質進化關系的遠近推測景寧木蘭PIF轉錄因子的功能。AtPIF3與PtPIF3a、PtPIF3b同源性較高,且與AtPIF3和ZmPIF3位于同一進化枝,據此推測MsPIF3與AtPIF3功能相似。MsPIF4與PtPIF4、ZmPIF4、AtPIF4位于同一進化枝。AtPIF3蛋白質在植株剛剛暴露到光下時會急劇減少,在黑暗條件下會重新積累,在擬南芥幼苗階段,AtPIF3在光誘導的葉綠體發育中起到積極的作用[20]。AtPIF3、AtPIF4和AtPIF5在年齡引起的和黑暗引起的植物衰老中起到重要作用,其中AtPIF4通過調控葉綠素降解和維持葉綠體活性的相關基因從而促進植株衰老[7]。AtPIF4能夠調控下游基因從而促進擬南芥開花[21]。
此外,AtPIF4能與AtBZR1共同調節下游光響應的相關基因。AtPIF7與MsbHLH1同源性較高,推測其功能可能類似。遮陰條件下,AtPIF7是調控擬南芥莖伸長的重要因子[17]。AtPIF7是調節植物去黃化的弱負反饋因子,與PhyB結合的過程中通常不伴隨著可以監測到的磷酸化和分解[22]。MsPIF8與AtPIF8同源,推測其功能相似。與AtPIF3不同,AtPIF8蛋白質在遠紅光下的積累比在黑暗條件中或紅光條件下更多,AtPIF8能夠抑制由PhyA介導的種子萌發、下胚軸伸長等生命活動[23]。MsbHLH23與AtbHLH24功能相似,AtbHLH24在抑制種子萌發和維持種子休眠狀態中具有重要作用[24]。AtbHLH24能夠激活細胞分裂素信號,同時激活生長素生物合成和雄蕊內部結構域的轉運基因,并且在花瓣和果實發育中起到重要作用[25]。MsbHLH68,MsbHLH66和MsbHLH48共同匯集于同一進化枝,其功能還需要進一步挖掘。但是,即使是同一分支內蛋白質功能也可能存在差異,并且不同物種之間具有較大的差異[18]。因而關于MsPIF家族蛋白質的具體功能還需要通過后續研究。
3.2 景寧木蘭內在瀕危機制
群落層片造成的遮陰會降低下層植被的生長率與成活率[26]。本研究極端遮陰處理組的景寧木蘭在處理過程中逐步萎蔫死亡。光敏色素作用因子(PIFs)在植物的生長發育中起到重要調節作用。PIFs作為光信號轉導途徑中的負調控因子,對植物生長發育的多個過程都有調控作用[27?32]。PIF家族轉錄因子是光敏色素介導的光信號轉導途徑中的負反饋因子[28]。遮陰條件下,PIF蛋白質大量積累,從而調控植物發生一系列生理生化反應。考慮到植物的個體差異和基因表達差異,本研究的每個取樣時間點都作了相應的空白對照。本研究中,長期極端遮陰條件下,景寧木蘭的PIF類家族轉錄因子的表達水平多數顯著上調,只有MsPIF8的表達水平顯著下調。在擬南芥中,與其他PIF家族成員相比,AtPIF8能夠與PhyB結合但效果微弱[23]。MsPIF8的表達模式與前人的研究結論存在差異,可能與物種特異性相關,有關MsPIF8的功能還需要進一步研究。MsPIF1、MsPIF3和MsPIF4的表達模式與前人的研究結論[29]吻合。黑暗條件下,AtPIF1的表達上調,從而抑制葉綠素的合成與種子萌發;AtPIF3、AtPIF4的表達顯著上調,從而促進葉綠素的降解與葉片衰老[29]。植物群落造成的遮陰使得AtPIF4的表達上調,從而使成花誘導相關基因的表達上調,最終誘導擬南芥提早開花[21]。PIF功能十分復雜,景寧木蘭PIF家族轉錄因子在遮陰調控網絡中發揮的作用還需要進一步研究。

