血紅素氧合酶1對(duì)高糖誘導(dǎo)人晶狀體上皮細(xì)胞的氧化應(yīng)激和凋亡的影響
張 奇,馬天駒,黃 楊,李朝輝
解放軍總醫(yī)院第一醫(yī)學(xué)中心 眼科,北京 100853
白內(nèi)障形成的因素有很多,其中糖尿病是最重要的危險(xiǎn)因素。隨著人口老齡化的加劇和人們生活水平的提高,糖尿病的發(fā)病率一直在上升,已嚴(yán)重影響到人們的生活質(zhì)量[1]。糖尿病性白內(nèi)障是導(dǎo)致患者視力下降的主要原因之一。持續(xù)的高血糖通過(guò)改變晶狀體的滲透壓、誘發(fā)晶狀體氧化應(yīng)激等途徑,加速白內(nèi)障的發(fā)生發(fā)展[2-3]。雖然目前手術(shù)是治療白內(nèi)障的有效方式,但糖尿病患者術(shù)中危險(xiǎn)程度高,術(shù)后并發(fā)癥較多,因此迫切需要一種藥物用于干預(yù)治療[4]。血紅素氧合酶1(heme oxygenase-1,HO-1)是Hmox-1基因編碼的熱休克蛋白,存在于身體的各個(gè)組織和器官中,其將血紅素以限速的方式分解為三種重要的副產(chǎn)物 —— 一氧化碳、亞鐵和膽綠素[5]。在各種病理生理?xiàng)l件的刺激下,人體內(nèi)可產(chǎn)生HO-1[6]。研究發(fā)現(xiàn)降低氧化因子或增加抗氧化因子的產(chǎn)生,可能是治療和預(yù)防白內(nèi)障的有效方式,而HO-1及其產(chǎn)物具有抗氧化、抗炎、抗凋亡等作用[6]。因此我們假設(shè)HO-1對(duì)白內(nèi)障有治療作用,用高糖誘導(dǎo)晶狀體上皮細(xì)胞為模型模擬葡萄糖性白內(nèi)障,運(yùn)用HO-1誘導(dǎo)劑鈷原卟啉(cobalt protoporphyrin,CoPP)和抑制劑鋅原卟啉(zinc protoporphyrin,ZnPP)上調(diào)或下調(diào)HO-1的表達(dá),觀察HO-1是否對(duì)高糖誘導(dǎo)的晶狀體上皮細(xì)胞有保護(hù)作用,為糖尿病白內(nèi)障尋找有效的藥物干預(yù)方式。
材料與方法
1 材料 人晶狀體上皮細(xì)胞系(SRA01/04,中國(guó)廣州吉妮歐生物科技有限公司);D-葡萄糖(Solarbio,中國(guó));HO-1抗體(Cambridge,英國(guó));鈷原卟啉,鋅原卟啉(St Louis,MO,美國(guó));青霉素鏈霉素溶液(Hyclone,美國(guó));Annexin V-FITC/PI細(xì)胞凋亡雙試劑盒(碧云天,中國(guó));CCK-8檢測(cè)試劑盒,活性氧(reactive oxygen species,ROS)檢測(cè)試劑盒(碧云天,中國(guó))。
2 晶狀體上皮細(xì)胞(SRA01/04)的培養(yǎng)與分組 晶狀體上皮細(xì)胞(SRA01/04)培養(yǎng)于10%胎牛血清的1640培養(yǎng)液中,置于25 cm2培養(yǎng)瓶,于37℃、5% CO2孵育箱中培養(yǎng)。待細(xì)胞完全融合至80% ~ 90%時(shí)經(jīng)0.25%含EDTA胰酶消化,按1∶3傳代,取良好的對(duì)數(shù)生長(zhǎng)期的細(xì)胞進(jìn)行實(shí)驗(yàn)。將實(shí)驗(yàn)分為高糖處理組和正常處理組,高糖處理組在1640培養(yǎng)液中添加葡萄糖,濃度分為15 mmol/L、30 mmol/L、50 mmol/L、100 mmol/L;5 mmol/L為正常對(duì)照組。
3 CCK-8實(shí)驗(yàn)檢測(cè)不同濃度下晶狀體上皮細(xì)胞(SRA01/04)的增殖活力 將對(duì)數(shù)生長(zhǎng)期的SRA01/04細(xì)胞用0.25% EDTA胰酶消化后,于基礎(chǔ)溶液中重懸,按4×104/L的細(xì)胞密度接種于96孔細(xì)胞培養(yǎng)板,每孔100 mL,設(shè)置6個(gè)孔重復(fù)。常規(guī)培養(yǎng)24 h,待細(xì)胞貼壁后,按上文中高糖處理組和正常對(duì)照組的要求更換培養(yǎng)液,繼續(xù)培養(yǎng)24 h,培養(yǎng)結(jié)束后棄上清液,于避光條件下每孔加入100 mL CCK-8試劑,37℃、5% CO2恒溫反應(yīng)24 h后,置于微板孔分光光度計(jì)450 nm波長(zhǎng)處取吸光度(OD)值。
4 流式細(xì)胞術(shù)測(cè)定細(xì)胞內(nèi)ROS相對(duì)含量 用二氯熒光素二乙酸DCFH-DA檢測(cè)試劑盒。對(duì)數(shù)期人晶狀體上皮細(xì)胞6組接種于24孔板中,稱(chēng)取180.2 mg的葡萄糖,加1 mL基礎(chǔ)培養(yǎng)基配制成1 mol/L母液進(jìn)行過(guò)濾,配置所需葡萄糖濃度,DMSO稀釋為10 mmol/L母液過(guò)濾,分別培養(yǎng)3組,共分為6組:正常組(control) 5 mmol/L,高糖組(D) 100 mmol/L,將CoPP、ZnPP用母液稀釋1 000倍至10 μmol/L,加入高糖組和正常組培養(yǎng)基中,形成Control 5 mmol/L + CoPP 10 μmol/L組、Control 5 mmol/L + ZnPP 10 μmol/L組、D 100 mmol/L + CoPP 10 μmol/L組、D 100 mmol/L +ZnPP 10 μmol/L組,6組均培養(yǎng)24 h后,按照1∶1 000用無(wú)血清培養(yǎng)液稀釋DCFH-DA,使終濃度為10 μmol/L。去除細(xì)胞培養(yǎng)液,加入稀釋好的DCFH-DA。活性氧陽(yáng)性對(duì)照孔加1∶1 000稀釋的試劑刺激細(xì)胞20 min,37℃細(xì)胞培養(yǎng)箱內(nèi)孵育20 min。用無(wú)血清細(xì)胞培養(yǎng)液洗滌細(xì)胞3次,以充分去除未進(jìn)入細(xì)胞內(nèi)的DCFH-DA。立即采用流式細(xì)胞儀(BD)在激發(fā)波長(zhǎng)(Ex)為488 nm和發(fā)射波長(zhǎng)(Em)為530 nm處檢測(cè)。
5 Annexin V-FITC/PI檢 測(cè) 細(xì) 胞 凋 亡 比 例 用Annexin V-FITC/PI測(cè)量細(xì)胞凋亡的比例。對(duì)數(shù)期人晶狀體上皮細(xì)胞接種于24孔板中,調(diào)整細(xì)胞密度至1×106/mL,將0.2 mL細(xì)胞懸液從細(xì)胞培養(yǎng)板中(2×105個(gè)細(xì)胞)用移液槍轉(zhuǎn)移到干凈的離心管中;室溫1 000 g離心5 min,去除培養(yǎng)基。分組培養(yǎng)24 h后(Control 5 mmol/L組;Control 5 mmol/L + CoPP 10 μmol/L組;Control 5 mmol/L +ZnPP 10 μmol/L組;D 100 mmol/L組;D 100 mmol/L +CoPP 10 μmol/L組;D 100 mmol/L + ZnPP 10 μmol/L組),用0.2 mL預(yù)冷的PBS溶液輕輕重懸,室溫1 000 g離心5 min,去上清;細(xì)胞沉淀用0.2 mL預(yù)冷的結(jié)合緩沖液輕輕重懸,加入5 μL Annexin-FITC、5 μL PI染液,輕輕混勻,室溫(18℃~24℃)下避光孵育10~15 min,用流式細(xì)胞儀檢測(cè)(Ex=488 nm;Em=530 nm)細(xì)胞凋亡率。
6 鏡下觀察培養(yǎng)各組細(xì)胞凋亡形態(tài)學(xué)變化 在顯微鏡下觀察6組(Control 5 mmol/L組;Control 5 mmol/L + CoPP 10 μmol/L組;Control 5 mmol/L +ZnPP 10 μmol/L組;D 100 mmol/L組;D 100 mmol/L +CoPP 10 μmol/L組;D 100 mmol/L + ZnPP 10 μmol/L組)已干預(yù)細(xì)胞的凋亡形態(tài)學(xué)改變。
7 統(tǒng)計(jì)學(xué)分析 采用SPSS20.0進(jìn)行統(tǒng)計(jì)分析,計(jì)量數(shù)值以表示。采用單因素方差分析進(jìn)行多組均數(shù)比較,兩兩比較采用Dunnett's 檢驗(yàn)或Tukey’s檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
結(jié) 果
1 細(xì)胞增殖活力 CCK-8檢測(cè)結(jié)果顯示,15 mmol/L葡萄糖在24 h內(nèi)對(duì)晶狀體上皮細(xì)胞無(wú)影響(P>0.05)。當(dāng)葡萄糖濃度達(dá)到30 mmol/L時(shí),晶狀體上皮細(xì)胞增殖活力升高(P<0.01)。當(dāng)葡萄糖濃度持續(xù)升高至50 mmol/L時(shí),晶狀體上皮細(xì)胞的增殖活力也隨之升高(P<0.01)。當(dāng)葡萄糖濃度達(dá)到100 mmol/L時(shí),細(xì)胞增殖活力降低(P<0.01)。見(jiàn)圖1。
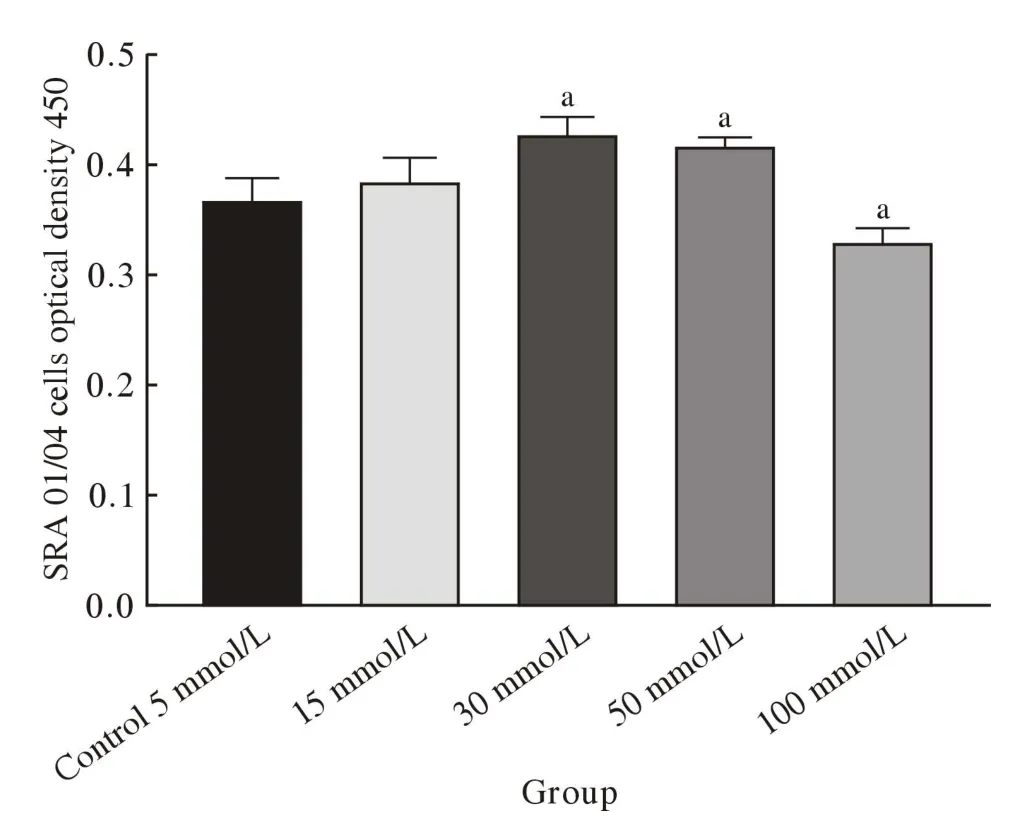
圖1 晶狀體上皮細(xì)胞(SRA01/04)在不同濃度葡萄糖中培養(yǎng)24 h的增殖活性(CCK-8檢測(cè))(aP<0.01,vs control)Fig.1 Proliferative activity of lens epithelial cells (SRA01/04)cultured in different glucose concentrations for 24 h (CCK-8 test)(aP<0.01, vs control)
2 HO-1抑制高糖誘導(dǎo)晶狀體上皮細(xì)胞產(chǎn)生ROS 使用熒光探針DCFH-DA流式細(xì)胞儀測(cè)量ROS的產(chǎn)生。高糖組(D組)細(xì)胞內(nèi)ROS相對(duì)含量增加至51.63%±1.74%,是正常組(Control組)ROS相對(duì)含量(4.70%±1.27%)的10倍余。高糖組加入HO-1誘導(dǎo)劑CoPP后(D + CoPP組,43.37%±2.08%),細(xì)胞內(nèi)ROS相對(duì)含量較高糖組(D組)明顯降低(P<0.01);高糖組加入HO-1抑制劑ZnPP后(D + ZnPP組,60.10% ±1.54%),細(xì)胞內(nèi)ROS相對(duì)含量較高糖組(D組)明顯升高(P<0.01)。見(jiàn)圖2。

圖2 流式細(xì)胞術(shù)測(cè)定各組ROS相對(duì)含量(aP<0.01,vs control;bP<0.01,vs group D)Fig.2 ROS levels in each group were measured by Rhyndrocytometry (aP<0.01, vs control; bP<0.01, vs group D)
3 HO-1可減輕高糖誘導(dǎo)下SRA01/04的細(xì)胞凋亡 流式細(xì)胞術(shù)顯示,高糖組(D組)細(xì)胞凋亡比例為39.56%±0.50%,明顯高于正常組的3.05%±0.35%(P<0.01)。高糖組加入HO-1誘導(dǎo)劑CoPP后(D + CoPP組,33.72%±2.05%),細(xì)胞凋亡率較高糖組(D組)明顯降低(P<0.001);高糖組加入HO-1抑制劑ZnPP后(D + ZnPP組,44.53%±0.48%),細(xì)胞凋亡率較高糖組(D組)明顯升高(P<0.01)。見(jiàn)圖3。

圖3 流式測(cè)定各組細(xì)胞凋亡率的比較(aP<0.01,vs control;bP<0.01,vs group D)Fig.3 Comparison of the proportion of apoptosis in each group by flow cytometry (aP<0.01, vs control; bP<0.01, vs group D)
4 鏡下觀察細(xì)胞形態(tài)學(xué)變化 鏡下觀察到高糖組(D組)細(xì)胞的形態(tài)發(fā)生明顯改變,游離死細(xì)胞明顯多于正常組,當(dāng)各自加入誘導(dǎo)劑CoPP后,形態(tài)規(guī)則、生長(zhǎng)良好的細(xì)胞明顯增多;反之,當(dāng)各自加入抑制劑ZnPP后,形態(tài)規(guī)則、生長(zhǎng)良好的細(xì)胞明顯減少。見(jiàn)圖4。

圖4 各組培養(yǎng)晶狀體上皮細(xì)胞形態(tài)Fig.4 Morphology of cultured lens epithelial cells in each group
討 論
糖尿病患者的晶狀體抗氧化酶(如超氧化物歧化酶和過(guò)氧化氫酶)異常,從而導(dǎo)致氧化應(yīng)激[7-8]。氧化應(yīng)激對(duì)晶狀體上皮細(xì)胞造成直接的損傷,如蛋白的交聯(lián)、聚集和沉淀,此過(guò)程中產(chǎn)生有毒物質(zhì),最終導(dǎo)致白內(nèi)障[9-10]。缺乏HO-1的小鼠很難維持晶狀體的透明度,隨著時(shí)間的延長(zhǎng),其晶狀體越來(lái)越渾濁[9,11]。多項(xiàng)研究均證實(shí)HO-1具有保護(hù)細(xì)胞免受氧化應(yīng)激、抗增殖、抗輻射等作用[11-14]。
ROS是氧正常代謝的天然副產(chǎn)物,在細(xì)胞信號(hào)傳導(dǎo)和體內(nèi)平衡中具有重要作用,ROS可觸發(fā)細(xì)胞死亡的生理或程序途徑[15-18]。高糖誘導(dǎo)引起的氧化應(yīng)激產(chǎn)生ROS,擾亂了抗氧化系統(tǒng),使自由基大量積累,內(nèi)環(huán)境平衡遭到了破壞,被認(rèn)為是白內(nèi)障發(fā)生和發(fā)展的分子基礎(chǔ)[19]。因此抗氧化劑可延緩白內(nèi)障的進(jìn)展。本實(shí)驗(yàn)中,加入HO-1誘導(dǎo)劑CoPP組的ROS相對(duì)含量明顯減少,加入HO-1抑制劑ZnPP組的ROS相對(duì)含量明顯升高。
本實(shí)驗(yàn)中,在急性高糖的刺激下,晶狀體上皮細(xì)胞形態(tài)學(xué)發(fā)生改變,出現(xiàn)明顯的生長(zhǎng)脫離、胞質(zhì)收縮、細(xì)胞核大小不一、死細(xì)胞漂浮等變化。高糖組(D組)細(xì)胞凋亡比例(39.56%± 0.50%)較對(duì)照組(3.05%±0.35%)明顯升高。根據(jù)細(xì)胞水平檢測(cè),HO-1高表達(dá)時(shí),加入HO-1誘導(dǎo)劑CoPP組(Control + CoPP組、D + CoPP組)細(xì)胞凋亡比例較低;HO-1低表達(dá)時(shí),加入HO-1抑制劑ZnPP組(Control + ZnPP組、D + ZnPP組)細(xì)胞凋亡比例明顯高于對(duì)照組。HO-1的高表達(dá)明顯抑制了ROS的相對(duì)含量,從而使細(xì)胞的凋亡比例明顯下降,抵御了氧化應(yīng)激帶給細(xì)胞帶來(lái)的損傷,這與其對(duì)肝損傷、血管疾病、缺血再灌注損傷的保護(hù)作用相符[20]。這些結(jié)果均表明,HO-1對(duì)高糖誘導(dǎo)晶狀體上皮細(xì)胞產(chǎn)生的氧化應(yīng)激和凋亡有保護(hù)作用。
綜上所述,本研究通過(guò)HO-1激動(dòng)劑CoPP和抑制劑ZnPP調(diào)節(jié)HO-1的表達(dá)水平,發(fā)現(xiàn)HO-1對(duì)高糖誘導(dǎo)晶狀體上皮細(xì)胞的損害起到了一定的保護(hù)作用。HO-1是一種潛在治療糖尿病性白內(nèi)障的措施。然而由于實(shí)驗(yàn)的局限性,并沒(méi)有數(shù)據(jù)證明HO-1在體內(nèi)是否對(duì)糖尿病性白內(nèi)障起到有效的保護(hù)作用,進(jìn)一步將細(xì)胞培養(yǎng)結(jié)果轉(zhuǎn)化為動(dòng)物研究是非常必要的。本研究的結(jié)果提示HO-1體內(nèi)治療糖尿病性白內(nèi)障或成為可能。

