胃癌患者手術前后血清PGⅠ、PGⅡ及二者比值變化對術后復發或轉移的預測價值
張 冰 姚 威 宋 濤
胃癌具有早期診斷困難,術后恢復緩慢,發病率和死亡率高的特點,是中國最常見的惡性腫瘤之一[1]。幽門螺桿菌感染和萎縮性胃炎與胃癌發展密切相關,胃蛋白酶原(PG)在胃癌的發展過程中都會發生一系列變化[2-3]。用放射免疫法檢測胃癌及其他胃病患者血清PG,具有簡單、有效和經濟的優點,對胃癌的早期診斷和術后復發的早期預測具有重要意義,有效提高胃癌治愈率和生存率,降低死亡率[4]。PG能反映胃粘膜不同部位的形態和分泌功能,主要進入胃腔,根據免疫原性不同可分為PGⅠ和PGⅡ兩個亞組,胃粘膜中分泌細胞的分布不同,胃底腺粘膜的主要細胞和宮頸細胞主要分泌PGI和少量PGⅡ,門控腺、幽門腺和Burnner's可產生PGⅡ[5-6]。本次研究選取我院確診的擬實施胃癌根治性手術的患者90例,探討胃癌患者血清胃蛋白酶原Ⅰ(PGⅠ)、PGⅡ及其相互間比值(PGR)在手術前后的變化及對患者復發或轉移的預測價值。
1 資料與方法
1.1 臨床資料
選取我院2016年1月至2018年1月確診的擬實施胃癌根治性手術的患者90例作為觀察組、選取45例健康體檢對象作為對照組。入選標準:①患者年齡范圍79歲以內;②術前經胃鏡檢查確診為胃癌;③TNM分期:Ⅰ期~Ⅲ期;④具有手術適應癥,在我院接受同一組醫護人員手術治療;⑤術后接受隨訪觀察;⑥復發及轉移的診斷以CT、超聲及病理學結果為標準;⑦本研究符合《赫爾透辛基宣言》相關醫學倫理規定,經我院醫學倫理委員會批準。排除標準:①轉移性胃癌;②既往手術后再次復發的胃癌患者;③合并其他部位的腫瘤;④免疫系統疾病;⑤不愿接受術后隨訪。觀察組,患者年齡39~72歲,平均(54.8±9.2)歲,男性50例、女性40例;TNM分期:Ⅰ期15例、Ⅱ期53例、Ⅲ期22例,腫瘤分化程度:高分化28例、中分化43例、低分化19例;發生淋巴結轉移44例;其中實施胃大部切除62例、全胃切除28例;隨訪24個月,復發22例、轉移20例。對照組,年齡33~75歲,平均(56.1±12.0)歲,男性24例、女性21例。兩組研究對象的年齡、性別比較,差異不具有統計學意義(P>0.05)。
1.2 指標檢測方法
所有受試者均在早上6點空腹抽取3 ml靜脈血,高速離心分離血清,并在2 h內完成試驗。患者在術前10 h禁食,所有樣本檢測均使用LumiStation 1800Plus型化學發光酶標儀(上海閃譜生物科技有限公司),PGⅠ、PGⅡ檢測試劑盒(北京奧維亞生物技術有限公司),應用ELISA法來檢測血清中術前、術后1周、術后1個月的血清PGⅠ、PGⅡ水平,計算PGR值。檢測方法嚴格參照試劑盒內說明書進行。常參考值范圍:PG I為67~200 μg/l,PGII為0~15 μg/l,PGR為≥7.5 μg/l。
術后對患者進行隨訪,依據24個月后是否出現復發、轉移進行分組比較,繪制工作曲線(ROC)分析手術前患者的PGⅠ、PGⅡ及PGR。
1.3 統計學方法
2 結果
2.1 對照組和觀察組血清PGⅠ、PGⅡ及PGR測定值比較
觀察組術前的血清PGⅠ、PGR測定值顯著低于對照組(P<0.05),觀察組患者術后1周、術后1個月的血清PGⅠ、PGR測定值均較本組術前顯著升高(P<0.05),見表1。

表1 對照組和觀察組的血清PGⅠ、PGⅡ及PGR測定值比較
2.2 復發或轉移組與未復發或轉移組患者的血清PGⅠ、PGⅡ及PGR測定值比較
復發或轉移組術前的血清PGⅠ、PGR測定值顯著低于未復發或轉移的患者(P<0.05)。見表2。

表2 復發或轉移組與未復發或轉移組患者的血清PGⅠ、PGⅡ及PGR測定值比較
2.3 血清PGⅠ、PGR測定值預測患者術后復發的關系
以胃癌患者手術前的血清PGⅠ、PGR測定值繪制ROC曲線,結果顯示,術前的血清PGⅠ預測胃癌術后復發或轉移的靈敏度為78.17%、特異度為65.24%、ROC曲線下面積AUC值為0.730;術前的血清PGR預測胃癌術后復發或轉移的靈敏度為93.35%、特異度為78.66%、ROC曲線下面積AUC值為0.861。見表3、圖1。

表3 血清PGⅠPGR測定值預測術后復發的價值
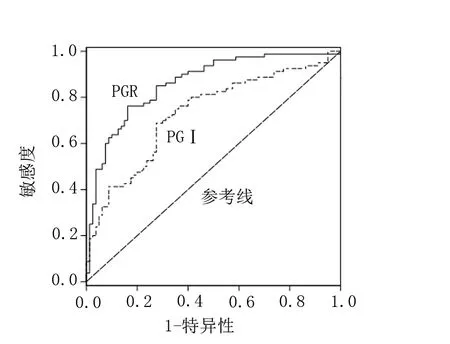
圖1 胃癌患者血清PGⅠPGR預測術后復發ROC曲線圖
3 討論
胃癌的發病率和死亡率一直是我國惡性腫瘤中最高的,也是我國最常見的惡性腫瘤之一,早期發現和對癥治療是胃癌療效的關鍵[7]。為早期胃癌或胃癌癌前病變的大規模篩查找到1種簡單、靈敏和無創的方法尤為重要。在日本、芬蘭等國,用血清學方法對萎縮性胃炎和胃癌進行鑒別診斷的研究已經進行了多年[8]。胃蛋白酶原(PG)是胃蛋白的前體,沒有活性,大多數食物蛋白質可以刺激PG的分泌,可在人體胃液、血清和尿液中檢測到,在胃中被鹽酸轉化為活性胃蛋白酶[9-10]。PG可以通過反映胃粘膜的結構和分泌功能,間接反映胃粘膜的功能。基于其免疫活性,將血清PG分為兩種亞型,即PGⅠ和PG Ⅱ[11]。PGⅠ主要由胃底腺細胞和粘液細胞分泌,可作為胃體的血清學標志,當胃粘膜腺體萎縮時,PG I減少;PGII是由賁門的賁門腺、胃竇的幽門腺和十二指腸附近的Burnner's產生的[12]。在正常情況下,大約1%的PG可以進入人體血液循環,而大多數PG進入胃腔并在酸性胃液的作用下轉化為胃蛋白酶。當急性和慢性胃粘膜炎癥發生時,炎癥因子刺激導致PG I和PG II水平升高。當慢性炎癥導致胃粘膜萎縮、非典型增生和癌變時,PG Ⅰ和PG Ⅱ水平的變化將導致PGR水平的變化。因此,前列腺素水平可用于篩選晚期萎縮性胃炎和早期胃癌[13]。
血清水平的變化可以直接反映胃粘膜的功能變化[13]。從本次結果來看,對照組和觀察組的血清PGⅠ、PGⅡ及PGR測定值進行比較發現,觀察組術前的血清PGⅠ、PGR測定值明顯低于對照組,超過80%的胃癌與萎縮性胃炎相關,并且萎縮性胃炎可導致胃粘膜主要細胞的損失,這影響分泌功能并導致PGI水平降低。胃癌患者血清PGII含量變化不大,可能與胃黏膜PGII分泌細胞分布廣泛有關[14]。術后胃癌患者血清PGⅠ、PGⅡ水平可以顯示殘胃粘膜腺體的分泌情況,對血液水平進行檢測。術后1周、術后1個月觀察組患者的血清PGⅠ、PGR測定值均較本組術前顯著的升高;因為受正常細胞分泌的影響胃癌細胞分泌的PG,在血清中無法檢測到,因此當胃完全切除時,如果PGⅠ、PGⅡ水平上升,最有可能是胃癌細胞分泌的,可能有癌癥復發,應該進行進一步的胃鏡檢查[14-15]。對隨訪患者血清PGⅠ、PGⅡ及PGR測定值進行比較,復發或轉移組術前的血清PGⅠ、PGR測定值顯著高于未復發或轉移的患者,差異具有統計學意義。說明全胃切除后血清PGⅠ、PGⅡ及PGR的顯著升高為胃癌復發的臨床指標之一。
以胃癌患者手術前的血清PGⅠ、PGR測定值繪制ROC曲線,靈敏度為縱坐標,(1-特異度)為橫坐標。ROC曲線下面積AUC值越接近1,說明該指標對胃癌診斷的效果就越好。結果顯示,術前的血清PGⅠ預測胃癌術后復發或轉移的靈敏度為78.17%、特異度為65.24%、ROC曲線下面積AUC值為0.730;術前的血清PGR預測胃癌術后復發或轉移的靈敏度為93.35%、特異度為78.66%、ROC曲線下面積AUC值為0.861。結果與郭會玲等[9]相比特異度及敏感度均較高,這可能與本研究中收集的小樣本量有關,需要進一步擴大用于分析的樣本量,找到PGⅠ、PGⅡ水平及PGR診斷胃癌的最佳界值。
過去鋇餐X光透視通常用于診斷胃癌,但這種方法存在輻射暴露的風險;內窺鏡檢查會給患者帶來更大的痛苦和更高的成本。綜上所述,檢測胃癌患者手術前后的血清PGⅠ、PGR水平,具有簡便快捷,創傷小的優點,對于評估患者術后復發具有一定的臨床價值,對于指導患者術后治療具有一定的作用。

