腎移植術后長期服用免疫抑制劑誘發惡性腫瘤的影響因素分析
喬良偉 王 凱 李 明
腎移植手術對終末期腎病治療效果確切,目前已得到廣泛應用。在腎移植術后,應用免疫抑制劑可延長患者生存時間,但是,免疫抑制劑的長期應用會帶來一定并發癥,包括感染、心血管疾病、惡性腫瘤等[1]。研究顯示,腎移植術后,患者發生惡性腫瘤的風險高達2.19%~6.7%,在我國約為2.2%[2]。惡性腫瘤目前已成為導致腎移植患者術后病死的主要原因,相較于一般患者,腎移植手術患者腫瘤侵襲性更高,預后更差[3]。因此,探明影響長期使用免疫抑制劑的腎移植患者發生惡性腫瘤的相關因素較為重要,對指導早期干預、降低病死率、改善預后結局具有積極意義。但是,目前相關研究較少,較多研究主要分析免疫抑制劑的使用對惡性腫瘤發生的影響,重點在于藥物本身帶來的影響。本研究主要分析腎移植術后長期服用免疫抑制劑患者惡性腫瘤發病的影響因素,以指導后續早期風險因素的評估與防治干預,旨在改善患者預后。
1 資料與方法
1.1 一般資料
回顧性分析2014年1月至2020年1月197例于醫院完成腎移植并在術后長期服用免疫抑制劑患者的資料。197例患者,男性112例,女性85例;年齡22~53歲,平均年齡(43.12±5.33)歲;體重指數18.53~24.46 kg/m2,平均體重指數(21.55±1.06)kg/m2;原發病:慢性腎小球腎炎118例,慢性腎功能不全46例,間質性腎炎14例,腎盂腎炎10例,囊性腎病9例。
1.2 入選標準
納入標準:①惡性腫瘤患者經穿刺活檢或手術病理學檢查確診;②首次接受腎移植術且均成功完成腎移植;③腎移植術后腎功能正常;④腎移植術后長期服用免疫抑制劑。排除標準:①屬于肝腎聯合移植或胰腎聯合移植;②精神、溝通障礙;③臨床資料不完整;④失訪或隨訪資料缺失。
1.3 方法
設計一般資料填寫表,仔細查閱研究對象的相關資料并記錄研究所需基線資料情況,內容包括:(1)性別;(2)年齡;(3)體重指數;(4)原發病:劃分為慢性腎小球腎炎和其他;(5)血藥濃度:采集3 ml空腹靜脈血,根據根據FK506國際監測原則,使用全自動生化分析儀(邁瑞BS-280型),以酶聯吸附免疫分析方法檢測血藥濃度,隨訪期間每3個月監測1次,直至確診為惡性腫瘤或隨訪結束,取這期間所得結果平均值作為最終結果;(6)乙型肝炎病毒(Hepatitis B virus,HBV)感染:采集3~5 ml空腹靜脈血,分離血清,應用熒光定量PCR儀(德國Roche公司,Lightcycler)與HBV-DNA熒光定量試劑盒(湖南圣湘生物科技有限公司),采用熒光實時定量聚合酶鏈反應(FQ-PCR)檢測HBV-DNA定量,HBV-DNA≥500 IU/ml判為陽性;(7)Treg細胞水平:采集2 ml空腹靜脈血,使用美國BD公司提供的流式細胞儀測定Treg細胞水平;(8)營養不良:根據簡易營養評價表對營養狀況進行評估,評分越高表示營養狀況越佳,<17分為營養不良;≥17分為營養正常;(9)抑郁、焦慮:參照焦慮自評量表(Self-Rating Anxiety Scale,SAS)、抑郁自評量表(Self-Rating Depression Scale,SDS)評估,均采用4級評分,SAS共20個條目,標準分的分界值為50分,>50分為焦慮,分值越高表示焦慮程度越嚴重;SDS共有20個條目,標準分的分界值為53分,>53分為抑郁,分值越高表示抑郁程度越嚴重。
1.4 統計學方法
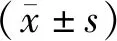
2 結果
2.1 惡性腫瘤發生情況
本研究197例腎移植術后長期服用免疫抑制劑的患者中11例發生惡性腫瘤,惡性腫瘤發病率為5.58%(11/186),包括4例(36.36%)腎癌,4例(36.36%)肺癌,2例(18.18%)乳腺癌,1例(9.09%)大腸癌。
2.2 基線資料
惡性腫瘤患者相較于其他患者,HBV感染占比更大,血藥濃度、Treg細胞水平更高,差異有統計學意義(P<0.05);組間其他基線資料比較差異無統計學意義(P>0.05)。見表1。
2.3 腎移植術后長期服用免疫抑制劑誘發惡性腫瘤的影響因素分析
2.3.1 單因素分析 將經基線資料分析得到的差異有統計學意義的變量作為自變量并進行變量說明,見表2,將惡性腫瘤發生情況作為因變量(1=發生,0=未發生),經Logistic回歸分析結果顯示,血藥濃度高、HBV感染、Treg細胞高表達可能是腎移植術后長期服用免疫抑制劑誘發惡性腫瘤的影響因素(OR>1,P<0.05)。見表3。

表2 自變量賦值情況

表3 單因素分析結果
2.3.2 多因素分析 將基線資料中全部資料納入作為協變量,將惡性腫瘤發生情況作為因變量(1=發生,0=未發生),校正性別、年齡等帶來的影響,建立Logistic多元回歸模型行多因素分析,結果顯示,血藥濃度高、HBV感染、Treg細胞高表達均是腎移植術后長期服用免疫抑制劑誘發惡性腫瘤的影響因素(OR>1,P<0.05)。見表4。

表4 多因素分析結果
3 討論
由于免疫抑制劑的使用,腎移植術患者惡性腫瘤發病率較常人高,且腫瘤的發展速度更快、惡性程度高,預后更差[4]。免疫抑制劑的使用會使機體處于免疫抑制的狀態,使免疫功能無法發揮作用,不能及時殺滅癌變細胞,增加惡性腫瘤發病風險[5]。
研究表明,肝移植術后使用免疫抑制劑患者惡性腫瘤發生率為0.840%(17/2042)[6]。本研究結果顯示,惡性腫瘤發病率為5.58%(11/186),發生率嚴重高于上述結果,這可能與本研究納入樣本入選標準有關,但結果也證實了腎移植術后患者長時間使用免疫抑制劑帶來的不良影響,早期找到影響因素尤為必要。本研究經單因素與多因素分析結果顯示,血藥濃度高、HBV感染、Treg高表達均是腎移植術后長期服用免疫抑制劑誘發惡性腫瘤的影響因素。有研究發現,腎移植后發生惡性腫瘤的患者血藥濃度較無惡性腫瘤的患者更高[7]。免疫抑制劑長期使用和積累,會造成個體的免疫功能降低及腫瘤免疫監視機制損壞,增加感染風險,且無法抑制腫瘤細胞的增殖、分化,從而誘發惡性腫瘤[8]。血藥濃度高的患者可能因此受免疫抑制劑帶來的免疫功能影響更大,從而增加惡性腫瘤發生風險[9]。因此,建議臨床對腎移植術后患者免疫抑制劑血藥濃度進行嚴格監控和調整,保證血藥濃度在安全范圍內,避免濃度過高而增加惡性腫瘤發生風險。本研究中,腎移植術后長期免疫抑制劑使用誘發惡性腫瘤患者中,肝癌和腎癌所占比重較大,故推測HBV感染可能也與惡性腫瘤的誘發有一定聯系,且該推測也被研究所證實。HBV不僅能通過感染膽管上皮細胞,侵犯機體,而且具有嗜肝性,造成肝臟損傷后會加速炎癥因子分泌,促使炎癥微環境形成,從而增加惡性腫瘤的發生風險[10]。同時,HBV感染后,不僅能誘導肝癌細胞大量分泌,而且造成免疫抑制相關基因上調,加之患者長期使用免疫抑制劑,故更易誘發惡性腫瘤[11]。因此,建議臨床應嚴格監測HBV感染,對于存在HBV感染的患者需及時采取干預,避免HBV感染誘發惡性腫瘤。而Treg細胞導致的惡性腫瘤高患病率,則可能與Treg過表達導致的腫瘤免疫逃逸有關[12]。 Treg細胞可以分泌白細胞介素10、轉化生長因子β等抑制性細胞因子,而Treg細胞過表達則會增加上述因子的表達,加重免疫抑制,造成腫瘤逃避機體免疫,繼而增加腫瘤發生風險;在腫瘤微環境中,Treg細胞能誘導顆粒酶B的表達,促使細胞毒性T淋巴細胞、自然殺傷細胞的溶解,減弱抗腫瘤免疫因子的作用,從而增加惡性腫瘤的發生風險[13]。同時,Treg細胞異常升高還會造成機體產生免疫耐受,增加腫瘤逃逸的幾率,從而誘發惡性腫瘤[14]。因此,建議臨床在腎移植患者術后免疫抑制劑使用過程中密切監測Treg水平,對于Treg細胞水平過表達的患者應及時調控,保證Treg細胞水平正常,從而降低因免疫逃逸或免疫耐受導致的惡性腫瘤高風險。
綜上所述,腎移植術后長期服用免疫抑制劑患者惡性腫瘤發病風險高,可能受血藥濃度高、HBV感染、Treg細胞高表達等因素影響,臨床應重視上述風險因素,及時對患者進行干預,預防惡性腫瘤的發生,改善預后結局。

