紫貽貝加工下腳料抗菌肽的分離及其穩定性研究
時光宇,張 玥,潘淵博,趙莘芷,徐瓊怡,楊玉霞,莊黛娜
(浙江海洋大學東海科學技術學院,浙江舟山 316000)
近年來,抗生素的過度使用導致細菌耐藥性、抗生素殘留等問題日益突出,嚴重制約著我國水產、畜牧養殖及食品工業的可持續發展[1]。因此,迫切需要尋找新型的抗生素替代物。抗菌肽(antimicrobial peptides,AMPs)是生物免疫系統產生的一類抵御外源病原體入侵的低分子質量肽類物質[2],由于具有活性強、安全性高、不易產生耐藥性等特點,有望成為化學防腐劑、抗生素的理想替代品[3]。
貽貝是一種濾食性底棲海洋生物,長期生活在微生物多樣性和復雜性的環境里(菌落總數為9 lgCFU·mL-1)[4],由于缺乏特異免疫系統,抗菌肽成為其抵御外源病原微生物侵襲的重要屏障[5]。目前,從3 種貽貝屬(地中海貽貝Mytilus galloprovincialis、紫貽貝M.edulis 和厚殼貽貝M.coruscus)和1 種股貽貝屬(翡翠貽貝Perna viridis)的血細胞、鰓和消化腺中鑒定出100 多種抗菌肽,按其序列特征可分為7 個家族[6],即Myticin、Mytilin、Mytimycin、MGD、Myticusin、big defensins 和Mytimacin。不同生長環境與發育階段的貽貝會分泌不同抗菌肽抵御外源病原微生物的侵襲[7],而不同抗菌肽有著不同的結構和序列,其抑菌活性、理化性質及穩定性等特征也相應存在差異。
目前,有關紫貽貝抗菌肽的研究相對較少,如CHARLET,et al[8]從紫貽貝血液中分離鑒定出5 個抗菌肽,即defensin A(4 314.3 Da)、defensin B(4 392.4 Da)、Mytilin A(3 773.7 Da)、Mytilin B(3 974.3 Da)和Mytimycin(6 233.5 Da);李哲等[9]從紫貽貝肉中提取分離出1 個抗菌肽(5 908 Da),而宋宏霞[10]從紫貽貝肉的酶解液中分離出1 個抗菌肽(2 490 Da)。張玥等[11]嘗試利用超聲輔助乙酸提取紫貽貝加工下腳料(受損/小規格紫貽貝)中抗菌肽,結果表明工藝可行。為了實際生產中能正確應用抗菌肽,需對其抑菌活性、理化性質及穩定性等特征要有詳細了解,而抗菌肽的分離純化是抑菌活性、理化性質與結構鑒定的基礎。
多肽分離方法主要有超濾、離子交換色譜、凝膠過濾色譜、超/高效液相色譜、親和色譜等方法。實際操作中,一般采用2 種或以上分離方法對抗菌肽進行分離,從而精確分離目標肽[12]。因此,本試驗先對紫貽貝加工下腳料粗提抗菌肽的敏感菌進行分析,在此基礎上利用固相萃取、凝膠過濾色譜和半制備高效液相色譜(semi-preparative high performance liquid chromatography,半制備RP-HPLC)對其抗菌肽進行分離純化,并對純度高、活性強的抗菌肽的相對分子質量和穩定性進行分析,從而為紫貽貝加工下腳料抗菌肽的制備與進一步應用提供基礎和依據。
1 材料與方法
1.1 材料與試劑
紫貽貝加工下腳料,舟山市某水產公司提供,受損的和小規格紫貽貝裝入碎冰泡沫箱。
大腸桿菌(GIM1.708)、金黃色葡萄球菌(GIM1.178)、枯草芽孢桿菌(GIM1.222),廣東省微生物菌種保藏中心;營養肉湯培養基、胰酪大豆胨瓊脂培養基,杭州微生物試劑有限公司;Sep-pak C18 固相萃取柱,美國Waters 公司;乙腈,HPLC 級,美國天地公司;三氟乙酸,HPLC 級,國藥集團化學試劑有限公司;其它試劑均為國產分析純。
1.2 儀器與設備
Waring-8010S 組織搗碎機,美國Waring 公司;SK5210HP 型超聲波清洗器(超聲頻率53 KHz,超聲功率200 W),上海科導超聲儀器有限公司;LGJ-10 型冷凍干燥機,北京松原華興科技發展有限公司;SPX-150B-Z 型生化培養箱,上海博迅醫療生物儀器股份有限公司;AKTA Purifier 10 型蛋白純化儀(配有UV-900 型紫外-可見光檢測器和Unicorn 控制軟件),瑞典安瑪西亞公司;Waters 1525-2998 型半制備液相色譜儀(配有Empower 色譜工作站),美國Waters 公司。
1.3 實驗方法
1.3.1 抗菌肽的制備及敏感菌篩選
紫貽貝下腳料半解凍后取肉、清洗、瀝干。準確稱取一定質量的紫貽貝肉,倒入螺口試劑瓶中,按張玥等[11]紫貽貝下腳料抗菌肽提取工藝進行抗菌肽的粗提,上清液凍干后即為紫貽貝粗抗菌肽,按1.3.2 方法測定其多肽含量與得率。
用20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液分別將紫貽貝粗抗菌肽和頭孢克肟配制成100 mg·mL-1多肽溶液和100 μg·mL-1頭孢克肟溶液,其中100 μg·mL-1孢克肟溶液和20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液分別作為陽性對照和陰性對照。以大腸桿菌、金黃色葡萄球菌和枯草芽孢桿菌為受試菌,吸取100 μL 0.22 μm 水相微孔濾膜過濾的濾液,采用瓊脂打孔法[11]測定其抑菌活性。
1.3.2 多肽含量與得率測定
采用考馬斯亮藍法[14],以結晶牛血清蛋白作為標樣,采用最小二乘法做結晶牛血清蛋白標準溶液質量濃度(μg·mL-1)與吸光值A595 的線性回歸方程:y=0.003 6x+0.286,相關系數R2=0.995 1。吸取1.0 mL 適當濃度的多肽溶液,加入5.0 mL 考馬斯亮藍G-250 試劑,渦流混勻靜置5 min 后于595 nm 下測吸光值。多肽含量(%)=多肽溶液質量濃度(μg·mL-1)×多肽溶液體積(mL)×體積稀釋倍數(n)/(1 000×樣品質量(mg));多肽得率(%)=多肽含量(%)×多肽樣品總質量(mg)/樣品質量或進樣多肽質量(mg)×100%。
1.3.3 抑菌活性及殘留率測定
以敏感菌為指示菌,采用瓊脂打孔法[11]測定各分離組分的抑菌活性,抑菌活性以抑菌圈直徑大小(mm)表示。以20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液作為陰性對照,未經處理的抗菌肽溶液作為陽性對照,計算抑菌活性殘留率,抑菌活性殘留率(%)=(樣品抑菌圈直徑-陰性對照抑菌圈直徑)/(陽性對照抑菌圈直徑-陰性對照抑菌圈直徑)×100%。
1.3.4 抗菌肽的分離純化
1.3.4.1 固相萃取
稱取1.0 g 紫貽貝抗菌肽粗提物,溶解于10 mL 0.1%三氟乙酸(trifluoroacetic acid,TFA)溶液中,12 000×g離心10 min,上清液在平衡好的Sep-pak C18 固相萃取柱(6 mL、500 mg)進行分步洗脫分離。分離條件:上樣體積2 mL,流速2 mL·min-1,階段洗脫順序為0%、10%、40%、80%乙腈的0.1%TFA 溶液,洗脫體積12 mL,收集各洗脫組分,分別命名為Sp0、Sp10、Sp40 和Sp80。多次重復上樣洗脫,合并各洗脫液,凍干后按1.3.2 方法測定多肽含量與得率。各洗脫組分用20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液配制成10 mmol·L-1多肽溶液,0.22 μm 水相微孔濾膜過濾備用,按1.3.3 方法測定抑菌活性。
1.3.4.2 Sephadex G-25 層析
上述抑菌活性最高組分用超純水配制成10 mg·mL-1多肽溶液,12 000 ×g 離心10 min,上清液在平衡好的Sephadex G-25 凝膠柱(?1.0 cm×60 cm)中進行分離。柱層析條件:上樣體積1 mL、流速1.0 mL·min-1、檢測波長220 nm,洗脫液為超純水,收集各色譜峰。多次重復分離,合并各色譜峰,凍干后按1.3.2 方法測定多肽含量與得率。各色譜峰用20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液配制成10 mg·mL-1多肽溶液,0.22 μm 水相微孔濾膜過濾備用,按1.3.3 方法測定抑菌活性。
1.3.4.3 半制備RP-HPLC 色譜
上述抑菌活性最高組分用0.1%三氟乙酸溶液配制成1 mg·mL-1多肽溶液,12 000 ×g 離心10 min,上清液進行RP-HPLC 色譜分離。色譜條件:SunfireTM C18 色譜柱(?19 mm×250 mm,5 μm),檢測波長220 nm,柱溫25 ℃,流動相為乙腈(含0.1%TFA)和0.1%TFA,流速1.0 mL·min-1,上樣體積100 μL;線性梯度洗脫模式,60 min 內乙腈體積分數從10%升至40%。多次重復分離,合并收集各色譜峰,凍干后按1.3.2 方法測定多肽含量與得率,各色譜峰用20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液將多肽粉配制成1 mg·mL-1多肽溶液,0.22 μm 水相微孔濾膜過濾備用,按1.3.3 方法測定抑菌活性。
1.3.5 穩定性分析
1.3.5.1 溫度
用20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液將HPLC 分離獲得組分單一、活性強的抗菌肽配制成1 mg·mL-1多肽溶液,800 μL 多肽溶液分裝于離心管內,分別在40、60、80、100 ℃條件下處理10 min 和20 min,冰水冷卻,12 000 ×g 離心10 min,按1.3.3 方法測定其殘留活性,未經熱處理多肽溶液作為陽性對照。
1.3.5.2 反復凍融
用20 mmol·L-1pH 4.0 乙酸-乙酸鈉緩沖液將HPLC 分離獲得組分單一、活性強的抗菌肽配制成1 mg·mL-1多肽溶液,800 μL 多肽溶液分裝于離心管內,置于-18 ℃冰箱中反復凍融2、4、8、12、16 次(冷凍30 min/次,25 ℃水浴30 min/次),12 000 ×g 離心10 min,按1.3.3 方法測定其殘留活性,未經凍融處理的多肽溶液作為陽性對照。
1.3.5.3 蛋白酶
分別用20 mmol·L-1的pH 4.0 乙酸-乙酸鈉緩沖液、20 mmol·L-1的pH 7.5 和pH 8.0 PBS 緩沖液將HPLC 分離獲得組分單一、活性強的抗菌肽配制成1 mg·mL-1多肽溶液;胃蛋白酶、蛋白酶K 和胰蛋白酶也分別用20 mmol·L-1的pH 4.0 乙酸-乙酸鈉緩沖液、20 mmol·L-1的pH 7.5 和pH 8.0 PBS 緩沖液配制成2.5 mg·mL-1酶溶液。分別吸取200 μL 多肽溶液和40 μL 蛋白酶溶液于1.5 mL 離心管內,胰蛋白酶和胃蛋白酶水解溫度為37 ℃、蛋白酶K 酶解溫度為42 ℃,水解時間為90 min,待水解結束后于85 ℃水浴15 min[13],冰水冷卻,12 000 ×g 離心10 min,按1.3.3 方法測定其殘留活性,以未經酶處理的多肽溶液作為陽性對照。
1.3.6 相對分子質量測定
采用凝膠過濾色譜法(gel filtration chromatography,GPC)對HPLC 分離獲得組分單一、活性強的抗菌肽的相對分子質量進行測定。色譜條件:色譜柱Ultrahydrogel 250(7.8 mm×300 mm)串聯Ultrahydrogel 100(7.8 mm×300 mm),流動相50 mmol·L-1PBS(含100 mmol·L-1NaCl,pH 6.8),洗脫速率1.0 mL·min-1,柱溫25 ℃,檢測波長220 nm,上樣質量濃度1 mg·mL-1,上樣體積50 μL。采用細胞色素C(12.4 kDa)、抑肽酶(6.5 kDa)、維生素B12(1.35 kDa)、Tyr-Phe-Glu(457 Da)作為標準分子質量物質,LgMr 與標準物質洗脫時間的線性回歸方程為:LgMr=6.956 9-0.207 2x,相關系數R2=0.998 9。
1.4 數據處理
利用SPSS 19.0 軟件進行數據處理及差異性分析,試驗結果以xˉ±S 表示,P<0.05 差異顯著;采用OriginPro 9.1 軟件進行繪圖。
2 結果與分析
2.1 敏感菌的篩選
經超聲輔助乙酸提取與冷凍干燥后,紫貽貝加工下腳料抗菌肽粗提物凍干粉呈淡黃色粉末,經計算其得率為(1.55±0.04)%。紫貽貝抗菌肽粗提物對金黃色葡萄球菌和大腸桿菌具有抑菌活性,其抑菌活性分別達到陽性對照的88.06%和33.21%(表1);而抗菌肽粗提物對枯草芽胞桿菌無抑菌效果(抑菌圈直徑<2 mm),這與CHANDRAN,et al[15]的研究結果相一致,表明抗菌肽的抑菌活性具有選擇性和特異性。因此,后續試驗選用金黃色葡萄球菌作為敏感指示菌。
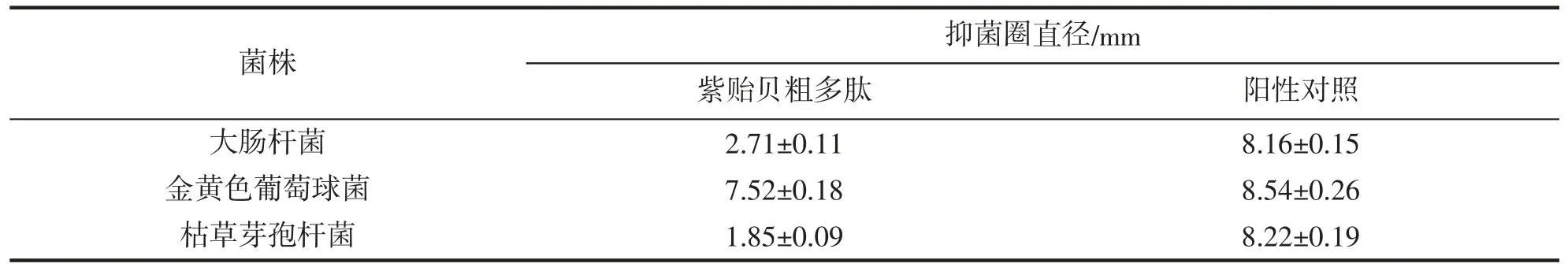
表1 紫貽貝粗抗菌肽的抑菌活性Tab.1 Antimicrobial activity of crude antimicrobial peptides from M.edulis by-products
2.2 分離純化
2.2.1 固相萃取
固相萃取因其簡單、方便而廣泛被應用于多肽和蛋白的富集純化[16]。由圖1 可知,Sp40 和Sp80 洗脫組分具有抑菌活性,而Sp0 和Sp10 洗脫組分無抑菌活性,這與DEFER,et al[17]的研究結果相似。其中,Sp40洗脫組分的抑菌活性最高,抑菌圈直徑為(11.38±1.59)mm,且其得率相對較高(30.83%)。同時,Sp40 洗脫組分具有兩親性和一定程度的疏水性,可能為蛋白或肽類[3]。為驗證其是否為抗菌肽,利用凝膠過濾層析對Sp40 洗脫組分進行進一步分離。
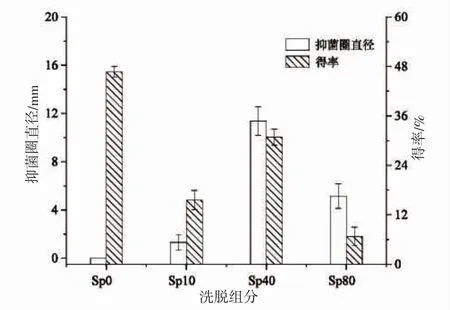
圖1 固相萃取洗脫組分的抑菌活性與得率Fig.1 Antimicrobial activity and yield of solid phase extraction fractions of crude peptides from M.edulis by-products
2.2.2 Sephadex G-25 層析
凝膠過濾層析是活性肽分離純化的簡單常用方法[18]。Sp40 洗脫組分經Sephadex G-25 凝膠過濾層析分離,色譜結果和抑菌活性見圖2。色譜圖中出現4 個洗脫峰,其中峰2(命名為Sp40-2 組分)具有抑菌活性,其抑菌圈直徑為(23.19±3.82)mm,表明Sp40 洗脫組分中抑菌活性成分為多肽。另外,相同劑量下Sp40-2 組分比Sp40 洗脫組分的抑菌活性更強(P<0.05),說明SephadexG-25 對其抗菌肽純化是有效的。為進一步獲得抑菌活性和純度相對較高的抗菌肽,采用半制備RP-HPLC 色譜對Sp40-2 組分進行進一步分離。
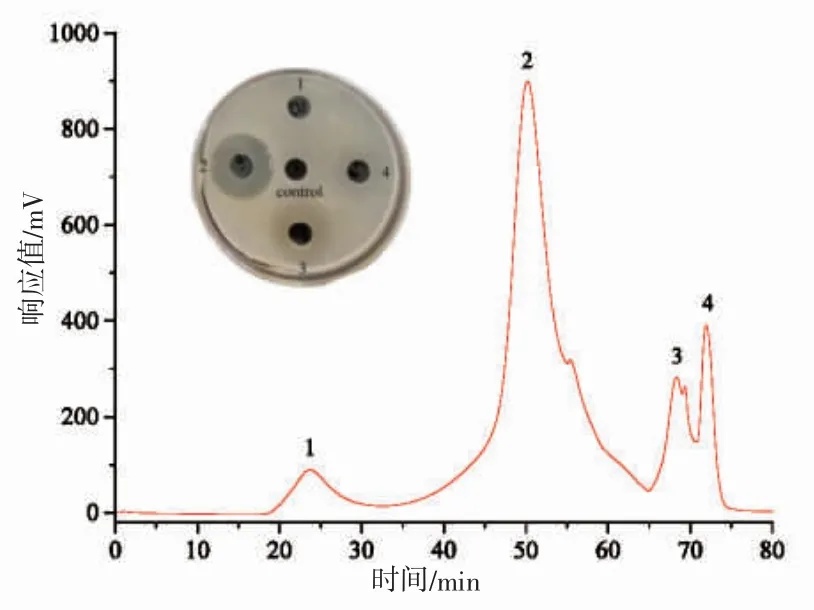
圖2 Sp40 洗脫組分的Sephadex G-25 層析色譜圖及分離峰抑菌活性Fig.2 Sephadex G-25 chromatogram of fraction Sp40 and antimicrobial activity of its separate peaks
2.2.3 半制備RP-HPLC 色譜
圖3 顯示,Sp40-2 組分經半制備RP-HPLC 色譜分離后僅有峰4 和峰段5(分別命名為Sp40-2-4 和Sp40-2-5)具有抑菌活性(抑菌圈直徑分別為(33.26±4.35)mm 和(32.83±5.04)mm),其抑菌活性顯著高于其抗菌肽粗提物(P<0.05)。Sp40-2-4 和Sp40-2-5 的抑菌活性無顯著性差異(P>0.05),表明其抑菌活性不僅與其疏水性有關[19],也與其肽鏈組成與結構有關[20]。盡管Sp40-2-4 組分得率低于Sp40-2-5 組分,但Sp40-2-4 組分純度(圖4)和水溶解性均高于Sp40-2-5 組分。同時,圖4 表明Sp40-2-4 組分為單一色譜峰,其相對分子質量約為1 970.78 Da,與已報道紫貽貝抗菌肽相對分子質量均不同[8-10]。鑒于此,后續試驗著重研究Sp40-2-4 組分的穩定性。
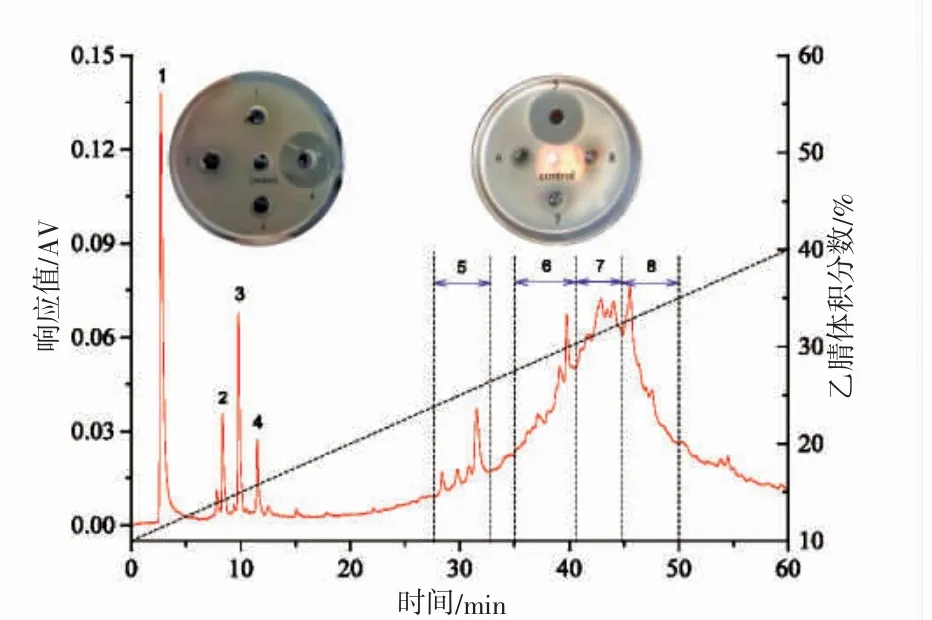
圖3 Sp40-2 組分的半制備RP-HPLC 色譜圖及各分離峰/段的抑菌活性Fig.3 Semi-preparative RP-HPLC chromatogram of fraction Sp40-2 on C18 preparative column and antimicrobial activity of its separate peaks
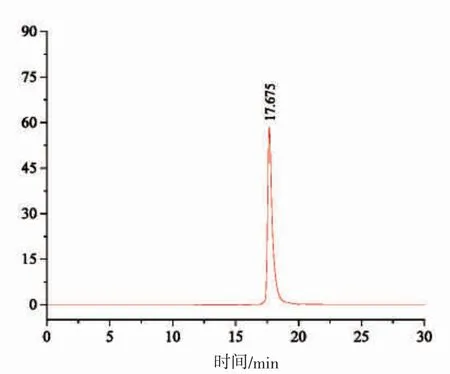
圖4 Sp40-2-4 組分的GPC 色譜圖Fig.4 Gel filtration chromatogram of fraction Sp40-2-4
2.3 Sp40-2-4 組分穩定性研究
2.3.1 溫度
圖5 顯示,隨著處理溫度升高和作用時間延長,Sp40-2-4 組分的抑菌活性殘留率逐漸降低。當溫度≥100 ℃時,隨著作用時間延長,Sp40-2-4 組分的抑菌活性殘留率顯著降低(P<0.05),這與HAUG,et al[4]研究的偏頂蛤乙腈提取物熱穩定性結果相似,抑菌活性降低可能由于高溫破壞了Sp40-2-4 組分的多肽分子結構[21]。李哲等[9]從紫貽貝中分離獲得的抗菌肽經100 ℃加熱20 min 后其抑菌活性基本喪失,而Sp40-2-4 組分抑菌活性殘留率達72.42%,表明Sp40-2-4 組分具有一定的熱穩定性,而且Sp40-2-4組分與其組成與結構不同。
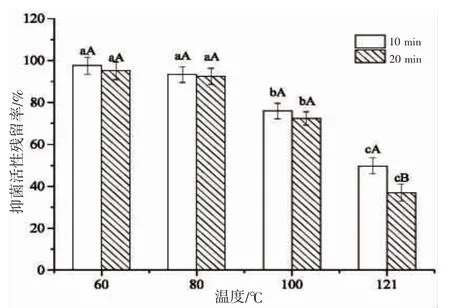
圖5 溫度對Sp40-2-4 組分抑菌活性的影響Fig.5 Effect of temperature on the antimicrobial activity of fraction Sp40-2-4
2.3.2 反復凍融
從圖6 可看出,當凍融次數≤10,Sp40-2-4 組分的抑菌活性殘留率無顯著降低(P>0.05),殘留率為91.42%以上;而凍融次數≥12 時,其抑菌活性殘留率顯著降低(P<0.05),其中反復凍融16 次后其抑菌活性殘留率降至57.49%,這與亞洲飛蝗抗菌肽的反復凍融結果相一致[22]。反復凍融會影響Sp40-2-4 組分多肽的結構和溶解性(離心管底部有沉淀),最終導致其抑菌活性降低。由此可知,當凍融次數≤10 時,Sp40-2-4 組分對反復凍融有一定的耐受性。
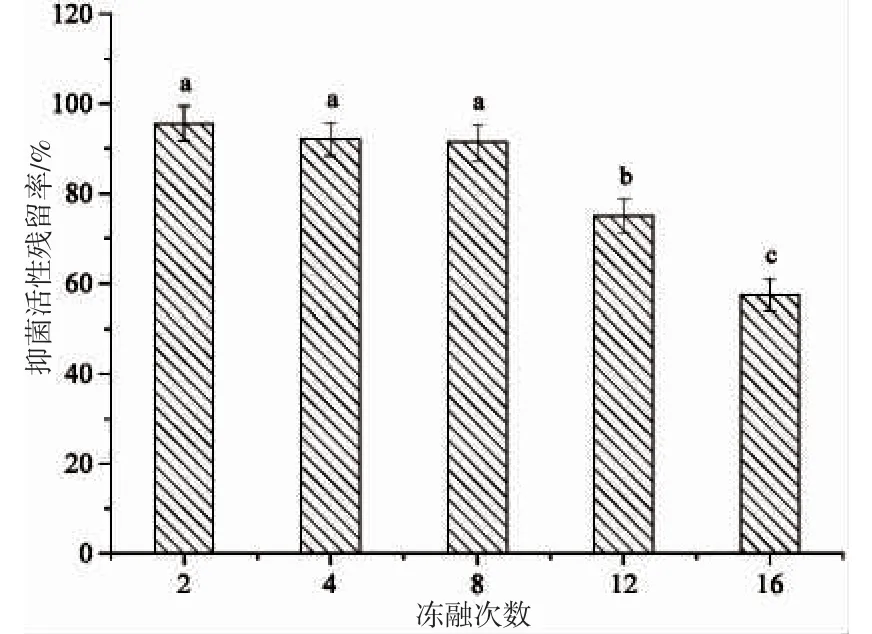
圖6 反復凍融對Sp40-2-4 組分抑菌活性的影響Fig.6 Effect of freeze-thaw cycles on the antimicrobial activity of fraction Sp40-2-4
2.3.3 蛋白酶
圖7 反映了Sp40-2-4 組分經3 種蛋白酶處理后其抑菌活性殘留率的變化情況。經胃蛋白酶處理后,Sp40-2-4 組分抑菌活性殘留率降至75.59%,這表明Sp40-2-4 組分具有一定的抗胃蛋白酶水解能力;而分別經胰蛋白酶、蛋白酶K 處理后,其抑菌活性殘留率分別降至9.91%和8.93%,其抑菌活性基本喪失,表明Sp40-2-4 組分具有胰蛋白酶和蛋白酶K 的酶切位點,易被水解而失去抑菌活性。由此可知,Sp40-2-4組分對胃蛋白酶具有一定的耐受性,而對胰蛋白酶和蛋白酶K 的耐受性較差。
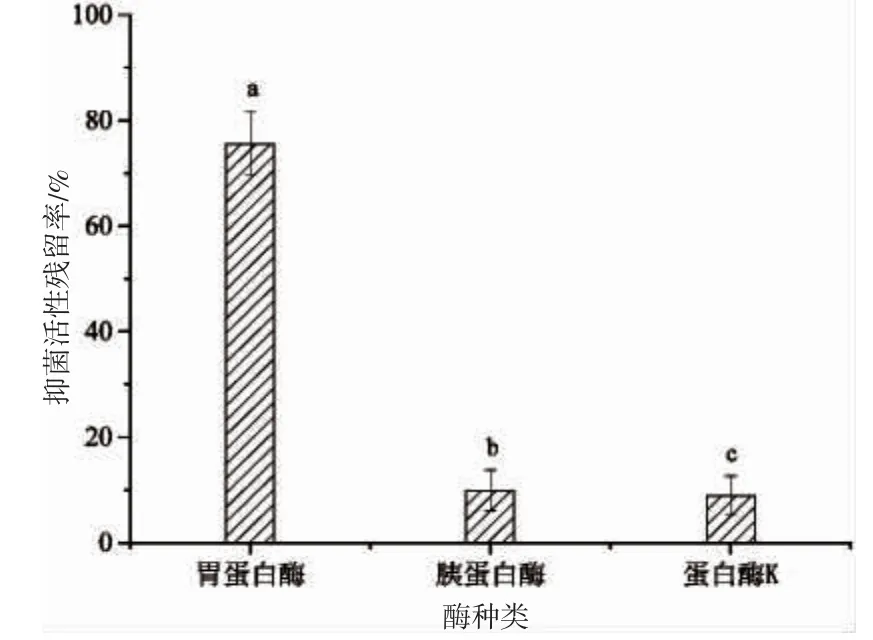
圖7 蛋白酶對Sp40-2-4 組分抑菌活性的影響Fig.7 Effect of protease on the antimicrobial activity of fraction Sp40-2-4
3 結論
本試驗首先分析了紫貽貝加工下腳料粗提抗菌肽的敏感菌,結果顯示,金黃色葡萄球菌為最敏感菌株。在此基礎上,采用固相萃取、Sephadex G-25 和半制備型RP-HPLC 對其抗菌肽進行分離純化,獲得2 個具有較高抑菌活性的組分Sp40-2-4 和Sp40-2-5,其抑菌圈直徑分別為(33.26±4.35)mm 和(32.83±5.04)mm(P>0.05);GPC 顯示Sp40-2-4 組分為單一色譜峰,其相對分子質量約為1 970.78 Da。穩定性試驗表明Sp40-2-4 組分具有一定的熱穩定性(100 ℃、20 min,抑菌活性殘留率72.42%),對反復凍融(凍融次數≤10,抑菌活性殘留率91.42%以上)和胃蛋白酶(抑菌活性殘留率75.59%)有一定的耐受性;而對胰蛋白酶和蛋白酶K耐受性差(抑菌活性殘留率10%以下)。
綜上所述,Sp40-2-4 組分有被用于食品防腐的可能性,但其穩定性還有待提高,可嘗試在分子水平上對其進行改良提高其穩定性。本研究說明在紫貽貝加工下腳料中存在具有抑菌活性的多肽,且經過逐步分離可獲得高抑菌活性的多肽成分,從而為其抗菌肽的開發及相關研究奠定了基礎。

