黃櫨枯萎病菌巢式PCR檢測方法的建立
夏 菲,周江鴻,車少臣,仲 麗,趙正楠
(園林綠地生態功能評價與調控技術北京市重點實驗室,北京市園林科學研究院,北京100102)
黃櫨(Cotinus coggygria)為漆樹科(Anacardiaceae)黃櫨屬(Cotinus)植物,落葉灌木或小喬木,秋季葉色變紅,極具觀賞價值和經濟價值,是北京香山公園秋季紅葉景觀的主要樹種。自上世紀80年代香山發現黃櫨枯萎病以來[1],其發生有逐年加重的趨勢。該病害導致黃櫨葉片萎蔫,同時自葉緣向內發黃,或失水卷曲,但通常不脫落;根、莖的維管束出現壞死,木質部與皮層交界處出現褐色帶線,部分樹杈迅速死亡,發病嚴重時可導致整株長勢衰弱或死亡。
黃櫨枯萎病的病原菌為大麗輪枝菌(Verticillium dahliae),其無性世代屬于半知菌亞門(Deuteromycotina)絲孢綱(Hyphomycetes)輪枝孢屬(Verticillium),菌落表面常形成黑色微菌核,其溫度適應范圍較寬,具有耐高溫特性[2]。大麗輪枝菌為典型土壤習居菌,土壤中的微菌核萌發產生的菌絲通過黃櫨根系表面的傷口侵入維管束,然后產生分生孢子沿維管束隨蒸騰流向上擴展[3]。大麗輪枝菌在寄主體內擴展緩慢、潛伏期長,當葉片出現明顯萎蔫癥狀時,其根部及莖干內已經存在大量病原菌[4],使其易錯過最佳防治期,造成病害大面積暴發[5]。傳統的病原物分離、鑒定技術費時費力,難以對大量苗木進行快速檢測,因此建立快速、高靈敏度的黃櫨枯萎病菌檢測技術對黃櫨枯萎病的防治具有重要意義。
基于PCR技術的檢測方法具有快速、靈敏等特點,已廣泛用于病害的診斷和鑒定。朱有勇等[6]根據棉花黃萎病菌(V.dahliae)核糖體基因ITS區段的堿基編碼序列,設計了一對26 bp的PCR特異性擴增引物P1∕P2,用于棉花黃萎病菌的分子鑒定和分子監測。但常規PCR靈敏度較低,不適合進行黃櫨枯萎病菌的快速檢測;相比之下,巢式PCR靈敏性更高。本研究基于大麗輪枝菌特異性引物P1∕P2擴增出的片段序列設計巢式PCR引物,以期為黃櫨枯萎病早期診斷和快速檢測提供有效方法。
1 材料與方法
1.1 供試菌株
大麗輪枝菌:2014年5月于北京香山公園采集黃櫨枯萎病感病枝條,采用常規組織分離法分離培養病原菌,經鑒定為大麗輪枝菌,低溫保存備用。海棠腐爛病菌(Valsa ceratosperma)、尖孢鐮刀菌(Fusarium oxysporum)、立枯絲核菌(Rhizoctonia solani)和莖點霉菌(Phoma sp.)用于檢測引物特異性,均由北京市園林科學研究院植保所提供。
1.2 供試引物
基于大麗輪枝菌ITS序列設計特異性引物P1(5′-CATCAGTCTCTCTGTTTATACCAACG-3′)∕P2(5′-CGATGCGAGCTGTAACTACTACGCAA-3′)[6],用于大麗輪枝菌常規PCR和巢式PCR第一輪擴增。
1.3 黃櫨枯萎病菌及植物樣品基因組DNA的提取
將供試黃櫨枯萎病菌在PDA培養基培養10 d后,刮取菌絲,采用Ezup柱式真菌基因組DNA抽提試劑盒(B518259)[生工生物工程(上海)股份有限公司]提取總DNA。采集植物葉片組織,采用新型植物基因組DNA提取試劑盒(DP320)[天根生化科技(北京)有限公司]提取基因組DNA。
1.4 黃櫨枯萎病菌巢式PCR檢測體系的建立
1.4.1 引物設計及特異性篩選
以黃櫨枯萎病菌基因組DNA為模板,利用大麗輪枝菌ITS序列特異性引物P1∕P2,在C1000 Touch梯度PCR儀(Bio-Rad,美國)上進行擴增,將其產物與載體連接,并轉化大腸桿菌,送生工生物工程(上海)股份有限公司進行測序。根據其堿基序列,使用Primer3 Input(v.0.4.0)軟件在線設計3對引物(表1),分別進行PCR擴增,篩選最合適的特異性引物。
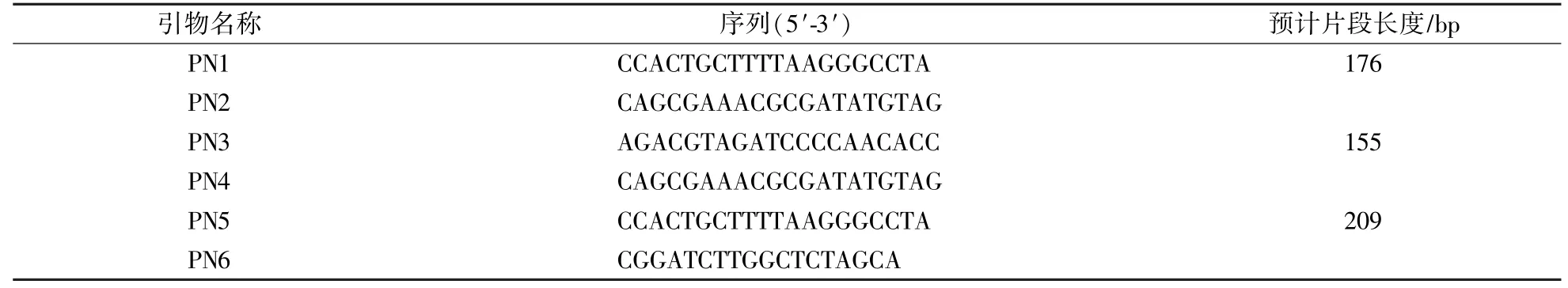
表1 供試引物Table 1 Primers used in this study
PCR反應體系(25μL):10×PCR buffer(含Mg2+)2.5μL,dNTP 0.5μL(10 mmol∕L),上下游引物各1μL(10μmol∕L),Taq DNA聚合酶0.2μL(5 U),DNA 1μL(30 ng∕μL),加ddH2O至終體積25μL。
PCR程序:95℃預變性5 min;95℃變性30 s,Tm℃退火45 s,72℃延伸40 s,30個循環;72℃延伸7 min。取5μL PCR產物于含GelRed核酸染料(Biotium,美國)的1.0%瓊脂糖凝膠中電泳20 min(150 V),Quantum CX5凝膠成像系統(Vilber,法國)觀察并拍照。
以海棠腐爛病菌、尖孢鐮刀菌、立枯絲核菌、莖點霉菌和黃櫨枯萎病菌基因組DNA為模板,使用設計的引物分別進行PCR擴增,以ddH2O為陰性對照,檢測3對引物的可擴增性和產物特異性,選取只能在黃櫨枯萎病菌DNA中擴增出單一且較亮條帶的引物。
1.4.2 擴增條件優化
第一輪擴增引物選用朱有勇等[6]設計的特異性引物P1∕P2,設置61℃、58℃、55℃和52℃四個退火溫度,對其擴增產物進行凝膠電泳檢測。第二輪擴增以第一輪擴增產物為模板,PN1∕PN2為引物,設置61℃、58℃、55℃和52℃四個退火溫度,篩選引物最優退火溫度。
1.4.3 PCR檢測靈敏度
使用N50 Touch超微量分光光度計(Implen,德國)測定黃櫨枯萎病菌DNA濃度,采用10倍梯度稀釋,再將不同稀釋濃度的DNA作為模板,分別用常規PCR和巢式PCR進行擴增,驗證檢測方法的靈敏度。
1.5 黃櫨樣品的巢式PCR檢測
以發病黃櫨上表現黃化和萎蔫癥狀的葉片為顯癥材料,發病植株正常枝條上的葉片和發病區域表現正常植株的葉片為未顯癥材料。在試驗地采集8份樣品,包括:發病區域表現正常的植株葉片、發病植株未顯癥葉片、健康黃櫨葉片(陰性對照)、顯癥黃櫨葉片,各2份,使用P1∕P2和PN1∕PN2引物,按1.4.2篩選出的擴增條件,進行巢式PCR檢測。用熒光定量PCR方法檢測上述DNA樣品中目的基因拷貝數,得到各個黃櫨葉片樣品中所攜帶的枯萎病菌絕對數量。
2 結果與分析
2.1 引物的可擴增性及產物特異性篩選
以黃櫨枯萎病菌基因組DNA為模板,利用設計的3對引物分別進行PCR擴增,對其可擴增性進行篩選。凝膠電泳結果顯示,引物PN1∕PN2能擴增出片段長度為176 bp的單一條帶(圖1),非以黃櫨枯萎病菌基因組DNA為模板的泳道未擴增出條帶(圖2)。這表明,PN1∕PN2可以作為檢測黃櫨枯萎病菌的特異性引物。
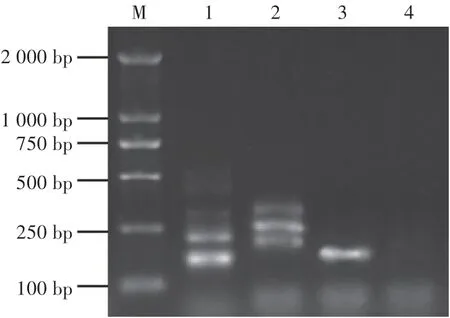
圖1 設計引物的可擴增性篩選Fig.1 Screening for amplification effect of the designed primers
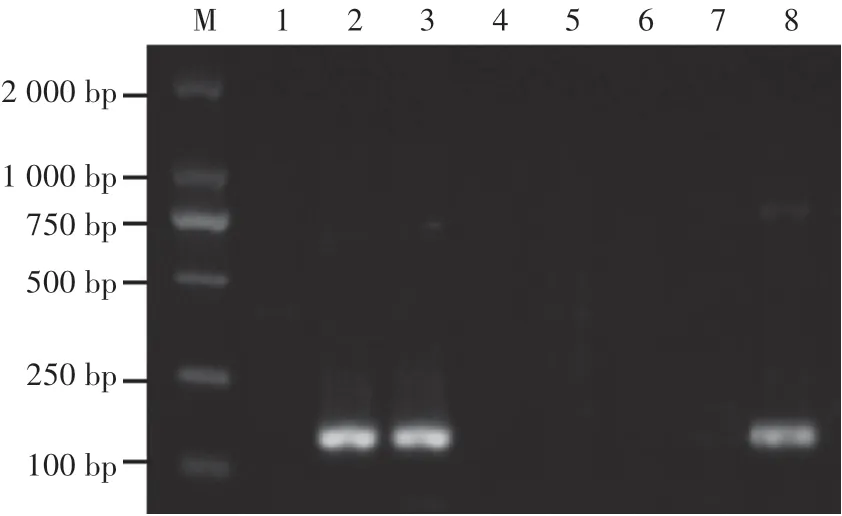
圖2 引物PN1∕PN2擴增產物特異性分析Fig.2 Specificity analysis for primers PN1∕PN2
2.2 擴增條件優化
PCR擴增產物的凝膠電泳結果如圖3所示:P1∕P2引物的退火溫度為58℃時擴增條帶最清晰,第二輪擴增使用的是引物PN1∕PN2,在退火溫度為55℃時條帶最為清晰。
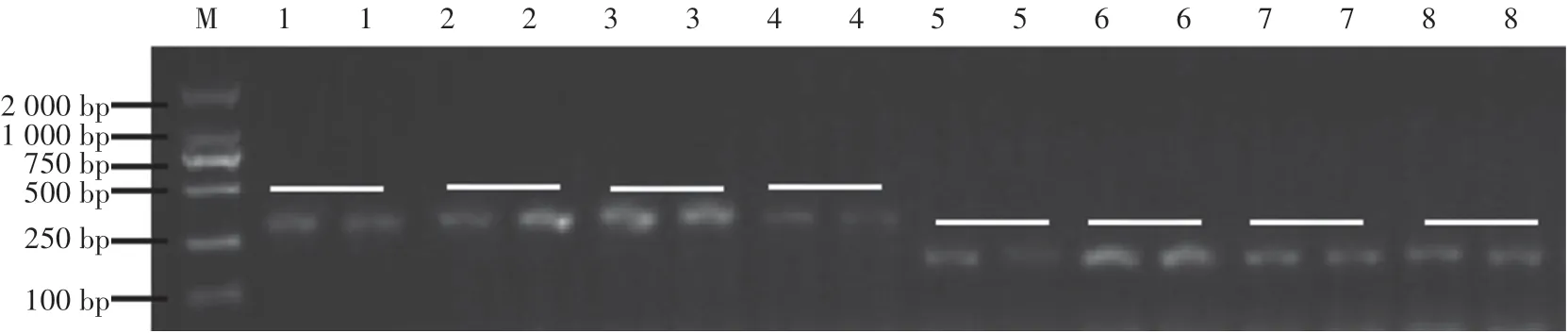
圖3 PCR擴增體系優化Fig.3 Optimized single PCR reaction system
2.3 巢式PCR靈敏度分析
黃櫨枯萎病菌DNA初始濃度為23.25 ng∕μL,10倍梯度稀釋后分別作為模板,使用PN1∕PN2進行普通PCR擴增(圖4A),使用P1∕P2和PN1∕PN2進行巢式PCR擴增(圖4B)。結果表明:引物PN1∕PN2進行普通PCR擴增最低可檢測出來的黃櫨枯萎病菌DNA濃度為2.325×10-2ng∕μL,PN1∕PN2進行巢式PCR擴增最低可檢測出來的DNA濃度為2.325×10-4ng∕μL,巢式PCR的靈敏度是普通PCR的100倍。
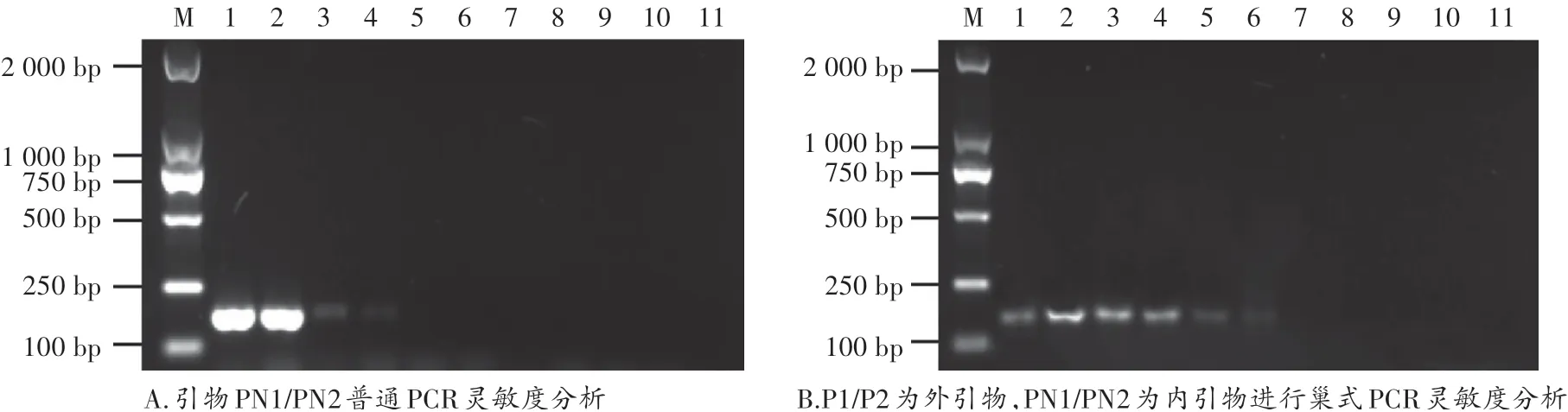
圖4 普通PCR和巢式PCR擴增靈敏度分析Fig.4 Sensitivity analysis for ordinary PCR and nested PCR
2.4 黃櫨樣品檢測
以引物P1∕P2進行的第一輪PCR擴增,只有顯癥黃櫨葉片的2份樣品擴增出324 bp的特異性片段,其余樣品中均未擴增出條帶(圖5A);以引物PN1∕PN2進行的第二輪PCR擴增,除了健康黃櫨葉片樣品中未擴增出條帶,其他樣品中均擴增出176 bp的特異性片段(圖5B),2份顯癥黃櫨葉片和4份未顯癥黃櫨葉片樣品中都檢測出枯萎病菌。實時熒光定量PCR檢測結果表明,發病區域表現正常植株的葉片、發病植株未顯癥葉片、顯癥黃櫨葉片中大麗輪枝菌的絕對數量分別為25.41 copies∕g、1.35×102copies∕g、7.02×104copies∕g,在健康黃櫨葉片中未能檢測到大麗輪枝菌的存在。可見,在未顯癥黃櫨葉片中也存在枯萎病菌,其含量較低,利用本研究建立的巢式PCR檢測體系均能擴增出較清晰片段,可用于黃櫨枯萎病的早期診斷。

圖5 黃櫨葉片中枯萎病菌的巢式PCR檢測Fig.5 Detection of V.dahliae in leaves of C.coggygria by Nested PCR
3 討論
黃櫨枯萎病是系統性侵染病害,嚴重影響黃櫨的觀賞價值、生態價值及經濟價值。目前,仍未有效控制該病害的發生[7-8]。感染樹木并引起枯萎病的輪枝菌多數為大麗輪枝菌,其已知寄主植物超過200種,許多園林植物及林下雜草都是其無癥狀帶菌體,這些植物雖然體內含有大麗輪枝菌,但本身并不表現任何癥狀,是黃櫨枯萎病菌傳播的重要介體[9-10]。
本研究構建的巢式PCR檢測方法僅在感染了大麗輪枝菌的黃櫨樣品中擴增到特異性目的片段,保證了PCR擴增的特異性。與常規PCR相比,該巢式PCR檢測方法經過兩輪PCR反應,其靈敏度是普通PCR的100倍,表明此巢式PCR檢測體系檢測結果更精準,可用于黃櫨枯萎病的早期診斷。
大麗輪枝菌主要以微菌核形式存活于土壤中,在外部環境適宜的條件下,微菌核可迅速萌發并成為病害初侵染源[11],因此對土壤中微菌核的監測預警也十分必要。本研究構建的巢式PCR檢測方法同樣可用于土壤中大麗輪枝菌的定性檢測,但由于土壤中含有較多的腐植酸、酚類化合物、不明沉淀物和菌體裂解成分等物質,如何提取高質量的DNA成為土壤中病原菌檢測的難點,接下來將持續進行相關研究。

