持久性有機污染物多溴聯苯醚的生殖毒性研究進展
楊俊花,孫詩謠*,孫玲偉,凌阿茹,饒欽雄,趙志輝**
(1上海市農業科學院農產品質量標準與檢測技術研究所,上海201403;2上海市農業科學院畜牧獸醫研究所,上海201106)
多溴聯苯醚(Polybrominated diphenyl ethers,PBDEs)是一類含溴芳香族化合物,共209種同系物,包括四溴聯苯醚(BDE-47)、五溴聯苯醚(BDE-99)、六溴聯苯醚(BDE-153)、八溴聯苯醚(BDE-183)和十溴聯苯醚(BDE-209)等[1-2]。PBDEs具有阻燃、熱穩定、持久蓄積和難降解等特性,因價格低廉,在工業生產中常被用作阻燃劑或絕熱材料添加到塑料制品、紡織品、電子設備和密封黏膠等產品中,以優化產品性能[3-4]。
自20世紀80年代以來,隨著電子產品的使用頻率急劇上升,PBDEs在帶來經濟效益的同時也引起了嚴重的環境污染和生物安全等問題。資料顯示,在香港附近海域、珠江入海口等區域均檢出PBDEs污染,而流經中國最大規模電子垃圾拆卸地的廣東東江段PBDEs含量更高,為珠江入海口的2倍[5-6]。在內陸水域,中國淮河流域中PBDEs水平急劇上升,電子垃圾拆解地汕頭紅樹林濕地也檢測出PBDEs深度污染,其中BDE-99和BDE-209可能已對汕頭紅樹林沉積物的生態環境產生負面影響[7]。PBDEs極難降解,其殘積顆粒懸浮、沉積于空氣、土壤及河流海洋中,經過遷移作用易富集于生物體內,最終通過食物鏈進入動物或人體[8-9]。可見,PBDEs的污染已經對生態環境安全構成了巨大的威脅,其不同的暴露途徑對人類健康也產生很大影響。
近年來,PBDEs除在空氣、土壤和水資源等環境介質中被檢出外,在人體的血液、頭發、母乳和臍帶血中也被檢出[10-12]。電子垃圾拆解區為重點暴露區域,調查發現,PBDEs宮內暴露會對胎兒生長發育帶來不利影響,其中BDE-47、BDE-99及BDE-153檢出率達100%,BDE-28、BDE-100、BDE-154、BDE-183和BDE-209在各試驗組中的檢出率均高于對照組[13]。對孕婦進行是否了解日常生活化學用品信息問卷調查發現,多數人認為普及PBDEs等環境污染物危害知識是醫生或政府的職責,對其潛在生殖危害和預防意識非常薄弱[14-15]。因此,明確PBDEs的生殖毒性效應對于提升民眾對此環境污染物的關注度和保護自身及后代健康生長發育具有重要意義。目前,關于PBDEs毒性效應研究,主要集中在神經發育毒性、內分泌干擾毒性、免疫毒性和致癌效應等,但有關生殖毒性特別是詳細的毒性機制研究報道有限。鑒此,基于已有材料對PBDEs的生殖毒性研究予以概述,重點關注PBDEs對睪丸、精子、子宮、卵巢、胚胎、內分泌等生殖發育毒性及誘導生殖細胞凋亡等毒性機制方面。
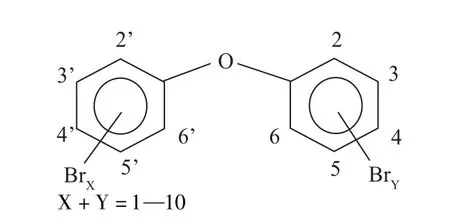
圖1 多溴聯苯醚的分子結構式Fig.1 Molecular structure of polybrominated diphenyl ethers(PBDEs)
1 PBDEs簡介
PBDEs化學通式為C12H(0—9)Br(10—1)O,分子結構如圖1所示,沸點310—425℃,熔點290—306℃,是一類含溴芳香族化合物,常被添加到電子、紡織、塑料和建筑材料等產品中作為阻燃劑。目前,已知共有209種同系物,工業上常見的有四溴聯苯醚(BDE-47)、五溴聯苯醚(BDE-99)、六溴聯苯醚(BDE-153)、八溴聯苯醚(BDE-183)和十溴聯苯醚(BDE-209)。其中BDE-47的毒性最強,BDE-209的毒性最弱[16]。BDE-47、BDE-99、BDE-153、BDE-209等9種PBDEs已被《斯德哥爾摩公約》列為持久性有機污染物,BDE-209被我國原環境保護部、工業和信息化部、衛生計生委公布的《優先控制化學品名錄(第一批)》列為優先控制化學品[17-18],目前僅有BDE-209被批準使用。PBDEs具有親脂性高、疏水性強的特質,可以蒸發于空氣,沉積于土壤和水體中,極易通過食物鏈在高等生物體內富集,產生不同的毒性效應[19-20]。同時,PBDEs在人和動物的肝臟、腸道等器官內可通過脫溴或羥基化進行降解。有研究表明,PBDEs在生物體內能代謝生成羥基化(HO-PBDEs)和甲氧基化(MeO-PBDEs)產物,而經脫溴或羥基化后,可產生更強的毒性作用[21]。
2 PBDEs的生殖毒性
近年來,中國的不孕不育率有逐漸上升趨勢,每年的不孕癥發生率已達到15%—20%,而環境因素可能是威脅生殖健康的元兇[22]。調查發現,PBDEs的暴露水平可以影響被暴露群體的睪丸功能、精子活率、受孕率和母系及子代健康水平等[7]。探討PBDEs的生殖毒性對預防生殖水平下降具有重要意義。
2.1 PBDEs的雄性生殖毒性
2.1.1 PBDEs對睪丸的毒性效應
睪丸是雄性生殖器的重要組成部分,在合成精子和分泌雄性激素過程中起重要作用,同時也是PBDEs生殖毒性的主要靶器官。有研究指出,BDE-47可使雄性小鼠睪丸組織產生細胞碎片和附睪間質炎性細胞浸潤[23]。成年大鼠暴露不同劑量的BDE-209持續4周后會導致附睪質量下降,最高可下降22.5%,精囊腺質量顯著增加[24]。PBDEs還可誘導子代生殖功能障礙,Sarkar等[25]觀察到哺乳期母鼠分別暴露500 mg∕kg bw和700 mg∕kg bw BDE-209后,其子代小鼠睪丸和精囊腺相對質量顯著下降,生精細胞變薄,生精管直徑減小,小鼠附睪精子數量顯著減少。深入研究發現,一方面BDE-209可以破壞睪丸組織的血睪屏障,通過上調睪丸雄激素受體α(androgen receptor,ARα)和下調血睪屏障相關蛋白claudin-11、occludin等的表達水平對小鼠產生生殖毒性[26]。另一方面,BDE-209干擾MAPKs通路相關蛋白p38、JNK的表達,即p-p38∕p38和p-JNK∕JNK比值上升,破壞血睪屏障緊密連接蛋白claudin-11的表達[27]。由此可見,PBDEs能影響睪丸形態、誘導炎癥發生,其作用機制可能是PBDEs抑制睪丸組織相關連接蛋白的表達從而損傷血睪屏障。
2.1.2 PBDEs對精子的毒性效應
精子是由睪丸組織產生的生殖細胞,在動物有性生殖過程中發揮重要作用,精子畸形和活力低會直接影響雄性動物的生殖能力和生產價值。在過去的半個世紀里,男性精液中精子質量和數目顯著下降,環境中PBDEs污染已經被認為是男性不育的主要原因,且已有研究報道,人類血清中PBDEs水平與精子數量和活力呈負相關[28]。周義軍[29]分別用2 mg∕kg、10 mg∕kg及50 mg∕kg的BDE-209染毒大鼠,發現其生精細胞脫落,管腔堵塞,精子畸形率增加,出現香蕉型和無鉤型等病理現象。Sarkar等[30]發現,與對照組相比,BDE-209處理的小鼠,精子數量和存活率顯著降低,而BDE-47處理也可以使大鼠附睪精子數減少[31]。除此之外,Chen等[32]發現BDE-209可使水生生物斑馬魚的精子密度和雄∕雌性別比例下降,并且F1代斑馬魚也出現受精率降低和孵化延遲現象。可見,PBDEs可以誘發雄性動物的精子畸形,抑制精子活力,影響雄性動物的生殖功能。
2.2 PBDEs的雌性生殖毒性
2.2.1 PBDEs對子宮的毒性效應
子宮是雌性動物生育的主要生殖器官,其結構和功能的完整性是評估PBDEs對雌性生殖毒性的重要指標。有數據顯示,在長達2年的隔天800 mg∕kg bw BDE-209給藥暴露下,C57BL∕6小鼠子宮內檢測出PBDEs殘留,并且子宮絕對質量增加,表明暴露PBDEs可能會影響雌性動物子宮的結構和功能[33]。Dang等[34]發現200 mg∕kg bw的BDE-47給藥24 h后能夠使大鼠子宮濕重增加,而持續28 d給藥450μg∕kg bw BDE-47后小鼠子宮內膜面積和肌層面積比值增加[35]。因此推斷PBDEs對子宮存在毒性效應。但目前有關PBDEs對雌性子宮的毒性影響研究極少,缺乏相應的靶向機制研究,有待進一步深入研究與論證。
2.2.2 PBDEs對卵巢的毒性效應
卵巢位于盆腔內,是產生卵母細胞和雌性激素的重要器官,研究PBDEs對其結構與功能的影響,對揭示PBDEs的雌性生殖毒性具有非常重要的意義。近年來,在中國體外受精婦女卵泡液中發現有PBDEs生物蓄積的現象,其中BDE-99為主要成分[36]。西班牙一項有關婦女血清中PBDEs濃度與生殖能力關系的調查研究顯示,PBDEs濃度與婦女懷孕期延長有關,可顯著降低婦女生育能力[37]。在水生動物試驗中,14 mg∕L的BDE-47可使褶皺臂尾輪蟲休眠卵的產量顯著增加,30 mg∕L的BDE-209也呈現類似的結果,表明BDE-47和BDE-209會干擾褶皺臂尾輪蟲的有性生殖[38]。此外,BDE-47可使雌性大鼠卵巢芳香烴受體(aryl hydrocarbon receptor,AhR)mRNA和細胞色素P450家族蛋白(cytochrome P450 1A1,CYP1A1)的表達量較對照組顯著升高[39],提示BDE-47可通過上調AhR和CYP1A1的表達增強對大鼠卵巢的毒性效應。可見,PBDEs對雌性動物卵巢組織的毒性作用主要源于其在組織中的蓄積,通過影響卵泡發育、干擾卵巢激素分泌及激素受體表達等因素產生相應的毒性效應。
2.2.3 PBDEs對胚胎的毒性效應
PBDEs具有很強的生物蓄積性,通過生物鏈的傳遞,其毒性效應極有可能擴大和遷移,近年來國內外也有報道PBDEs通過母體遷移,進而產生相應的胚胎毒性。母雞-雞蛋-育雛雞過程中,PBDEs濃度遞級升高[40]。斑馬魚染毒BDE-47后,其胚胎活性氧(reactive oxygen species,ROS)顯著增高,并且產生不同程度氧化應激毒性[41]。同時BDE-47可抑制斑馬魚胚胎血管形成與生長[42],而斑馬魚染毒BDE-209后胚胎畸形率增加[43],BDE-99使大鼠胚胎活性氧表達水平上調,且胎兒骨骼發育遲緩且不良[44]。另外,向體外培養的小鼠卵母細胞中分別加入10 pg∕mL、20 pg∕mL、40 pg∕mL的BDE-209,卵母細胞的體外受精率降低,受精卵的早期發育延緩,并呈現顯著的劑量效應[45]。李秋華等[46]分別采用100 mg∕kg、300 mg∕kg、500 mg∕kg的BDE-209染毒昆明小鼠,其體外受精的獲卵率減少、受精率降低,嚴重干擾了小鼠的胚胎發育。可見,PBDEs具有較強的體內蓄積和母體遷移轉化能力,不僅對母體存在威脅,同時會影響受精率及受精卵的生長發育,導致胎兒畸形及子代生殖系統發育異常等。
3 PBDEs引起生殖毒性的作用機制
3.1 PBDEs對生殖內分泌的影響
已有研究表明,PBDEs會干擾生殖細胞相關激素的分泌,與PBDEs的類雌激素結構密切相關,可作為拮抗劑或促進劑與雄激素、孕酮和雌激素受體結合,從而造成機體內分泌紊亂[47]。王漢永等[48]用BDE-209染毒青春期小鼠發現,隨著BDE-209濃度的增加,小鼠血清中環磷酸腺苷(cyclic adenosine monophosphate,cAMP)和睪酮濃度呈下將趨勢,睪丸連接蛋白(connexin-34,CX-34)表達下降,揭示BDE-209是通過干擾cAMP途徑,抑制睪酮合成而產生生殖毒性效應。也有研究指出,PBDEs可競爭性地參與雌激素分泌,破壞雌性生殖系統平衡。如BDE-47、BDE-99、BDE-100和BDE-209等PBDEs混合物可促進豬卵巢顆粒細胞睪酮分泌[49]。BDE-47不僅可以提高蛤蜊睪酮∕雌二醇的比值,干擾生殖系統內分泌穩態[50],而且可以促進卵巢顆粒細胞與肥胖相關的脂聯素分泌[51]。Karpeta等[52]也發現,BDE-47的代謝產物5-OH-BDE-47和6-OH-BDE-47可以通過激活芳香化酶(cytochrome P450 19,CYP19)的表達來刺激卵巢中雌二醇分泌。由此可見,PBDEs及其代謝產物會通過介導生殖激素的分泌而影響生殖系統,這可能是PBDEs產生毒性效應的途徑之一。
3.2 PBDEs引起氧化應激
氧化應激是機體抵御外來侵擾的關鍵防御體系,國內外多項研究表明,PBDEs的暴露會直接影響機體氧化應激系統的穩態。SPF級雄性SD大鼠分別染毒250 mg∕kg、500 mg∕kg和1 000 mg∕kg的BDE-209,大鼠睪丸組織一氧化氮(nitric oxide,NO)和一氧化氮合酶(nitric oxide synthase,NOS)水平升高,γ-谷氨酰轉移酶(γ-Glutamyltransferase,γ-GT)活性降低,表明BDE-209能激發睪丸組織的氧化應激從而導致精子質量和數量降低[53]。Sarkar等[54]用不同濃度的BDE-209作用于哺乳期母鼠后,在其子代的睪丸和附睪組織中也取得了相似的結果,即氧化應激標志物血紅素加氧酶-1(heme oxygenase-1,HO-1)水平升高,暗示PBDEs具有傳代毒性效應。同時,雄性小鼠暴露BDE-209后,精子線粒體膜電位(mitochondrial membrane potential,MMP)下降,超氧陰離子(O2-)生成,H2O2濃度上升[55],血清睪酮水平下降,精子頭部畸形率增加[56]。因此,氧化應激可能是激發PBDEs生殖毒性機制的關鍵步驟,但其具體機制仍有待進一步深入分析。
3.3 PBDEs誘導細胞凋亡
細胞凋亡是指為維持內環境穩定,由基因調控的細胞自主性有序死亡,其在保證個體正常生長發育和維持生理穩態過程中發揮著不可或缺的作用[57]。有報道指出,PBDEs可以誘導細胞凋亡的發生,如PBDEs暴露對睪丸支持細胞具有明顯的毒性,可激發支持細胞的氧化應激進而誘導細胞凋亡發生[29],BDE-47可誘導秀麗隱桿線蟲發生氧化應激而導致生殖細胞凋亡[58],表明PBDEs誘導生殖細胞氧化應激進而引起細胞凋亡可能是其產生生殖毒性的重要機制之一。另外,PBDEs還可能通過線粒體途徑誘導生殖細胞凋亡,如BDE-47可通過降低線粒體融合蛋白(mitofusin1,MFN1)的基因表達而抑制人胎盤絨膜癌細胞(BeWo)增殖[59]。也可通過抑制線粒體蛋白(Atp synthase subunitβ,Atp5b,ubiquinol-cytochrome-c reductase complex coreprotein1,Uqcrc1)以及抗凋亡B淋巴細胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)表達,促使小鼠精原細胞線粒體腫脹及空泡化,進而誘導線粒體膜電位和ATP水平降低,線粒體功能受損,最終導致精原細胞凋亡[60-61]。此外,內質網應激也是PBDEs誘導細胞凋亡的重要途徑之一,Zhou等[62]以虹鱒魚性腺細胞(RTG-2)為模型染毒BDE-47,發現處理組細胞內質網應激凋亡通路主要因子葡萄糖調節蛋白78(glucose regulated protein78,GRP78)的表達上調,凋亡蛋白caspase-12等表達也上調。在體內試驗過程中,低濃度BDE-47暴露時,SD大鼠卵巢內質網自噬被激活,通過清除錯誤蛋白進行自我保護,而高濃度BDE-47侵染時,內質網過度自噬并激發凋亡蛋白caspase-3,導致卵巢功能損傷及細胞凋亡[63]。綜上所述,PBDEs可通過氧化應激、線粒體或內質網應激等途徑誘導生殖相關細胞凋亡的發生,這可能是PBDEs產生生殖毒性效應的主要作用機制。
4 結論與展望
隨著對PBDEs生殖毒性研究的深入,人們認識到被用作阻燃劑添加于建筑材料及商業產品中的PBDEs,其毒性、難以降解和持久生物蓄積等特性,以及通過空氣、水和物種跨區域的遷移和沉積特征,與不孕不育癥密切相關,可對人類和動物的生殖健康和子代健康形成潛在的風險[64-65]。有限的資料表明,PBDEs不僅可以造成雄性動物的生殖毒性,還會導致子宮、卵巢和胚胎毒性作用,其作用機制可能與PBDEs干擾生殖內分泌、引發氧化應激和誘導細胞凋亡等有關。除此之外,還存在一些新的問題有待解決:(1)PBDEs生殖毒性的關鍵靶標器官、靶組織、生物標志物、作用信號通路及調控機制等。(2)已有的生殖毒性研究主要集中于生殖細胞和實驗動物,食物源性動物豬、家禽等作為PBDEs的傳遞載體,是否也存在相應的毒性效應。(3)PBDEs種類繁多,目前的生殖毒性效應研究多見于單一毒性,聯合毒性研究缺乏,特別是PBDEs在生物體內還存在脫溴和羥基化代謝,多種PBDEs原型聯合或與其代謝物聯合的互作效應、分子機制等。(4)對于抵御PBDEs的毒性作用仍無可靠的解決方案,有待開發有效的防御機制。這些研究不僅能為全面解析PBDEs生殖毒性作用提供參考,也可為準確評估PBDEs的生殖風險,提出關鍵有效的防控措施提供理論支持。

