順鉑前藥及雙載藥聚乙二醇化脂質體的制備、表征與體外抗腫瘤研究
王詠麒,朱嬌嬌,儲曉婷,張亞超,桂雙英,2,李真寶,2*(.安徽中醫藥大學藥學院,合肥 23002;2.安徽省中醫藥科學院藥物制劑研究所,合肥 23002)
順鉑(cisplatin,Pt)作為抗腫瘤藥物在各種惡性腫瘤的治療中發揮至關重要的作用,但因耐藥和嚴重的劑量依賴性,其臨床應用受到極大限制[1-2]。研究顯示,順鉑的耐藥機制源于多因素的細胞改變,包括順鉑的細胞積累減少、含硫醇分子[如抗壞血酸、半胱氨酸、谷胱甘肽(GSH)等]對順鉑的解毒、DNA修復水平升高和自噬誘導等,這些因素導致順鉑對腫瘤細胞的DNA損傷減少,導致治療效果大大降低[1]。
前藥策略是通過化學結構修飾來改善化療藥物的不良性質[3],四價順鉑前藥[Pt(Ⅳ)]具有八面體結構,需到達還原環境后被激活釋放二價Pt(Ⅱ)片段方可發揮藥效[4-6]。與正常細胞相比,腫瘤細胞過量產生GSH(2~10 mmol·L-1),導致腫瘤細胞呈高還原性微環境,近年來研究表明,這些高濃度的GSH能使鉑類藥物失活[7-8]。下調或消耗胞內的GSH,能夠克服順鉑耐藥,提高抗腫瘤效果[6,9]。L-丁硫氨酸-亞砜亞胺(L-BSO)是GSH合成過程中的限速酶γ-谷氨酰半胱氨酸合成酶(GCL)的抑制劑,能通過抑制GSH的合成,增加腫瘤細胞對順鉑的敏感性,進而提高治療效果[10-11]。
近年來,納米技術在藥物傳遞領域有著廣泛的研究,主要是通過制劑學方法延長藥物的體內循環時間,進而通過高滲透長滯留(EPR)效應提高藥物在腫瘤部位的蓄積,以達到增強抗腫瘤效果的目的[12-13]。其中,聚乙二醇(PEG)化脂質體具有長循環、被動靶向和增加藥物穩定性的特點[14],例如阿霉素脂質體(Doxil?)已被應用于臨床實踐中[15]。為了提高順鉑抗腫瘤效果,本課題構建雙載藥PEG化脂質體共遞送水溶性的Pt(Ⅳ)前藥和L-BSO。
1 儀器與試藥
1.1 儀器
EX125ZH十萬分之一電子天平(常州奧豪斯儀器有限公司);ME204E/02萬分之一電子天平(上海梅特勒-托利多國際貿易有限公司);DF-101S集熱式恒溫加熱磁力攪拌器(南京沃中儀器設備有限公司);R201C旋轉蒸發器(鞏義市英峪高科儀器廠);LF-1脂質體擠出器(加拿大AVESTIN);Zetasizer 3000 HS(英國Malven);JEOL-2010高分辨透射電子顯微鏡(日本電子);DMi1倒置熒光顯微鏡(德國Leica);318C+全自動酶標儀(上海贛閩分析儀器有限公司);HF90 CO2細胞培養箱(上海力康生物醫療科技控股有限公司);DSX-18L高壓蒸汽滅菌鍋(上海申安醫療器械廠);L4-6K臺式低速離心機(湖南可成儀器設備有限公司);Specord S600紫外-可見分光光度計(德國Analytik Jena AG)。
1.2 試藥
順鉑(純度:95%,山東鉑源藥業有限公司);丁二酸酐(純度:98%)、膽固醇(純度>95.0%)(上海麥克林生化科技有限公司);L-丁硫氨酸-亞砜亞胺(純度:99%,ACROS ORGANICS);蛋黃卵磷脂(上海艾偉拓醫藥科技有限公司);二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-mPEG2K)(Corden Pharma Switerland LLC);N,N-二甲基甲酰胺(DMF,無水級)、PBS、RPMI-1640培養基(大連美侖生物科技有限公司);胎牛血清(美國Gemini),青霉素-鏈霉素溶液、胰酶細胞消化液-0.25%胰酶(上海碧云天科技有限公司);CCK-8試劑盒(Biosharp);氮氣(青島華奧焊割儀表有限公司);BCA蛋白濃度測定試劑盒(上海生工生物工程有限公司);微量還原型谷胱甘肽測定試劑盒(Biological Industries);二氯甲烷(CH2Cl2)、30%過氧化氫(H2O2)、丙酮、乙醚、乙醇和磷酸為分析純;甲醇為色譜純。
1.3 細胞
小鼠乳腺癌順鉑耐藥(4T1/DDP)細胞和小鼠乳腺癌(4T1)細胞由安徽中醫藥大學宋航教授課題組提供。
2 方法與結果
2.1 順-二氯·反-二(丁二酸氫根)·順-二氨合鉑(Ⅳ)(DSCP)的制備
以順鉑為基礎,使用30% H2O2溶液氧化順鉑以增加兩個“-OH”軸向配體形成順-二氯·反-二羥基·順-二氨合鉑(Ⅳ){cis,cis,trans-[PtCl2(OH)2(NH3)2]},進而在真空條件下與丁二酸酐發生酯化反應生成具有雙羧基側鏈的Pt(Ⅳ)前藥——DSCP,合成路線見圖1。
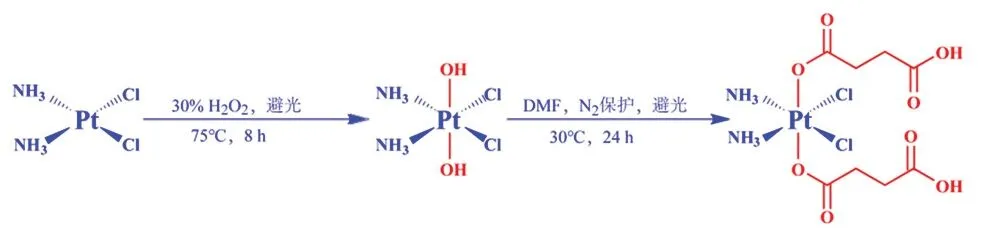
圖1 順-二氯·反-二(丁二酸氫根)·順-二氨合鉑(Ⅳ)的合成路線圖Fig 1 Synthetic route of DSCP
2.1.1 順-二氯·反-二羥基·順-二氨合鉑(Ⅳ)的合成及結構表征 稱取順鉑1.12 g置于250 mL圓底燒瓶中,加入75 mL 30% H2O2溶液,在75℃條件下回流反應8 h,將反應液降至室溫并于-20℃靜置過夜,抽濾,無水乙醇洗滌固體,25℃真空干燥得亮黃色晶體1.05 g,產率83%,紅外圖譜(IR)和質譜(ESI-MS)結果見圖2。IR(KBr,cm-1):3475,ν-OH;1587,δd-NH3;1445,1374,δS-NH3;1076,δ-PtOH;961,894,854,ρr-NH3;570,538,ν-PtO,ν-PtN。ESIMS+,m/z:[M+H]+,334.97。
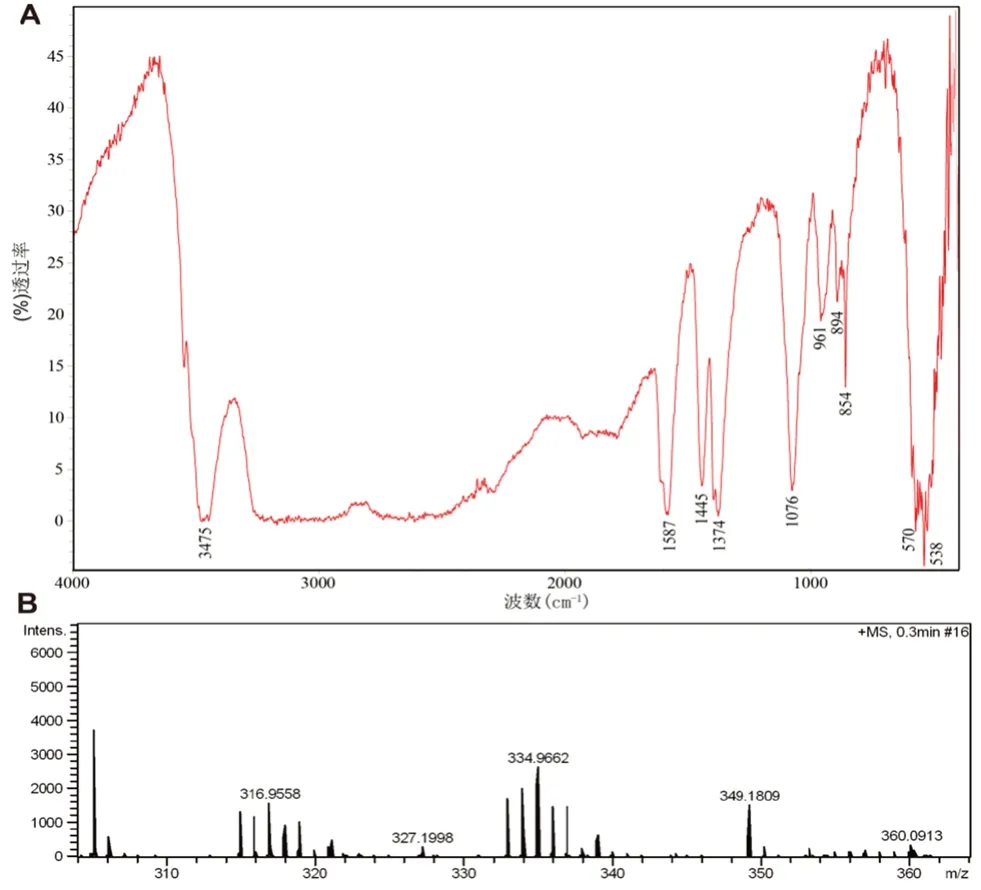
圖2 cis,cis,trans-[PtCl2(OH)2(NH3)2]的IR(A)和ESI-MS(B)圖譜Fig 2 IR(A)and ESI-MS(B)of cis,cis,trans-[PtCl2(OH)2(NH3)2]
2.1.2 DSCP的合成及結構表征 稱量cis,cis,trans-[PtCl2(OH)2(NH3)2] 200.4 mg(0.6 mmol)和丁二酸酐180.1 mg(1.8 mmol)置于50 mL圓底燒瓶中,加入8 mL無水DMF,氮氣保護條件下,30℃避光攪拌24 h得澄清黃色溶液。減壓旋蒸去除DMF得黃色油狀物,使用12 mL冰丙酮溶解,將溶液緩慢滴入快速攪拌的60 mL冰乙醚中析出沉淀。過濾得固體,乙醚清洗數次,25℃真空干燥后得淡黃色粉末,產率60%,純度為98.26%,核磁共振氫譜(1H-NMR)和ESI-MS結果見圖3。ESI-MS+,m/z:[M+H]+,534.8755;1H-NMR(400 MHz,DMSO-d6):δ12.20(2H,COOH),6.53(br,6H,-NH3),2.49(4H,OOC-CH2-),2.37(4H,-CH2-COOH)。
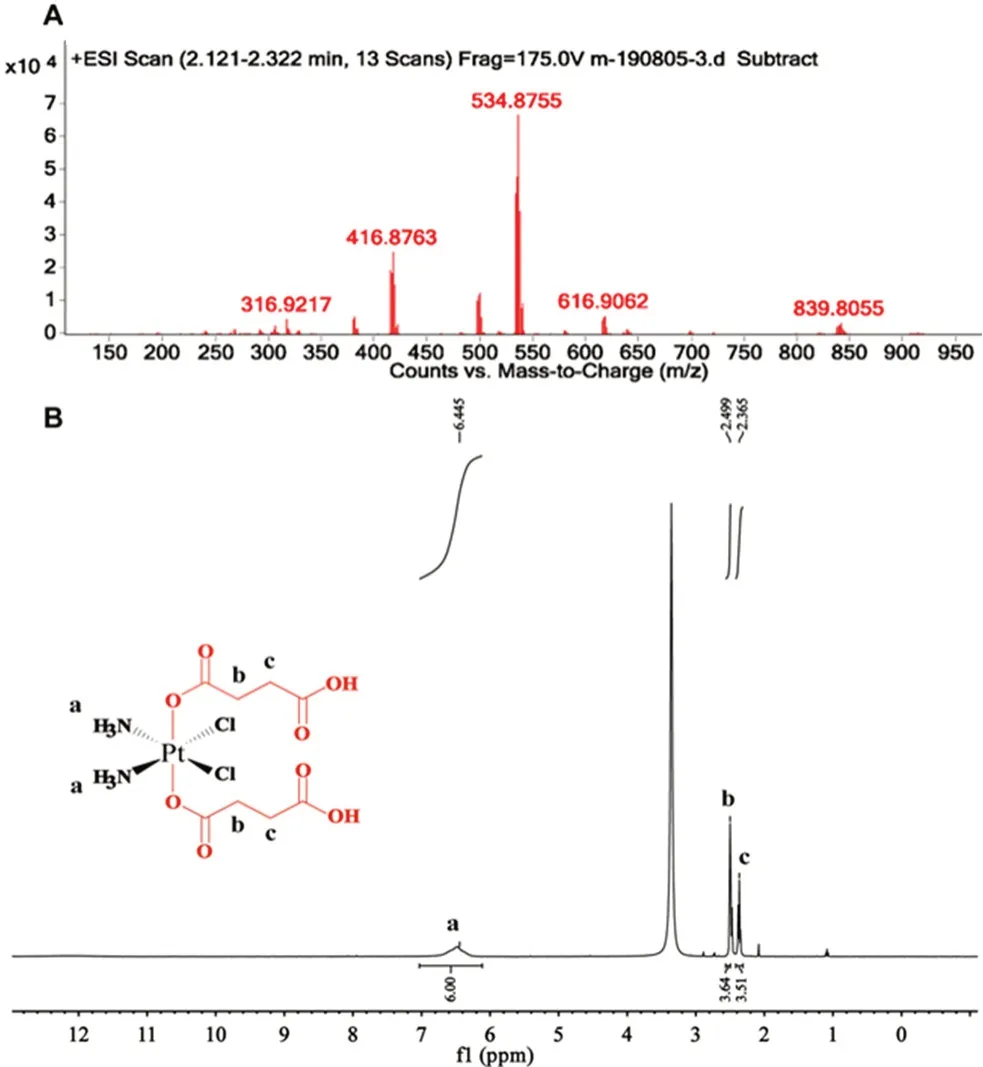
圖3 順-二氯·反-二(丁二酸氫根)·順-二氨合鉑(Ⅳ)的ESIMS(A)和1H-NMR(B)圖Fig 3 ESI-MS(A)and 1H-NMR(B)of DSCP
2.2 DSCP Lip和DSCP/L-BSO Lip的制備
2.2.1 細胞培養 在含10%胎牛血清的RPMI-1640培養基的培養瓶中培養4T1/DDP細胞,培養箱溫度37℃、含5%CO2,當培養瓶底部覆蓋細胞密度為80%~90%時,傳代進行后續實驗。
2.2.2 DSCP和L-BSO投料比的篩選 稱取適量的DSCP和L-BSO,采用去離子水溶解,按照不同摩爾比(12∶1、6∶1、3∶1、1∶1、1∶3、1∶6、1∶12)配制DSCP和L-BSO的混合溶液,取處于對數生長期的4T1/DDP細胞,用含10%胎牛血清的RPMI-1640培養基稀釋成3×104個·mL-1接種于96孔板,每孔100 μL,置于37℃、5%CO2培養箱中培養12 h。棄去培養基,加入不同比例的DSCP和L-BSO混合溶液劑作為實驗組(DSCP∶LBSO為12∶1、6∶1、3∶1、1∶1、1∶3、1∶6、1∶12,其中DSCP的濃度為30 μmol·L-1),同時設陰性對照組(不給藥),每組6個復孔。給藥48 h后,棄去培養基,加入不含血清的培養基稀釋10倍的CCK-8溶液,每孔100 μL,3 h后用酶標儀在450 nm測定OD值,計算各組細胞生存率,結果見圖4A。同時,采用CCK-8實驗考察不同濃度L-BSO溶液對4T1/DDP細胞生存率的影響(見圖4B)。細胞生存率(%)=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。
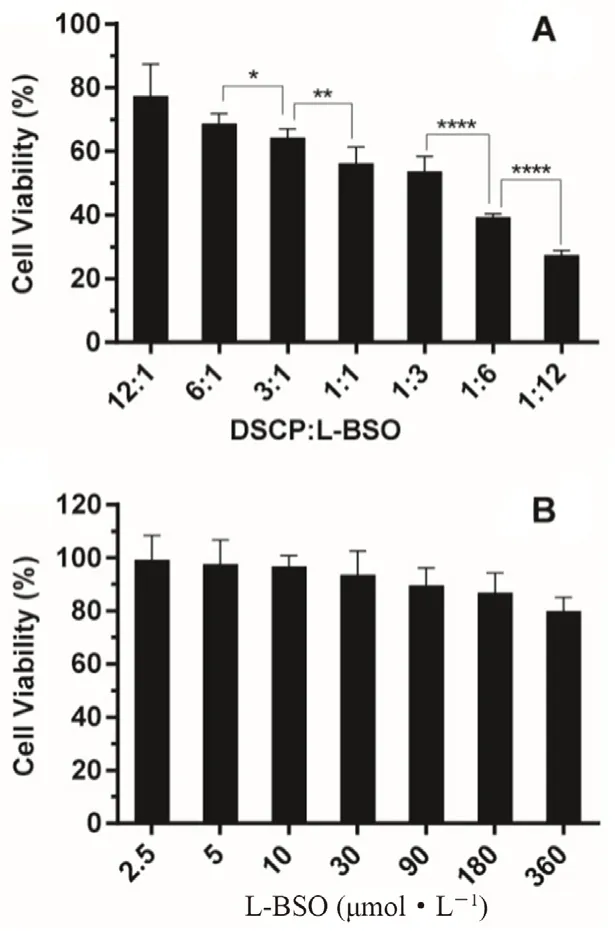
圖4 不同比例DSCP和L-BSO混合溶液劑(A)及不同濃度L-BSO溶液(B)對4T1/DDP細胞存活率的影響(Mean±SD,n=6,*P<0.05,**P<0.01,***P<0.001,****P<0.0001)Fig 4 Effects of different proportions of DSCP and L-BSO mixed solutions(A)and different concentrations of L-BSO solutions(B)on the cell viability of 4T1/DDP cells(Mean±SD,n=6,*P<0.05,**P<0.01,***P<0.001,****P<0.0001)
由結果可知,L-BSO溶液對4T1/DDP細胞存活率的影響較小,DSCP和L-BSO混合溶液劑對4T1/DDP細胞的抑制率隨著L-BSO在混合溶液中占比的增加而增加,當DSCP和L-BSO混合溶液劑的摩爾比為1∶12時,4T1/DDP細胞的存活率最低,具有較好的協同效果。因此,接下來的研究中,DSCP和L-BSO的摩爾比設為1∶12。
2.2.3 DSCP Lip和DSCP/L-BSO Lip的制備 采用薄膜水化-擠出法制得目標尺寸大小(<200 nm)的脂質體,并用超濾離心法去除游離藥物。具體如下:稱取蛋黃卵磷脂127.7 mg,膽固醇42.5 mg和DSPE-mPEG2K42.5 mg置于250 mL茄形瓶中,加入20 mL CH2Cl2形成脂質體溶液,旋蒸除去CH2Cl2,制成均一的脂質體膜,25℃真空干燥,加入DSCP和L-BSO混合溶液劑(含4 mg DSCP和20 mg L-BSO的去離子水溶液),磁力攪拌5 min,再加入4 mL去離子水,磁力攪拌2.5 h,即得到粗制的DSCP/L-BSO Lip。將其過0.22 μm濾膜,使用脂質體擠出器(200 nm膜)擠出20次,即得到具有乳光的DSCP/L-BSO Lip。使用超濾離心管,3000 r·min-1離心20 min去除游離藥物,制備的DSCP Lip和DSCP/L-BSO Lip外觀為乳白色的液體,具有淡藍色乳光(見圖5)。

圖5 DSCP Lip和DSCP/L-BSO Lip的外觀圖Fig 5 Appearance shape of the DSCP Lip and DSCP/L-BSO Lip
DSCP Lip的制備同上述操作,將DSCP和L-BSO的混合溶液替換成DSCP溶液劑。
2.3 DSCP Lip和DSCP/L-BSO Lip的表征
2.3.1 粒徑與Zeta電位 將制備的DSCP Lip和DSCP/L-BSO Lip用去離子水稀釋10倍,采用Zetasizer 3000 HS激光粒度儀測定粒徑分布和Zeta電位,結果見圖6。
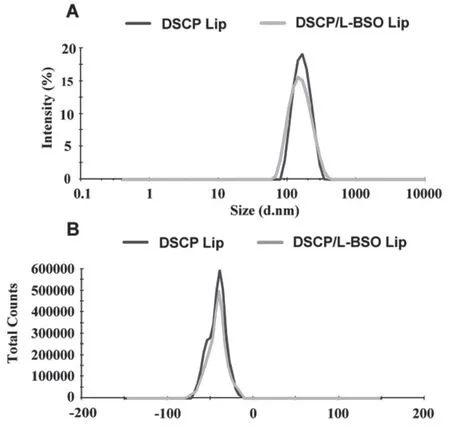
圖6 DSCP Lip和DSCP/L-BSO Lip粒徑分布圖(A)和電位分布圖(B)Fig 6 Particle size distribution(A)and Zeta potential(B)of the DSCP Lip and DSCP/L-BSO Lip
DSCP Lip和DSCP/L-BSO Lip的平均粒徑分別為(154.88±2.67)nm和(143.66±1.25)nm,Zeta電位分別為(-42.84±0.07)mV和(-42.10±0.12)mV,PDI分別為(0.12±0.01)和(0.13±0.01),說明所制得的DSCP Lip和DSCP/L-BSO Lip粒徑較小且分布較窄,有利于腫瘤細胞攝取內吞脂質體,增加L-BSO和DSCP的胞內積累,進而提高其抗腫瘤效果[16-18]。
2.3.2 形態 使用去離子水將脂質體稀釋300倍,滴加到碳膜覆蓋的銅網(200目)上靜置1 min,自然干燥后用2%的磷鎢酸溶液負染2 min,在透射電鏡(TEM)下觀察脂質體的形態(見圖7)。
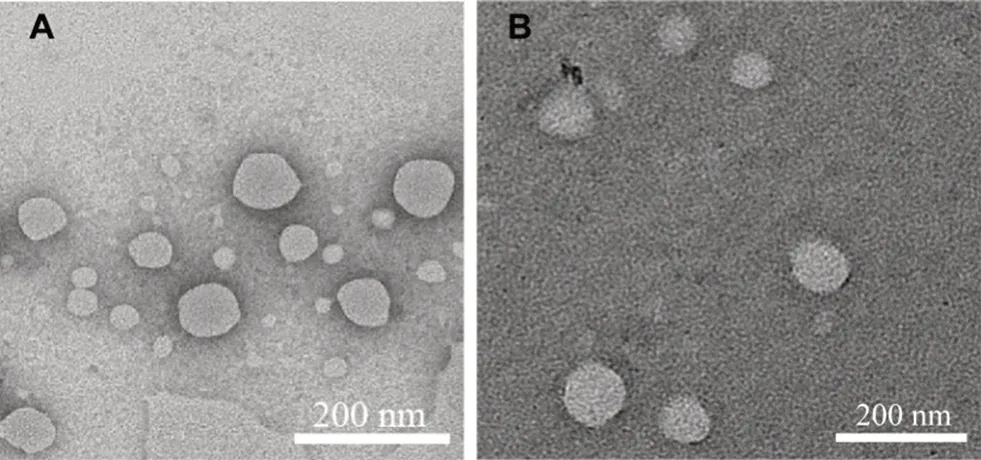
圖7 DSCP Lip(A)和DSCP/L-BSO Lip(B)的透射電鏡圖Fig 7 Transmission electron micrograph of DSCP Lip(A)and DSCP/L-BSO Lip(B)
DSCP Lip和DSCP/L-BSO Lip形態圓整,呈球狀,分散均勻,與Zetasizer 3000 HS激光粒度儀測定結果相比,TEM下干燥后的脂質體的粒徑要比水合粒徑小,筆者推測是由于在TEM條件下,脂質體表面的水化層的丟失造成的[19]。
2.3.3 穩定性 以粒徑為考察指標,考察DSCP Lip和DSCP/L-BSO Lip在10%大鼠血漿pH 7.4 PBS緩沖液中的穩定性[20]。將1 mL脂質體與9 mL 10%大鼠血漿pH 7.4 PBS混合均勻后,置于37℃,100 r·min-1搖床中,分別于0.5、2、4、8、12、24、48和72 h測定脂質體的粒徑變化(見圖8A)。
以粒徑為考察指標,使用去離子水將脂質體稀釋10倍,考察DSCP Lip和DSCP/L-BSO Lip在4℃條件下放置15 d的長期穩定性(見圖8B)。
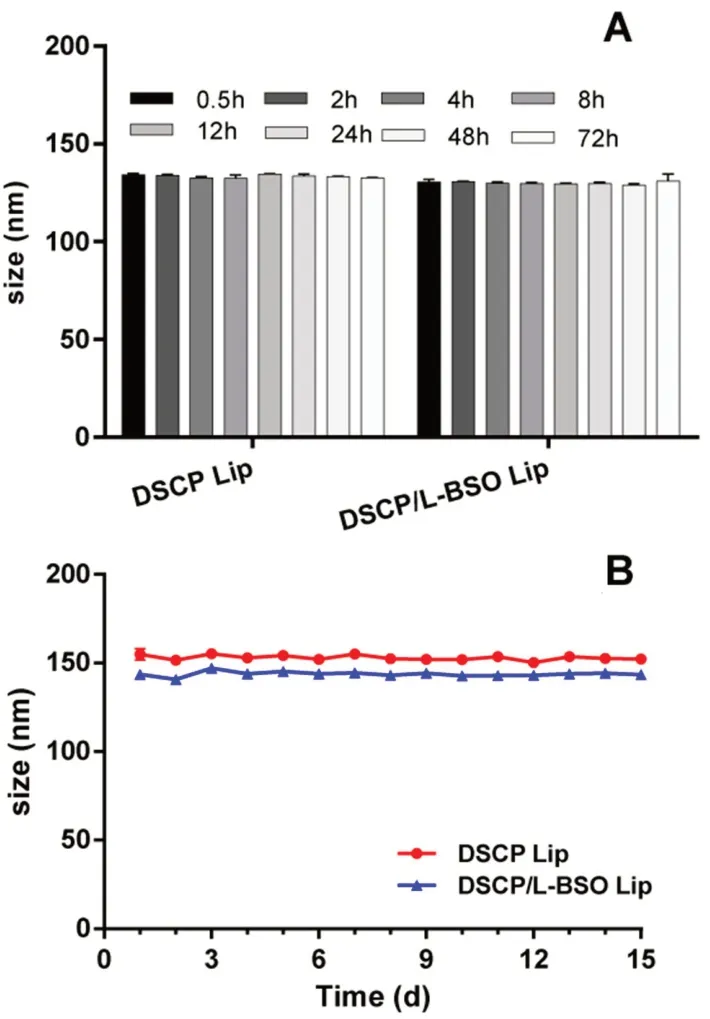
圖8 DSCP Lip和DSCP/L-BSO Lip的穩定性(Mean±SD,n=3)Fig 8 Stability of DSCP Lip and DSCP/L-BSO Lip(Mean±SD,n=3)A.72 h血漿穩定性(stored at rat plasma for 72 h);B.4℃長期穩定性(long term stability at 4℃)
從結果可以看出,DSCP Lip和DSCP/L-BSO Lip表現出較好的血漿穩定性和長期穩定性,這可能與脂質體表面存在PEG水化層和-40 mV左右的Zeta電位有關,脂質體粒子之間存在空間排斥作用,穩定性較高[14,21]。
2.3.4 包封率和載藥量的測定
① DSCP標準曲線的建立:采用高效液相色譜法(HPLC)測定DSCP的含量,采用YMC-Pack ODS-A色譜柱(250 mm×4.6 mm,5 μm);流動相:甲醇 ∶0.5%磷酸水(45∶55,V/V);柱溫:25℃;流速:1.0 mL·min-1;波長:220 nm;進樣量:10 μL。
配制質量濃度為1、5、10、25、50和100 μg·mL-1的DSCP溶液劑,進樣測定,以峰面積y對質量濃度x進行線性擬合,得回歸方程y=0.4603x-0.1574,R2=1.000,表明DSCP在1~100 μg·mL-1內與峰面積線性關系良好。
② L-BSO標準曲線的建立[22]:以鄰苯二酚為衍生劑使L-BSO衍生化,利用紫外可見分光光度計(UV-Vis)對L-BSO衍生物進行檢測和定量,具體如下:先后向2 mL樣品溶液中添加0.5 mL含鄰苯二酚的pH 7.4 PBS溶液(2.4 mmol·L-1)和0.5 mL含高碘酸鈉的pH 7.4 PBS溶液(4.8 mmol·L-1),60 s后在503 nm固定波長下測定L-BSO衍生物的吸光值。
配制質量濃度為100、200、300、500、800和1000 μg·mL-1的L-BSO水溶液,按上述方法測定,以吸光值y對質量濃度x進行線性擬合,得回歸方程y=0.0008x+0.0541,R2=0.9962,表明L-BSO在100~1000 μg·mL-1內與吸光值線性關系良好。
③ 包封率和載藥量的測定:使用超濾離心法測定DSCP和L-BSO的包封率和載藥量。取3 mL脂質體溶液至超濾離心管中,3000 r·min-1離心20 min,精密吸取濾液并定容,稀釋適當倍數后,過0.45 μm濾膜,分別用HPLC和UV-Vis測定DSCP、L-BSO含量,計算DSCP和L-BSO的包封率(EE)和載藥量(DL),結果見表1。包封率(EE,%)=脂質體中藥物的重量/藥物的加入重量×100%;載藥量(DL,%)=脂質體中藥物的重量/(載體重量+脂質體中藥物的重量)×100%。
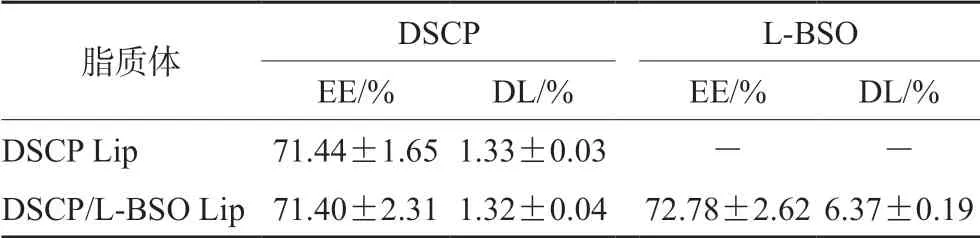
表1 DSCP Lip和DSCP/L-BSO Lip的包封率和載藥量(Mean±SD,n=3)Tab 1 Encapsulation efficiency and drug loading of DSCP Lip and DSCP/L-BSO Lip (Mean±SD,n=3)
由表1可看出,DSCP和L-BSO的包封率均在71%~73%,表明DSCP和L-BSO在脂質體內水相中的摩爾比依然保持在1∶12左右。
2.3.5 體外釋放考察 采用透析法考察DSCP在pH 7.4 PBS中的釋放行為。精密量取一定體積的DSCP Lip和DSCP/L-BSO Lip分別裝入預處理好的透析袋中,平行3份,兩端系好,放入50 mL PBS中,于120 r·min-1、37℃恒溫搖床上震蕩,分別在0.5、1、2、4、6、8、10、12和24 h時間點取樣1 mL,并每次補加等體積新鮮的釋放介質,過0.45 μm濾膜,HPLC測定DSCP的濃度,按照下式計算累積釋放百分比Q,結果見圖9。
Q=[Ci×V1+(C1+C2+…+Ci-1)×V2]/M×100%
式中C1、C2、Ci-1、Ci分別是第1、2、i-1、i時間點釋放介質中DSCP濃度;V1為釋放介質總體積,V2為所取樣的體積;M為釋放前總藥量。
由圖9可知,DSCP的水溶性較好[23],在pH 7.4 PBS釋放介質中,DSCP的釋放速度較快,約在4 h釋放達到80%。
2.4 體外抗腫瘤評價
2.4.1 考察不同制劑對4T1/DDP和4T1細胞存活率的影響 同“2.2.2”項下操作,采用CCK-8法考察不同濃度的DSCP溶液劑、DSCP和L-BSO混合溶液劑、DSCP Lip、DSCP/L-BSO Lip和空白脂質體對4T1/DDP細胞和4T1細胞存活率的影響,采用Graph Pad計算細胞存活率IC50,具體結果見圖10和表2。
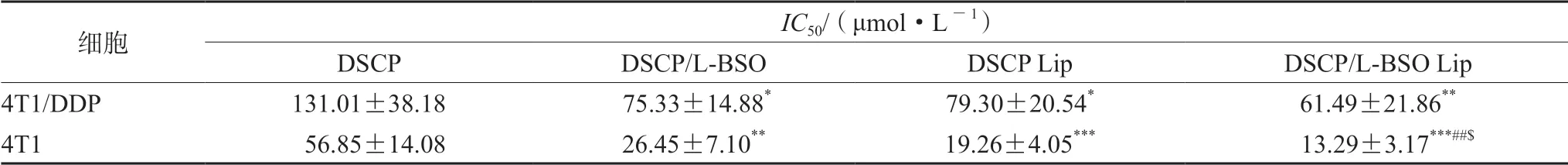
表2 DSCP溶液、DSCP/L-BSO混合溶液、DSCP/Lip和DSCP/L-BSO Lip對4T1/DDP細胞和4T1細胞的IC50值(n=6)Tab 2 IC50 of 4T1 and 4T1/DDP cells incubated with DSCP solution,DSCP and L-BSO mixed solutions,DSCP/Lip,and DSCP/L-BSO Lip (n=6)
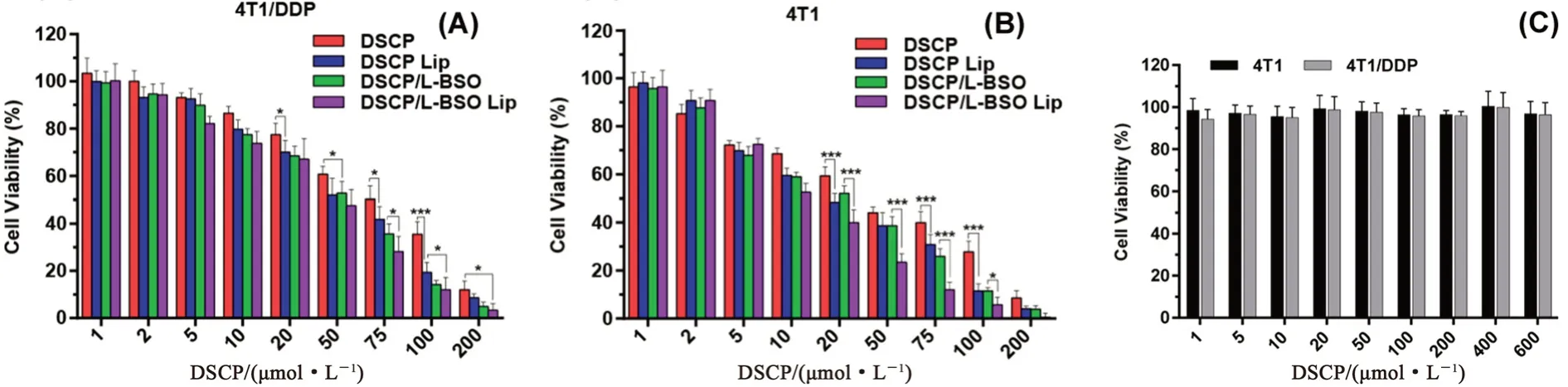
圖10 不同制劑對4T1/DDP細胞(A)和4T1細胞(B)存活率的影響以及不同濃度的空白脂質體對4T1/DDP細胞和4T1細胞存活率的影響(C)(n=6,*P<0.05,**P<0.01,***P<0.001)Fig 10 Effect of different preparation on the cell viability of 4T1/DDP cells(A)and 4T1 cells(B)and effect of different proportions of blank liposome on the cell viability of 4T1/DDP cells and 4T1 cells(C)(n=6,*P<0.05,**P<0.01,***P<0.001)
由結果可以看出,空白脂質體安全性良好,對細胞的存活率無影響。DSCP溶液劑、DSCP和L-BSO混合溶液劑、DSCP Lip和DSCP/L-BSO Lip對4T1/DDP和4T1細胞均有明顯的抑制作用,且抑制作用隨藥物濃度的增大而增強。相對于DSCP溶液劑,DSCP和L-BSO混合溶液劑具有較高的細胞毒性,說明DSCP和L-BSO具有協同抗腫瘤作用;同樣地,與DSCP Lip組相比,DSCP/L-BSO Lip的細胞抑制效果較強,說明其具有較好的抗腫瘤效果。DSCP/L-BSO Lip組對兩種細胞的IC50均最小,說明其體外抗腫瘤效果最好。
2.4.2 GSH濃度的測定 取處于對數生長期的4T1和4T1/DDP細胞,以2×105個·mL-1濃度加入到6孔板中,每孔3 mL,12 h后棄去培養液,加入DSCP溶液劑、DSCP和L-BSO混合溶液劑、DSCP Lip、DSCP/L-BSO Lip溶液處理(其中DSCP的濃度為60 μmol·L-1),設3個復孔,24 h后棄去含藥培養液,加入預冷的PBS溶液清洗細胞表面2~3次,吸凈PBS。放置于冰上,用細胞刮刀將細胞刮下并收集于超聲管,加入適量預冷的細胞裂解液,超聲裂解細胞。將細胞轉移至1.5 mL離心管中,隨后在13 000 r·min-1低溫離心10 min,小心吸取上清液分管裝好暫存于-20℃備用。使用BCA蛋白濃度測定試劑盒和微量還原型谷胱甘肽測定試劑盒測定上清液內細胞蛋白濃度和GSH含量,根據以下公式計算細胞內GSH的濃度。結果見圖11。
細胞內GSH濃度(μmol·g-1prot)=[(測定孔OD值-空白孔OD值)/(標準孔OD值-空白孔OD值)]×[20 μmol·L-1(GSH標準品濃度)/細胞蛋白濃度(g prot·L-1)]
從圖11可以看出,與4T1細胞相比,順鉑耐藥型4T1/DDP細胞具有較高的GSH濃度。無論是4T1和4T1/DDP細胞,與對照組DSCP溶液劑、DSCP和L-BSO混合溶液劑、DSCP Lip相比,DSCP/L-BSO Lip處理后,細胞內的GSH明顯得到下調,這個可能是由于脂質體進入細胞后,釋放的L-BSO通過抑制GCL活性下調了細胞內GSH,以及Pt(Ⅳ)前藥的激活消耗GSH,增加腫瘤細胞對順鉑的敏感性,提高DSCP/L-BSO Lip的抗腫瘤效果。
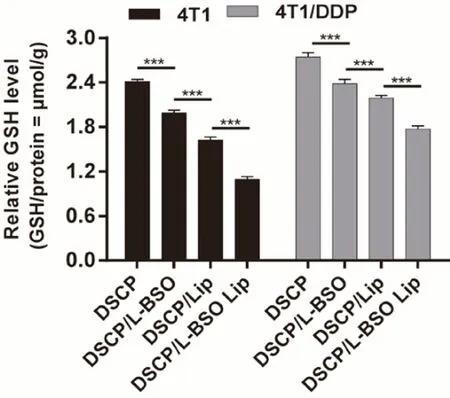
圖11 不同制劑處理24 h后胞內GSH的定量分析(n=3)Fig 11 Quantitative analysis of GSH in cells treated with different preparations for 24 h(n=3)
3 討論
目前而言,順鉑臨床使用過程中的最大難點是腫瘤耐藥[24-25]。腫瘤細胞產生順鉑耐藥主要是由于細胞對順鉑攝取的降低(例如Ctr1下調[26])、外排增加(如ATP7B上調[27])、胞內順鉑的轉化或硫醇物質的解毒(如GSH)、DNA修復(如NER系統[28])和自噬(如ATG14基因上調[29])等因素造成的。在順鉑進入細胞后,胞內的還原物質如GSH、甲硫氨酸、金屬硫蛋白、硫氧還蛋白和其他含硫醇的物質會和順鉑發生反應,產生Pt(GS)2偶聯物,進而被ATP依賴性的多藥耐藥相關蛋白排出細胞[24-25,30]。大量研究證明,降低胞內GSH的濃度,可以恢復腫瘤細胞對順鉑的化療敏感性。近期,Nie課題組構建了包載水溶性的Pt(Ⅳ)前藥和蘿卜硫素的納米遞送系統(SFN-CDDP-NPs),通過蘿卜硫素消耗乳腺癌細胞GSH的機制,降低了Pt(GS)2的生成,腫瘤細胞凋亡大大增加,顯著提高了體內腫瘤的治療效果[31]。
脂質體是由天然的或人工合成的脂質組合形成的封閉囊狀結構,具有良好的生物相容性和生物降解性[32-33]。它具有疏水性的脂質雙分子層和內水相,既能將親脂性藥物包載于磷脂雙分子層,也能將親水性藥物包載在內水相[34]。同時,脂質體磷脂雙分子層和DSPE-PEG的疏水段有較好的相似性,易于PEG化修飾,能在脂質體表面形成水化層,大大增加藥物的穩定性[35]。具有獨特結構的脂質體為水溶性的L-BSO和DSCP的有效共載提供了很好的平臺。
本文通過薄膜水化-擠出法制備了DSCP和L-BSO雙載藥的PEG化脂質體,對制備的DSCP/L-BSO Lip進行了系統的制劑學表征,體外抗腫瘤研究也初步證明了DSCP和L-BSO的協同抗腫瘤作用,DSCP/L-BSO Lip表現出較好的體外抗腫瘤效果,推測其可能機制為:① 相對于DSCP Lip,DSCP/L-BSO Lip攝取入胞后,L-BSO從脂質體中釋放出來,通過特異性抑制GCL活性,降低了GSH的合成,一定程度增加了抗腫瘤效果;② 和同等劑量的DSCP和L-BSO混合溶液劑相比,DSCP和L-BSO混合溶液劑進入腫瘤細胞的方式是被動擴散,而對于DSCP/L-BSO Lip制劑而言,其不僅能通過內吞的方式進入腫瘤細胞,同時該脂質體中釋放出來的DSCP和L-BSO也可以通過被動擴散方式進入腫瘤細胞,表現出較好的抗腫瘤效果。本研究制備的DSCP/L-BSO Lip具有較好的逆轉腫瘤順鉑耐藥的治療效果,為鉑類新制劑的研發提供了新的思路。

