沉默信息調節因子1通過調節LEF-1對軟骨保護作用的研究
胡學宇,楊小春,,薛 源,燕江波,周 永,金群華
(1.寧夏醫科大學臨床醫學院,銀川 750004;2.寧夏醫科大學總醫院,銀川 750004)
骨關節炎(osteoarthritis,OA)是一種慢性退行性疾病,可累及關節軟骨、軟骨下骨、半月板、滑膜及周圍軟組織[1]。其典型特征是關節軟骨退變,軟骨下骨骨重塑及滑膜炎性改變[2]。軟骨覆蓋于關節表面,起潤滑和支撐作用,主要由軟骨細胞和細胞外基質(extracellular matrix,ECM)組成。軟骨細胞負責ECM成分的分泌和更新,ECM反過來對軟骨細胞起營養支持作用。當軟骨由于磨損或機械應力造成軟骨破壞,將會引起關節疼痛、腫脹及炎癥反應[3],ECM隨之丟失,其合成代謝和分解代謝的平衡被打破,造成骨關節炎的發生。沉默信息調節因子1(silent information regulator 1,SIRT-1)作為煙酰胺腺嘌呤二核苷酸(NAD+)依賴性的Ⅲ類組蛋白去乙酰化酶(histone deacetylase,HDAC),其對細胞生長、代謝、衰老及炎癥方面有重要作用[4]。在Wnt/β-catenin信號通路中,SIRT-1可發揮軟骨保護作用從而達到治療骨關節炎的作用[5]。淋巴細胞增強因子1(lymphoidenhancer factor,LEF-1)作為T細胞因子(TCF)/LEF家族中成員[6],主要位于細胞核中,是Wnt信號通路中重要的調節因子。LEF-1參與調控多種疾病及代謝過程的發生[7-8]。β-catenin與LEF-1蛋白相互作用可穩定細胞質中β-catenin表達水平,在Wnt信號通路作用下,β-catenin被穩定轉運到細胞核內,與LEF-1結合后,調控目的基因的表達。研究顯示[9],β-catenin參與調節軟骨的保護,減輕關節軟骨的破壞與變性。為觀察在骨關節炎發生時,SIRT-1是否參與調節LEF-1蛋白的表達來發揮軟骨保護作用,進行了本研究。
1 資料與方法
1.1 一般資料
選取2020年2—7月寧夏醫科大學總醫院骨三科收治的原發性骨關節炎患者行全膝關節置換手術后自愿捐贈的新鮮脛骨平臺組織,共30例,其中女性18例,男性12例,排除類風濕、創傷等引起的繼發性關節炎。所有實驗均獲得寧夏醫科大學總醫院倫理委員會的批準(批準文號-2020-999),并取得患者家屬的知情同意且符合赫爾辛基原則。
1.2 所用材料
組織固定液(索萊寶,北京);番紅O固綠染料(索萊寶,北京);伊紅染液試劑盒(索萊寶,北京);PV-9001二抗試劑盒(中杉金橋,北京);磷酸鹽緩沖液(中杉金橋,北京);一抗:兔來源SIRT-1抗體(abcam,美國),兔來源β-catenin抗體(proteintech,武漢),兔來源LEF-1抗體(proteintech,武漢),兔來源CollagenⅡ抗體(abcam,美國),兔來源基質金屬蛋白酶13(MMP-13)抗體(proteintech,武漢);小量組織總RNA提取試劑盒(愛思進,美國);一步法cDNA反轉錄試劑盒(全式金,北京);qPCR試劑盒(全式金,北京);蘇木素染液(索萊寶,北京);山羊抗兔IgG H&L(Alexa FluorR488)(abcam,美國);抗熒光衰減封片劑(含DAPI)(碧云天,上海)。
1.3 組織處理及分組
將術中取下的新鮮標本,用骨刀、咬骨鉗處理成1 cm×1 cm×0.5 cm大小,按照國際骨關節炎協會(Osteoarthritis Research Society International,OARSI)制定的評級評估標本,評級為0~6級,分為OA輕度組(0~2級)、OA中度組(3~4級)、OA重度組(5~6級)[10],每組樣本為30例。將新鮮標本置于多聚甲醛液中固定48 h,磷酸鹽緩沖液(phosphate buffer saline,PBS)沖洗6 h后置于10%EDTA脫鈣液中3周,每天換液1次。脫鈣結束后包埋,制成蠟塊標本,將蠟塊切成5μm矢狀位切片,置于載玻片上烤干,進行下一步實驗。
1.4 蘇木精-伊紅(HE)和番紅O固綠染色觀察人膝關節脛骨平臺軟骨組織病理改變
首先將烤干的組織切片置于二甲苯中脫蠟,并置于梯度酒精中脫水,沖洗干凈后,蘇木素染色3 min,鹽酸酒精分化5 s,自來水返藍10 min,然后0.2%固綠染色3 min,1%醋酸浸洗5 s,0.1%番紅染色3 min,最后二甲苯脫蠟,樹膠封片。在伊紅染色實驗中,首先將烤干的組織切片置于二甲苯中脫蠟,在梯度酒精中脫水后用蘇木素染色3 min并分化5 s,自來水返藍10 min后用伊紅染液染色2 min,最后樹膠封片。在100倍光鏡下觀察軟骨組織的病理改變和透明軟骨厚度和鈣化軟骨厚度,采用OARSI評級標準評估軟骨改變情況。
1.5 免疫組織化學檢測脛骨軟骨組織中SIRT-1、β-catenin、LEF-1和CollagenⅡ的表達情況
將石蠟切片置于二甲苯中脫蠟,乙醇梯度脫水,于37℃下使用0.1%胰蛋白酶修復抗原15 min,3%過氧化氫液中孵育15 min,山羊血清封閉30 min,之后滴加一抗于4℃下過夜。所用一抗為Anti-SIRT-1:(abcam,1∶200),Anti-β-catenin:(proteintech,1∶200),Anti-LEF1:(proteintech,1∶200),Anti-Collagen II(abcam,1∶300)。最后選取脛骨平臺軟骨層區域并采用Image J 1.8.0軟件分析脛骨平臺組織中相應蛋白的陽性細胞面積百分比。
1.6 免疫熒光實驗檢測不同分組人膝關節脛骨軟骨組織中LEF-1和MMP-13的表達情況
對于免疫熒光實驗,將切片置于二甲苯中脫蠟,梯度脫水,抗原修復并山羊血清封閉后與相應一抗在4℃下過夜。并與Alexa Fluor 488山羊抗兔二抗(Abcam,1∶300,ab150077)結合于37℃孵育60 min。使用倒置熒光顯微鏡觀察陽性細胞,并用Image Pro-Plus 6.0軟件選取軟骨層區域,計數不同組別相應蛋白的陽性細胞平均吸光度(IOD)情況,使用GraphPad Prism 8.3.0統計學軟件分析數據。
1.7 qPCR實驗檢測不同分組人脛骨軟骨中SIRT-1和LEF-1的mRNA表達變化
根據2009年發布的實時定量PCR(MIQE)指南規定的信息進qPCR反應,使用組織RNA提取試劑盒(AXYGEN,Wujiang,China)提取人膝關節脛骨軟骨中總RNA,使用總RNA(500 ng)制備cDNA(Bio-rad,Hercules,CA,USA),25 ng的cDNA和Syber Green的混合物(Transgen Biotech,Beijing,China)進行實時定量PCR反應。
使用的引物序列為:β-actin forward(F)為5'-GTGCTATGTTGCTCTAGACTTCG-3',Reve rse(R)為5'-ATGCCACAGGATTCCATACC-3';SIRT-1(F)為5'-AACAGGTTGCGGGAATCCAAAGG-3',R為5'-AGCTGGGCACCTAGGACATCG-3';LEF-1(F)為5'-CACACAACTGGCATCCCTCATCC-3',R為5'-GGCTCCTGCTCCTTTCTCTGTTC-3';βactin作為參考基因。使用2-△△CT計算目的基因相對表達量。
1.8 統計學方法
實驗數據應用GraphPad Prism 8.3.0統計軟件進行分析,本研究數據滿足方差齊性要求,計量資料均以均數±標準差(±s)表示,多組樣本均數比較采用單因素方差分析,兩兩比較采用SNK-q檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 不同組人脛骨平臺軟骨組織退變程度比較
番紅O固綠和HE染色結果顯示:相對OA輕度組,OA重度組標本軟骨大量丟失,軟骨下骨暴露;而OA中度組軟骨中度磨損,可見部分軟骨細胞細胞核丟失,軟骨細胞肥大,部分壞死,透明軟骨變薄。與OA輕度組相比較,OA重度組的OARSI評分升高,OA中度組介于兩者之間,見圖1。三組人脛骨平臺軟骨組織的透明軟骨厚度、鈣化軟骨厚度和OARSI評分差異均有統計學意義(P均<0.01);透明軟骨厚度:OA輕度組>中度組>重度組(P均<0.01);鈣化軟骨厚度和OARSI評分:OA輕度組<中度組<重度組(P均<0.01),見表1。
2.2 不同組脛骨軟骨組織中SIRT-1、LEF-1、βcatenin和CollagenⅡ蛋白相對表達量比較
免疫組化結果顯示:三組脛骨軟骨組織中SIRT-1、LEF-1、β-catenin和CollagenⅡ蛋白相對表達量差異均有統計學意義(P均<0.01),見圖2、圖3。;SIRT-1和CollagenⅡ蛋白表達量OA中度和重度組低于OA輕度組,OA中度組低于重度組(P均<0.01);LEF-1和β-catenin蛋白的表達量OA中度和重度組高于OA輕度組,OA重度組高于中度組(P均<0.01),見表2。
2.3 不同分組中LEF-1和MMP-13蛋白表達變化的比較
免疫熒光結果顯示:三組人脛骨軟骨組織中LEF-1和MMP-13蛋白相對表達量差異均有統計學意義(P均<0.01);LEF-1和MMP-13蛋白表達量OA中度和重度組低于OA輕度組,OA中度組低于重度組(P均<0.01),見圖4、表3。
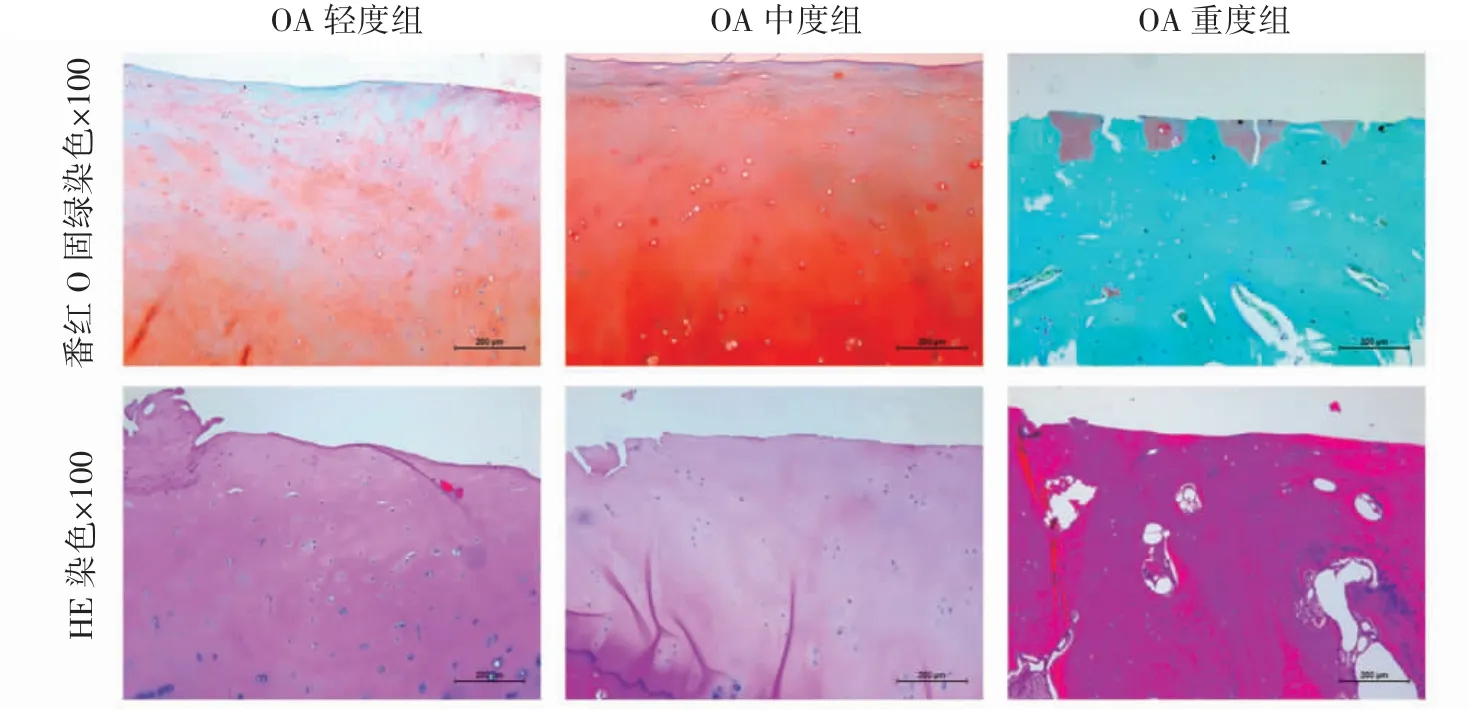
圖1 人膝關節脛骨平臺軟骨組織病理改變
表1 不同組人脛骨平臺軟骨組織退變程度比較(±s)
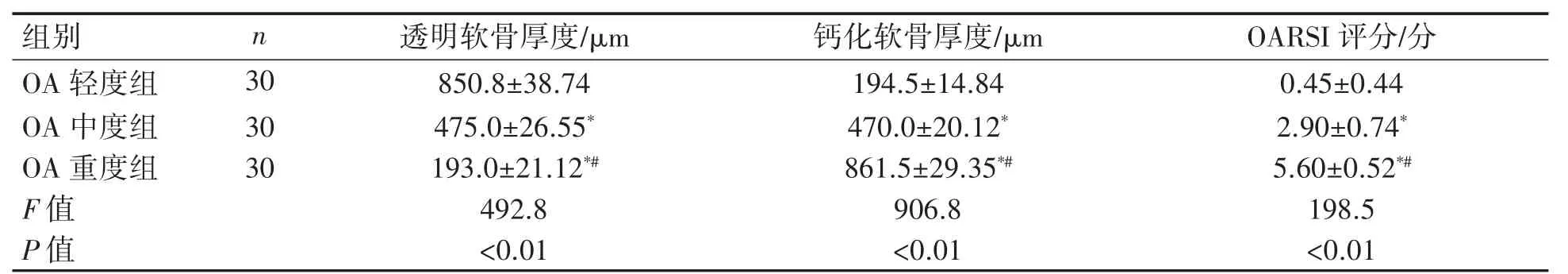
表1 不同組人脛骨平臺軟骨組織退變程度比較(±s)
與OA輕度組相比*P<0.01;與OA中度組相比#P<0.01。
?
表2 OA各組軟骨各蛋白表達量比較(±s)
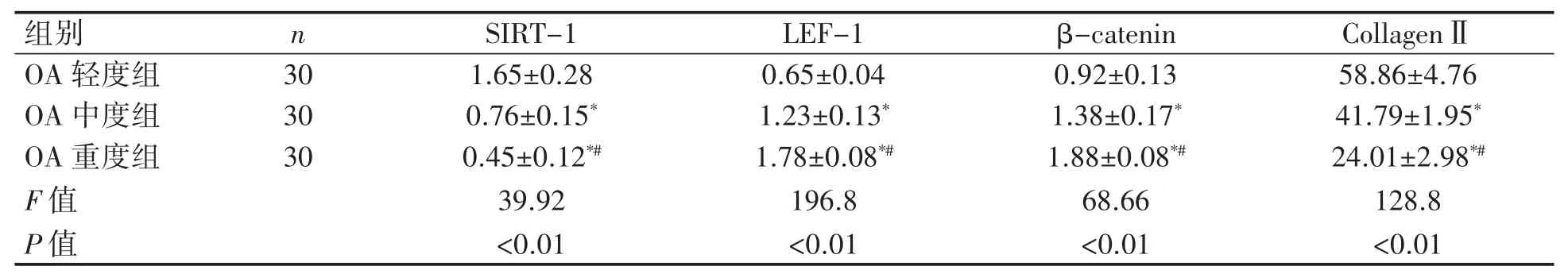
表2 OA各組軟骨各蛋白表達量比較(±s)
與OA輕度組相比*P<0.01;與OA中度組相比#P<0.01。
?
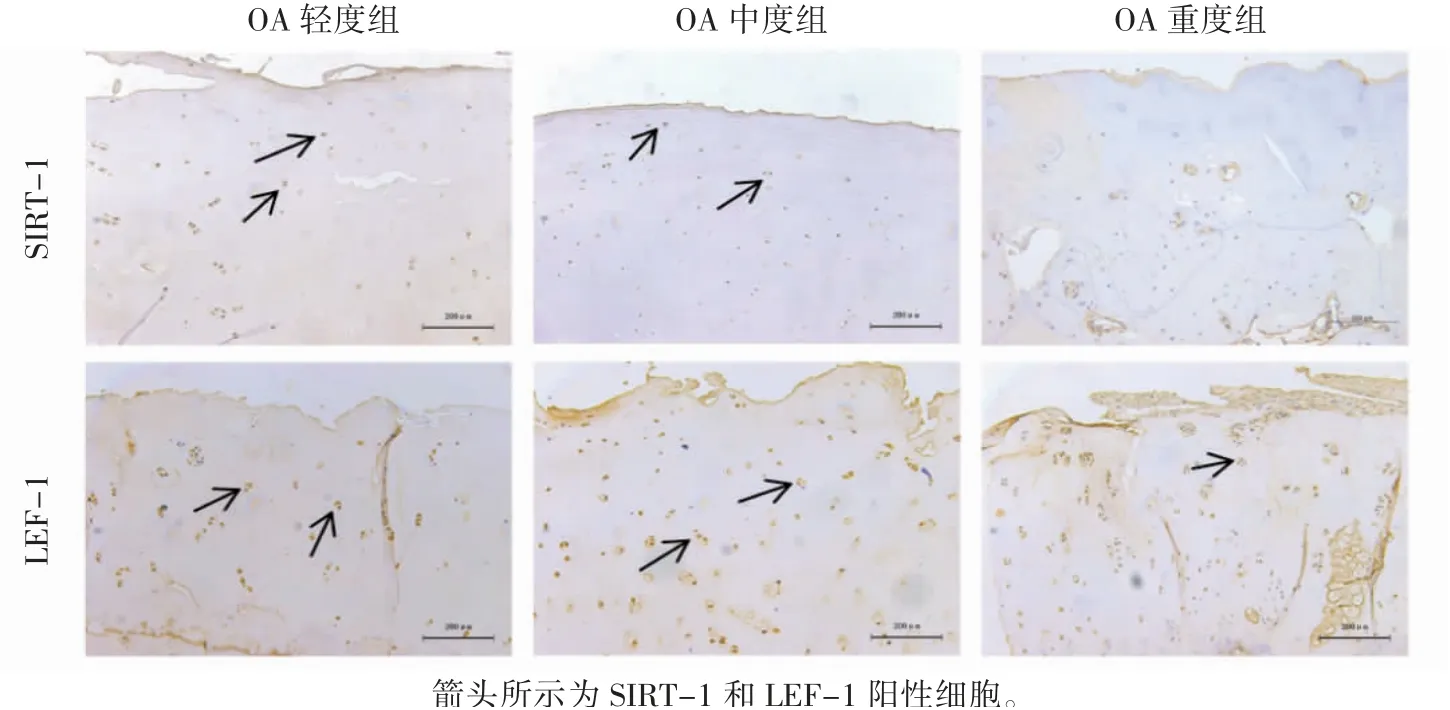
圖2 人膝關節脛骨平臺軟骨組織中SIRT-1和LEF-1蛋白表達變化情況(免疫組織化學×100)

圖3 人膝關節脛骨平臺軟骨組織中β-catenin和CollagenⅡ蛋白表達變化情況(免疫組織化學×100)
表3 OA各組中軟骨各蛋白表達量分析(±s)
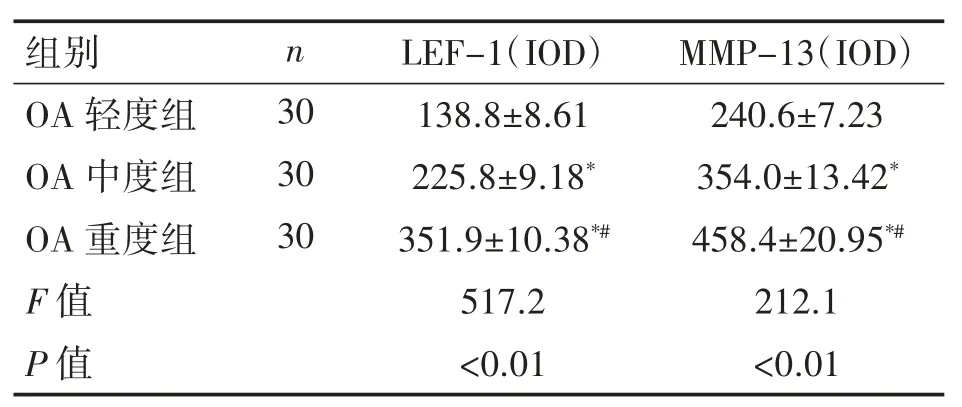
表3 OA各組中軟骨各蛋白表達量分析(±s)
與OA輕度組相比*P<0.01;與OA中度組相比#P<0.01。
?
2.4 不同分組中SIRT-1和LEF-1的mRNA相對表達情況
qPCR實驗結果顯示:三組人脛骨軟骨組織中SIRT-1和LEF-1的mRNA相對表達量差異均有統計學意義(P均<0.01);SIRT-1和LEF-1的mRNA表達量OA中度和重度組低于OA輕度組,OA中度組低于重度組(P均<0.01),見圖5。
3 討論
本研究結果表明,在OA發展過程中,軟骨面逐漸破壞受損,軟骨細胞肥大壞死,透明軟骨厚度逐漸被磨損變薄,與之相反,鈣化軟骨厚度逐漸增加,重度組標本軟骨面缺損,軟骨下骨暴露,部分標本透明軟骨消失,OARSI評級升高。這也驗證了在臨床上OA患者表現出的軟骨磨損,活動時出現關節疼痛現象。本研究依據OARSI分級原則,將相應病理染色切片組織分成了OA輕度組,OA中度組和OA重度組。在不同組中測得不同蛋白的表達水平不同。
免疫組織化學實驗結果顯示SIRT-1蛋白的表達量隨著軟骨破壞程度增加其表達逐漸減少,提示其表達變化可能與OA的發生發展有關;另外,在SIRT-1表達減少的同時,LEF-1和βcatenin蛋白的表達趨勢與之相反,表達量逐漸增加。這些與之前的研究結果相一致[11],同時qPCR實驗結果也證實了這一點,提示SIRT-1可能具有LEF-1的調節作用。二型膠原是軟骨細胞ECM中主要的膠原,起營養、支撐、保護軟骨細胞的作用[12]。在本實驗中可以看到,隨著軟骨破壞的增加,二型膠原mRNA的表達逐漸減少,這也證實二型膠原與軟骨破壞丟失有著密切聯系。
圖4 人膝關節脛骨平臺軟骨組織中β-catenin和CollagenⅡ蛋白表達情況(免疫熒光×200)
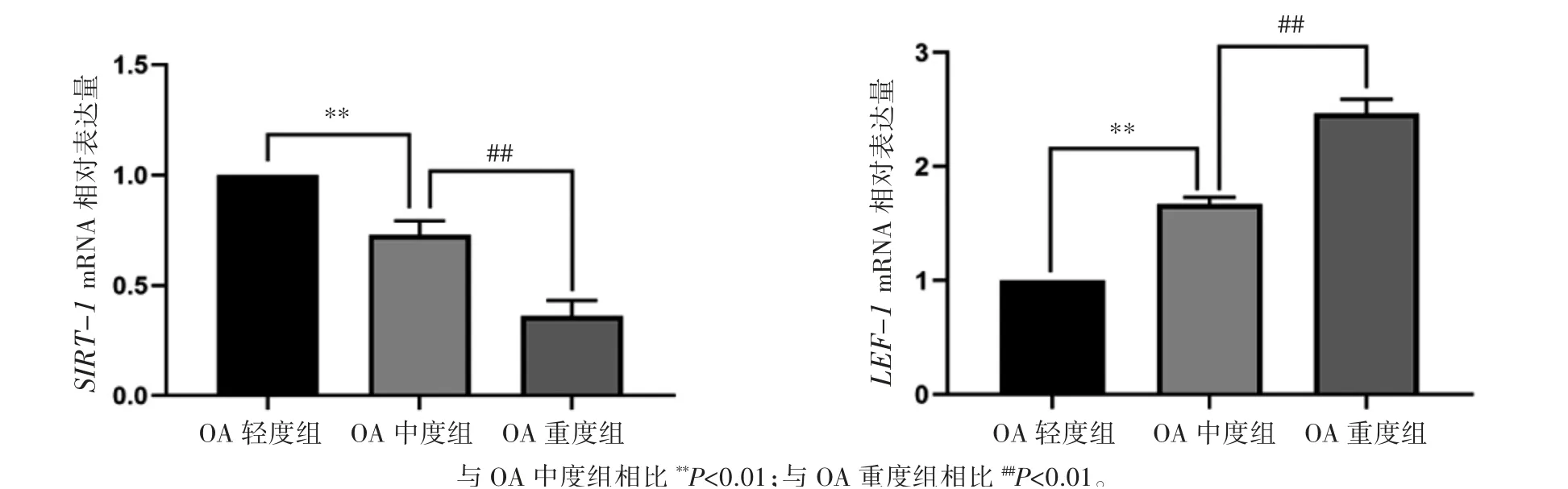
圖5 不同分組人脛骨軟骨組織中SIRT-1和LEF-1的mRNA相對表達情況
MMP-13作為軟骨中二型膠原的主要降解酶,在OA中起重要作用[13]。在免疫熒光實驗中,結果顯示,LEF-1和MMP-13的蛋白表達量隨著軟骨破壞程度的增加而增加,提示在OA時,LEF-1和MMP-13可能存在協同作用,這也和免疫組化實驗中二型膠原蛋白的表達變化相符合。結合之前研究結果推測,SIRT-1可能也具有調節MMP-13蛋白表達變化的作用。
SIRT-1表達于所有軟骨和滑膜組織的細胞核中,其去乙酰化能力與多種炎癥及疾病發生有關[14]。SIRT-1能調節機體的代謝功能,調節生物體胰島素敏感性,是控制炎癥的關鍵因子[15]。在缺乏SIRT-1基因小鼠的軟骨中發現軟骨細胞凋亡增加,ECM中二型膠原表達明顯減少,與之相反,聚集金屬基質蛋白酶13(MMP-13)表達明顯增加[16]。本文免疫組織化學研究結果也進一步證明了這些觀點。SIRT-1能激活人軟骨細胞中的自噬,發揮軟骨保護功能[17]。另外SIRT-1還參與了急性腎損傷、顱腦外傷、主動脈硬化等疾病的發病過程[18],這些疾病中SIRT-1的表達水平降低,而在一些癌癥中觀察到SIRT-1表達水平顯著升高[19],提示其也許可以用于癌癥治療。伏立諾他(SAHA)作為一種天然的HDAC抑制劑被證明可以抑制IL-1β誘導的MMP-13表達[20]。同樣作為天然HDAC抑制劑,曲古抑菌素(TSA)可以提高OA小鼠基質金屬蛋白酶抑制物(TIMP-1)/MMP比率發揮軟骨保護作用[21]。這些研究表明HDAC抑制劑在OA中也發揮著保護作用,也許是另一個不錯的研究方向。

