D NA甲基化對鄰苯二甲酸單乙基己酯致小鼠睪丸間質細胞損傷的作用
翁曉夢,李 玲,德小明,李麗萍,宋貝貝,黃金瑞,郭曉英,馬慧穎
(寧夏醫科大學公共衛生與管理學院職業衛生與環境衛生學系,寧夏環境因素與慢性病控制重點實驗室,生育力保持教育部重點實驗室,銀川 750004)
鄰苯二甲酸酯類物質(phthalic acid esters,PAEs)是一種環境內分泌干擾物,其中鄰苯二甲酸二(2-乙基己)酯(DEHP)作為廣泛使用的增塑劑,常用做聚氯乙烯(PVC)制品、塑料袋、工業涂料、化妝品、食品包裝、輸血袋等的原料,是迄今為止我國產耗量最大、應用最為廣泛的增塑劑類型[1],被列為人類可能致癌物(IARC分類為Group2B[2]。DEHP進入體內后通過哺乳動物腸道水解酶的作用代謝為鄰苯二甲酸單乙基己基酯(MEHP),研究表明MEHP毒性高于DEHP,在PAEs致生殖發育毒性中發揮主要作用[3]。體內外研究結果證實[4],在胚胎期暴露環境內分泌干擾物引起的表觀遺傳修飾,可以誘導基因表達的改變,并且這種改變可能在整個生命周期中持續存在,表觀遺傳學最主要的表達方式之一是DNA甲基化,在MEHP致睪丸間質細胞(TM-3)雄性生殖毒性的研究中,對DNA甲基化水平的研究尚不夠深入,因此本研究擬從表觀遺傳學的角度來深入探討MEHP的雄性生殖毒性機制,進而為后續的靶向研究提供理論依據。
1 材料與方法
1.1 細胞株來源、主要儀器和試劑
睪丸間質細胞株(TM-3細胞,美國ATCC細胞研究中心)。HF90 CO2培養箱(中國上海力申科學儀器有限公司),SW-CJ-1CU超凈工作臺(中國蘇州安泰空氣技術有限公司),CKX41倒置相差顯微鏡(日本Olympus公司),Neofuge15R高速冷凍離心機(中國上海力申科學儀器有限公司),I510全波長酶標儀(芬蘭賽默飛世爾公司),LDZM-40KCS-II立式壓力蒸汽滅菌器(中國上海申安醫療器械廠),BioRad熒光實時定量PCR儀(上海伯樂生命醫學產品有限公司)。
MEHP標準品(純度為97%,美國Sigma公司),DMEM培養基、青鏈霉素混合液、胰酶、胎牛血清、DMSO等(美國Gibco公司),CCK-8細胞增殖檢測試劑盒,Hoechst熒光染色試劑盒(中國江蘇凱基生物有限公司),5-甲基胞嘧啶(5-mc)免疫熒光抗體(美國CST公司),熒光二抗(中國北京中杉金橋),柱形核酸純化產品、Prime-ScriptTMRT Master Mix反轉錄試劑盒、TB Green Premix Ex TaqTMⅡ實時熒光定量試劑盒(大連寶生物工程有限公司)、目的基因及內參基因引物(中國上海生工生物公司),其他試劑均為國產分析純。
MEHP染毒液配制:用適量的無菌DMSO標準品稀釋質量為0.5 g MEHP標準品,配制成濃度為1.80 mol·L-1母液,然后用無菌培養基梯度稀釋成0(對照組)、50、100、200、400、800μmol·L-1的染毒液備用。
1.2 TM-3細胞培養
復蘇TM-3細胞,離心棄掉凍存液,加入新配制濃度為10%的完全培養基,培養48 h后換液;待細胞增殖至對數生長期,吸棄舊培養基,加入2 mL PBS清洗,清洗結束后加入1 mL胰酶消化30 s,然后加入4 mL完全培養基終止消化,制成單細胞混懸液,平均分置兩個新培養瓶;新培養瓶中加入完全培養液定容至4 mL,混勻,于37℃、5%CO2、100%相對濕度培養箱中培養24~48 h,待細胞進入對數生長期,進行后續實驗。
1.3 CCK-8法檢測細胞活力
取處于對數生長期的TM-3細胞,胰酶消化后加入完全培養基配成細胞混懸液,然后吸取100μL加入96孔板(約7000個細胞/孔),置于37℃、5%CO2細胞培養箱中培養數小時。待細胞貼壁后棄去培養基并加入濃度為0、50、100、200、400、800μmol·L-15個梯度的MEHP染毒液,再將96孔板放置于37℃、5%CO2、100%濕度的細胞培養箱中孵育24 h。向各孔中加入10μL的CCK-8檢測液,37℃孵育1~2 h后,在酶標儀450 nm波長下檢測各孔光密度(OD)值并計算細胞活力(%)=[(染毒組OD-空白組OD)/(對照組OD-空白組OD)]×100%。
1.4 光學顯微鏡觀察細胞形態
取處于對數生長期的TM-3細胞,胰酶消化后加入完全培養基配成細胞混懸液,吸取1 mL細胞混懸液并加入9 mL完全培養基至15 mL的離心管中,分別吸取1 mL細胞懸液加入4個培養瓶中,并定容至4 mL,待細胞鋪滿瓶底60%~70%,加入上述5個梯度的MEHP染毒液,24 h后于光學顯微鏡下(×400)進行觀察。
1.5 5-mc免疫熒光法檢測細胞總甲基化水平
實驗原理:通過檢測5-mc的含量來推斷細胞整體甲基化水平,熒光信號強度可以直接反映細胞總甲基化水平的高低。
方法:用清潔蓋玻片(14 mm×14 mm)放入24孔板細胞培養孔中,然后接種少量細胞進行培養,待細胞爬片后(6~8 h),對細胞進行染毒并培養24 h,染毒結束后用PBS輕柔漂洗3次,每次5 min吸凈PBS后加入1 mL 4%多聚甲醛于室溫固定(20 min),然后去掉多余甲醛再用PBS輕柔漂洗3次;繼續加入0.3%Triton-100 1 mL,進行透化處理(40 min),清洗同上,繼續加入5%BSA溶液,室溫封閉1 h,吸盡BSA溶液,在每個爬片加入100μL一抗,4℃過夜,清洗同上;第2天,每個爬片加入100μL二抗,于室溫避光孵育1 h,清洗同上,最后在載玻片上加一滴抗淬滅劑,用鑷子取出爬片輕輕倒扣在載玻片上,在熒光顯微鏡下進行觀察。在相同熒光顯微鏡觀察條件下隨機選取3個視野拍照,并用Image J軟件計算平均單個視野下的熒光強度。
1.6 RT-PCR檢測DNA甲基轉移酶(DNMTs)mRNA表達水平
用柱形核酸純化試劑盒提取TM-3細胞總RNA,然后根據反轉錄試劑盒說明書進行cDNA合成,以此為模板進行PCR擴增(引物序列見表1),擴增條件:95℃30 s,95℃5 s,55℃30 s,40個循環。并以95℃10 s,65℃5 s,95℃5 s,測定熔解曲線,以β-肌動蛋白(β-actin)作為內參基因,DNMTs(包括DNMT1、DNMT3A、DNMT3B)相關基因mRNA相對含量用2-ΔΔCt方法進行計算。

表1 DNMTs相關基因引物序列
1.7 Hoechst33258熒光染色觀察細胞凋亡變化
TM-3細胞爬片同免疫熒光的操作過程,染毒結束后,用預冷的Buffer A洗滌細胞2次,加入1 mL的4%多聚甲醛溶液,固定細胞10 min,繼續用Buffer A洗2遍,最后滴加50~100μL Hoechst33258工作液,室溫染色10 min,水沖凈晾干,在相同熒光顯微鏡觀察條件下隨機選取3個視野拍照,并用Image J軟件計算平均單個視野下的熒光強度,熒光強弱可間接反映MEHP誘導細胞凋亡變化的程度。
1.8 統計學方法
數據采用SPSS 25.0統計軟件進行分析,每項實驗均重復3次以上,計量資料用均數±標準差(±s)表示,多組間的比較采用單因素方差分析,進一步兩兩比較用LSD法。檢驗水準取α=0.05。
2 結果
2.1 MEHP對TM-3細胞活力的影響
預實驗設置毒物濃度梯度為0、50、100、200、400、800μmol·L-1,染毒24 h后測定OD值;與對照組相比,細胞活力下降(P均<0.01),見表2。運用Graphpad prism 6.0計算MEHP的IC50為354.4μmol·L-1,因此選取MEHP終濃度200、400、800μmol·L-1作為后續實驗的染毒濃度。
表2 不同濃度MEHP作用24 h對TM-3細胞活力的影響(n=3,±s)
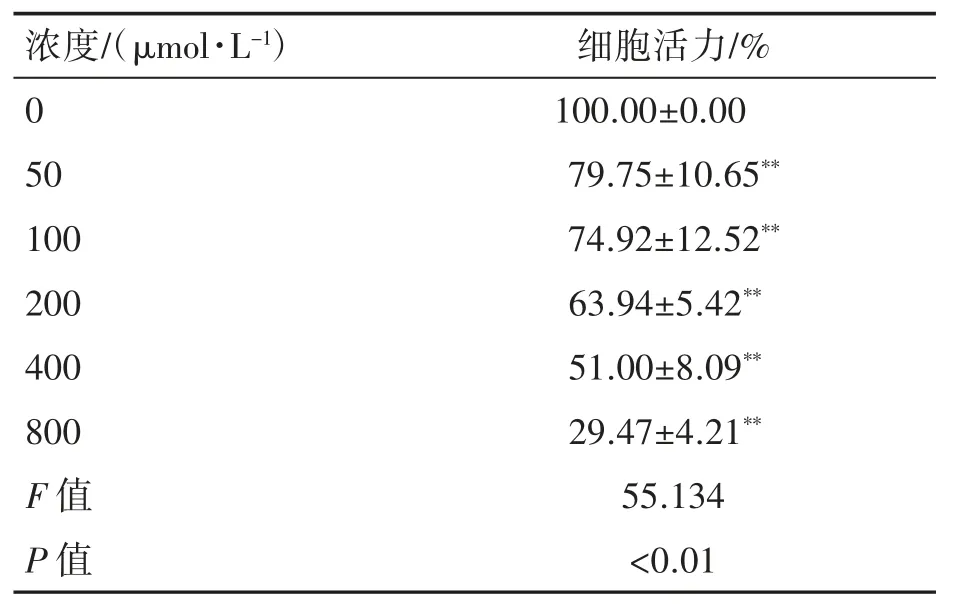
表2 不同濃度MEHP作用24 h對TM-3細胞活力的影響(n=3,±s)
與對照組相比**P<0.01。
?
2.2 不同濃度MEHP作用24 h后TM-3細胞形態學變化
正常細胞呈梭形、多邊形等不規則形狀生長,隨著染毒劑量的增加,貼壁細胞數量逐漸減少,細胞核呈現空泡化,條索狀細胞增多,且漂浮的死亡細胞數逐漸增加,見圖1。

圖1 不同濃度MEHP作用24 h后TM-3細胞形態學變化(×100)
2.3 MEHP對TM-3細胞總甲基化水平的影響
與對照組比較,200μmol·L-1組熒光信號最強,400μmol·L-1組次之,800μmol·L-1組最弱,不同濃度MEHP暴露均可引起TM-3細胞總甲基化水平降低(P均<0.01),見圖2、表3。

圖2不同濃度MEHP作用24 h對TM-3細胞5-mc表達水平的影響(×200)
表3 不同濃度MEHP作用24 h后TM-3細胞總甲基化水平的變化(n=3,±s)
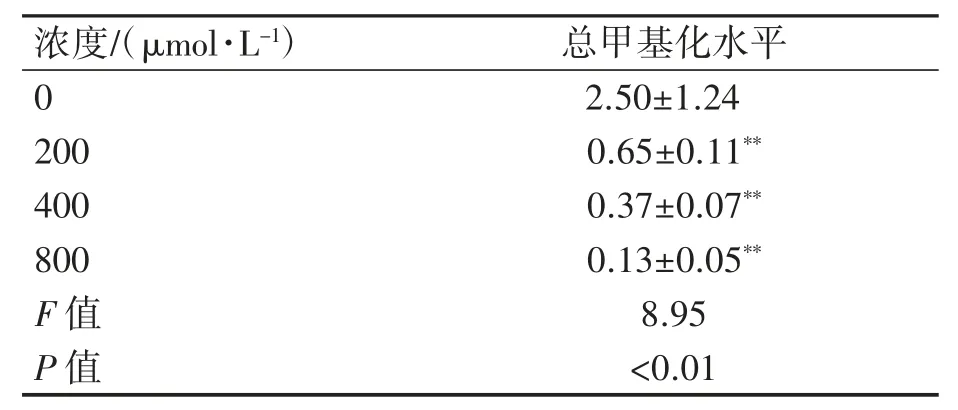
表3 不同濃度MEHP作用24 h后TM-3細胞總甲基化水平的變化(n=3,±s)
與對照組相比**P<0.01。
?
2.4 MEHP對TM-3細胞DNMTs mRNA表達水平的影響
RT-PCR結果顯示:與對照組相比,200μmol·L-1組DNMT1mRNA(1.15±0.08)、DNMT3BmRNA(2.28±0.15)相對表達水平均高于對照組(P<0.05或<0.01);DNMT3AmRNA(1.03±0.12)表達水平兩組間差異無統計學意義(P>0.05);400μmol·L-1組DNMT1mRNA(0.83±0.05)低于對照組(P<0.01),DNMT3AmRNA(1.91±0.44)和DNMT3BmRNA(2.50±0.09)表達水平高于對照組(P<0.05或<0.01);800μmol·L-1組DNMT1mRNA(0.50±0.08)低于對照組,DNMT3AmRNA(2.40±0.51)高于對照組(P<0.01),DNMT3BmRNA(1.02±0.01)表達水平和對照組相比差異無統計學意義(P>0.05),見圖3。
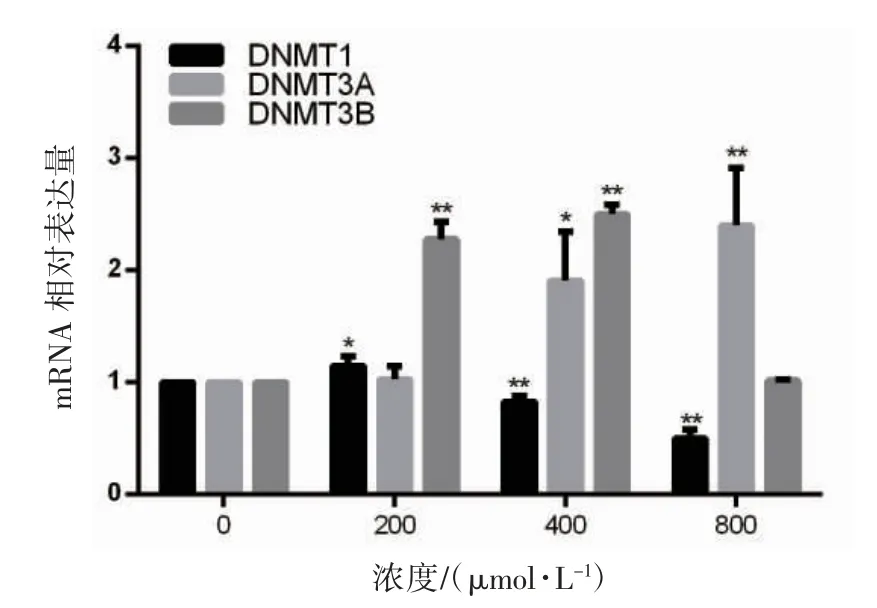
圖3不同濃度MEHP對TM-3細胞DNMTs mRNA相對表達水平的影響(n=3,±s)
2.5 MEHP對TM-3細胞凋亡水平的影響
Hoechst33258熒光染色顯示,不同濃度MEHP暴露,均可誘導TM-3細胞凋亡(P均<0.01),400、800μmol·L-1兩組可以觀察到明顯的染色質固縮,核濃染現象,凋亡細胞數目逐漸增多,見圖4、表4。
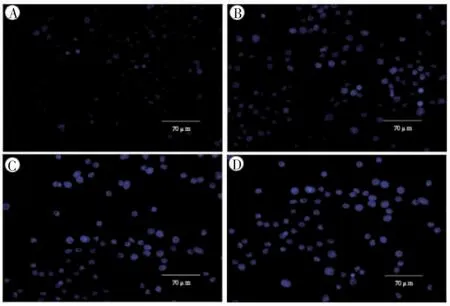
圖4 不同濃度MEHP作用24 h誘導TM-3細胞凋亡形態變化(×400)
表4 不同濃度MEHP作用24 h誘導TM-3細胞凋亡情況(n=3,±s)

表4 不同濃度MEHP作用24 h誘導TM-3細胞凋亡情況(n=3,±s)
與對照組相比*P<0.05,**P<0.01。
?
3 討論
關于PAEs類物質毒作用機制的研究進展,主要有三個方向:一是改變下丘腦-垂體-性腺軸的表達;二是誘導氧化應激損傷途徑;三是從表觀遺傳學的角度[5]。在環境污染物對人類健康造成影響的過程中,表觀遺傳學發揮著重要的作用,其中DNA甲基化是表觀遺傳學最主要的表達方式。DNA甲基化是指在DNMTs的催化作用下,將S-腺苷甲硫氨酸(SAM)中的甲基轉移到胞嘧啶和鳥嘌呤二核苷酸的第5位碳原子上,形成5-mc化學修飾的過程[6]。在DNMTs中,DNMT1作為哺乳動物最主要的維持甲基化酶,表達于復制狀態的增殖細胞,能夠優先催化復制后半甲基化的DNA雙鏈,使低甲基化的子鏈完全甲基化。DNMT3A和DNMT3B是重新甲基化酶,作用于未甲基化的DNA雙鏈。有研究報道[7],在人體尿液中檢測到DNA甲基化和羥甲基化過程的產物:5-甲基-2'-脫氧胞苷(5 mdC)和5-羥甲基-2'-脫氧胞苷(5 hmdC),且尿液中5 mdC和5 hmdC的濃度與接觸PAEs類物質的水平呈正相關關系。另一項研究表明:由DNA甲基化介導的精子活力,與低水平環境鄰苯二甲酸酯暴露呈正相關關系[8]。
本實驗結果顯示,與對照組相比,隨著MEHP染毒劑量的增加,細胞活力逐漸下降;光學顯微鏡觀察顯示,正常TM-3細胞呈梭形、多邊形等不規則形狀生長,隨著染毒劑量的增加,貼壁細胞數量逐漸減少,細胞核呈現空泡化,條索狀細胞增多,且漂浮的死亡細胞數逐漸增加;Hoechst33258熒光染色結果顯示:隨著染毒劑量增加,MEHP對DNA損傷程度加深,高劑量組的熒光信號最強,且能觀察到明顯的染色質濃染、核固縮,增加了細胞的凋亡水平。本課題組前期研究[9]結果顯示:MEHP染毒24 h后,細胞存活率呈現下降趨勢,MEHP染毒能夠誘導GRP78-ATF4-CHOP凋亡通路,導致細胞凋亡,能夠與本研究結果相互驗證[10]。5-mc免疫熒光結果顯示,MEHP導致TM-3細胞DNA甲基化整體水平降低,與對照組相比,200μmol·L-1染毒組熒光信號最強,400μmol·L-1染毒組次之,800μmol·L-1染毒組綠色熒光信號最弱;陳姣等[11]研究發現,MEHP可通過降低全基因組5-mc含量,從而促進前列腺癌的惡化、轉移。有研究報道[12],全基因組DNA的低甲基化可引起遺傳的不穩定性,誘發并促進腫瘤的惡化,是參與腫瘤進展的重要因素。另有研究表明,全基因組DNA低甲基化是細胞惡化的基本特征之一[13],與本研究與上述結果相近。與對照組相比,各組DNMT1和DNMT3BmRNA相對表達水平呈先升高后降低的趨勢,在200μmol·L-1組可能存在低劑量刺激作用,導致細胞整體甲基化水平升高,隨著染毒劑量增加,細胞整體甲基化水平逐漸降低,總體來說MEHP染毒導致TM-3細胞整體甲基化水平的降低;Li等[14]研究發現,鄰苯二甲酸二正丁酯(DBP)能夠通過降低DNMT3B的表達水平誘導異常的PTEN去甲基化,進而導致生殖毒性;鄭立娟等[15]的研究發現,非甾體類激素己烯雌酚能夠導致小鼠精母細胞整體甲基化水平的降低,DNMTs蛋白和mRAN的相對表達水平也發生異常改變。上述發現與本研究結果相類似。
本次實驗研究的不足之處:首先在檢測細胞整體甲基化水平方面,僅選取了5-mc免疫熒光技術進行定性檢測,并未進行一些定量研究;其次在DNMTs表達水平方面,并未對其蛋白翻譯水平進行檢測,也未加入相關的甲基化抑制劑進行驗證。因此在后續的實驗中,將會更加完善MEHP對DNA甲基化水平影響的實驗方法,進一步深入探討表觀遺傳學在MEHP致雄性生殖毒性中的作用。

