刺參腐皮綜合征發生的分子調控機制研究進展
李成華
(1.寧波大學 教育部應用海洋生物技術重點實驗室, 浙江 寧波 315832;2.青島海洋科學技術國家實驗室海洋漁業科學與食品產出功能實驗室,山東 青島266071)
海參為無脊椎動物,隸屬于棘皮動物門海參綱,具有六億多年的歷史,全世界約有1 200余種,其中印度洋、西太平洋海區是世界上海參種類最多、資源量最大的區域。刺參ApostichopusjaponicusSelenka(1867)作為海參綱的主要經濟養殖品種,位列世界八大珍品之一,也是中國主要消費的海參品種,具有悠久的飲食歷史和文化。
刺參重要的經濟和文化價值極大地推進了其養殖業的發展,20世紀90年代,山東和遼寧沿海地區出現了刺參的規模化養殖;2011年開始,刺參養殖開始逐漸向福建和浙江拓展,成為刺參規模化養殖的新興地區。目前,中國刺參養殖區主要集中在遼寧的大連、盤錦、錦州、葫蘆島等,山東的煙臺、青島等,福建的霞浦等。根據2020年中國漁業年鑒統計顯示,2019年中國刺參養殖產量為1.717×105t,苗種產量為5.25×1010頭,經濟產值達到300億元,已成為中國海水養殖業的重要支柱產業[1]。不僅如此,還開拓了以新加坡、中國香港、韓國、日本、美國、菲律賓、印度尼西亞等國家和地區為中心的貿易和消費市場。然而,伴隨著養殖規模和密度的擴大,病害問題也日益凸顯,其中首當其沖的就是刺參腐皮綜合征,每年給刺參養殖業造成的經濟損失高達30~40億元,逐漸成為刺參產業健康發展的瓶頸,對生態環境和食品安全也造成巨大威脅。因此,構建綠色健康的刺參疾病防控策略意義重大。本文中,依托作者團隊十余年的研究進展,綜述了刺參免疫防御途徑和代表性病原致病機制研究進展,同時銜接環境因子對宿主和病原的調控作用,旨在為刺參病害綠色防控和未來研究提供指導和幫助。
1 刺參腐皮綜合征流行病學調查及病原鑒定
中國水產科學研究院黃海水產研究所從2002年首次開始針對山東地區養殖刺參疾病進行了流行病學、病原學和防治策略的研究,到目前為止,已對刺參養殖各階段的易發病有了較為系統的理解。
1.1 流行特征
刺參腐皮綜合征(skin ulcer syndrome,SUS)是當前對刺參養殖產業危害最為嚴重的疾病,又稱化皮病、爛皮病等。該病于2003年2月在山東省榮成首次發生,自2004年開始在全國范圍內大規模暴發,波及中國從北方到南方的主要刺參產區。
流行病學調查發現,該病多發生于每年水體溫度較低的1—4月份(此期水溫一般在 8 ℃以下),1—3月份為該病的高峰期[2-3],發病快且涉及養殖區廣,一旦發病很快就會蔓延全池,死亡率高達90%以上,屬急性死亡。
1.2 病癥
該病的發病癥狀一般分3個階段,發病初期刺參厭食并伴有“搖頭”現象,口部出現局部感染并腫脹,口圍膜松弛,觸手黑濁,對外界刺激反應遲鈍,活動能力和附著力變弱;中期感染的刺參身體收縮、僵直,口部出現小面積潰瘍并形成白色斑點,肉刺發白,此時大部分刺參出現排臟現象;感染后期隨著病情的加重,刺參體表潰爛部位增多,出現大面積潰爛,最后死亡,并自溶為“鼻涕狀”的膠體,附著物上留有一白色印痕(圖1)[3-4]。

A—健康刺參;B、C—腐皮綜合征I期;D、E—腐皮綜合征II期;F、G—腐皮綜合征III期;BW—體壁;N—正常組織。
1.3 病原
目前,已經鑒定的刺參腐皮綜合征病原主要有以燦爛弧菌Vibriosplendidus為典型代表的弧菌Vibriosp.,以及假交替單胞菌屬細菌Pseudoalteromonasnigrifaciens和嗜水氣單胞菌Aeromonashydrophlia等。2006年,王印庚等[6]對養殖刺參保苗期的腐皮綜合征發病幼參進行了詳細的病原學分析,發現假交替單胞菌屬細菌和另外一種弧菌屬細菌是優勢菌。同年,張春云等[3]從患腐皮綜合征刺參的病灶部位分離得到燦爛弧菌KL-1,經人工回感染試驗,發現該優勢菌株引發刺參發病的癥狀與自然發病刺參的癥狀相同,其對健康刺參有較強致病和致死作用,并從人工感染發病的刺參個體內分離到大量形態單一的菌株,其形態特征和生化特征與KL-1菌株完全相符,表明燦爛弧菌是刺參腐皮綜合征的主要致病菌。從自然發病的幼參病灶部位還分離到一種優勢菌FP-1,經人工回接感染試驗證實該細菌對健康幼參有致病作用,腹腔注射FP-1,能引起受試刺參半數死亡,且發病刺參出現的癥狀與自然發病刺參的癥狀相同,回接感染后再分離得到的FP-3與FP-1為同一種細菌,符合“柯赫法則”;根據普通細菌學表型特征對FP-1進行鑒定,可初步認為細菌FP-1為弧菌屬細菌,但對其16S rDNA測序并結合系統發育樹的分類學分析結果表明,FP-1為假單胞菌屬細菌;進一步分析得知,假單胞菌屬細菌具有許多與弧菌屬細菌相同的生化特征,如革蘭氏陰性桿菌、極生單鞭毛、氧化酶陽性和發酵葡萄糖不產氣等特征,綜合這兩種細菌鑒定方法所得的結果最終證明了FP-1為假單胞菌屬細菌。由此可見,對刺參腐皮綜合征病原的種屬鑒定需要結合分子生物學和生理生化測定等多種方法。另外,芽孢桿菌屬細菌也出現在患腐皮綜合征刺參的腸道中,他們也被認為是導致腐皮綜合征發生的重要致病菌之一。
病毒亦是刺參腐皮綜合征的重要病原種類。目前關于病毒引起的刺參病害報道較少,且研究不夠深入,主要涉及刺參組織液或病變組織中病毒顆粒形態觀察,未對病毒的核酸組成、感染機制和病毒分類進行深入研究。2005年,王品虹等[7]用電鏡負染技術檢測表皮潰爛及黏液增多的刺參組織提取液,觀察到大量具有囊膜近似球形樣的病毒粒子,完整的病毒粒子直徑為80~100 nm,囊膜厚6~10 nm,核心結構直徑35~45 nm,呈六邊形;應用超薄切片技術對刺參的觸手臂、疣足、觸手頂部、背腸血管、呼吸樹和腸等組織的病毒感染狀況進行觀察,發現該種病毒粒子大量存在于所檢測的各組織內;感染細胞的超微結構表現為大量細胞器崩解形成空泡結構,并出現“髓袢樣”結構等病理變化,根據觀測結果,該病毒是一種無包涵體病毒。2008年,Deng等[8]通過超薄切片的電鏡觀察,并從出現排臟和皮膚潰爛癥刺參消化道、呼吸樹的細胞胞漿中分離獲得直徑為75~200 nm的球形病毒顆粒,但在健康的刺參中檢測不到病毒顆粒。將健康刺參暴露于含有病毒顆粒的培養基中,無論是否添加細菌懸浮液,其發病癥狀與可分離病毒的刺參相同,且死亡率為90%~100%;形態學觀察表明,病毒形態各異,表明并不是一種病毒引起的病癥,且與已報道的貝類病毒具有很大差異,然而遺憾的是并未對該病毒進行分類地位的確定。2010年,Liu等[9]亦從患腐皮綜合征的刺參中分離到具有雙層囊膜、直徑為100~250 nm的球形病毒粒子,提取該病毒的粗提物并感染健康刺參,刺參出現包括觸須活動減少、背部乳頭狀足部衰減、腸壁周圍腫脹和腹部潰瘍等病癥。
2 燦爛弧菌的致病機制
刺參在發育過程中的各個階段,均易被病原微生物感染,導致刺參疾病的發生。病原菌引起宿主感染的主要毒力因子包括蛋白酶、溶血素、Ⅲ型分泌系統、黏附因子和鐵攝取系統等,通過黏附、分泌胞外毒力因子和營養競爭等多個過程,達到其在易感宿主中的入侵和定植。燦爛弧菌是導致刺參腐皮綜合征發生的主要病原菌之一,目前的研究表明,燦爛弧菌的黏附因子和胞外產物等過程均與其毒力相關。
2.1 病原菌黏附
黏附作用對病原菌的致病力有著至關重要的作用,其具有抵抗黏液沖刷、細胞纖毛運動和腸蠕動等過程的清除作用,有利于病原菌在宿主體表和體內定居。Dai等[10-11]分別采用5-(4,6-二氯三嗪基)氨基熒光素[5-(4,6-dichlorotriazinyl) aminofluorescein,5-DTAF)]的化學標記法和綠色熒光蛋白(Green fluorescent protein,GFP)的生物標記法,對燦爛弧菌進行了熒光標記,進而對標記菌在刺參體內的分布進行了追蹤(圖2),結果表明,燦爛弧菌在感染初期可侵染到刺參的呼吸樹、觸手、腸道、肌肉和體腔液等各個組織中,隨著感染時間延長至48 h和96 h,熒光標記的燦爛弧菌可在腸道和呼吸樹中被檢測到,而在其他組織中菌體的量極少。因此推斷,呼吸樹和腸道是燦爛弧菌感染刺參的主要組織器官。
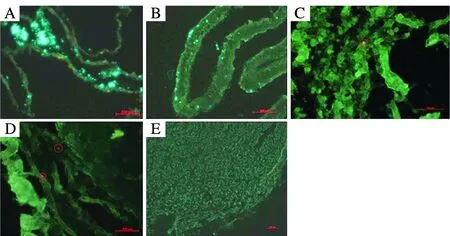
圖2 熒光顯微鏡下觀察刺參呼吸樹(A)、腸道(B)、體壁(C)、觸手(D)和肌肉(E)中GFP標記的燦爛弧菌[11]
弧菌的黏附因子一般可分為兩大類:菌毛黏附素和非菌毛黏附素,前者包括鞭毛和纖毛等,后者包含脂多糖和外膜蛋白等。Dai等[12]采用基因過表達技術研究了燦爛弧菌中FliC(鞭毛蛋白亞基)是否參與菌體黏附,結果表明,fliC基因過表達菌株的生物膜形成能力和運動能力均明顯高于野生型菌株,且fliC基因的過表達導致燦爛弧菌對刺參肌肉、呼吸樹和腸道組織中的黏附效率增加,而對體壁和觸手的黏附率無明顯影響,因此,FliC介導的黏附具有明顯的組織特異性。除了使用FliC聚合而成的鞭毛絲作為黏附因子,二氫脂酰胺脫氫酶(dihydroacrylamide dehydrogenase,DLDs)是目前已知的燦爛弧菌另一黏附因子。Dai等[10]制備了DLD1和DLD2的多克隆抗體,并對菌體表面的DLD1和DLD2蛋白進行封閉,DLD1、DLD2抗體封閉后的菌體對刺參體腔細胞的黏附率分別為7.5%、12.5%,均顯著低于野生型菌株的黏附率25%,封閉后的菌體對刺參各組織的黏附率亦均有所下降,對腸組織的黏附更具有特異性。
2.2 燦爛弧菌的致病因子
2.2.1 金屬蛋白酶Vsm 金屬蛋白酶是多種病原菌中公認的重要致病因子。燦爛弧菌中的vsm基因(VS_RS05940)編碼金屬蛋白酶,是燦爛弧菌中第一個被鑒定的胞外毒力因子[13-14]。研究者分別向同等刺參體腔細胞中加入70、90、100 μL純化的重組Vsm蛋白(50 mmol/L),發現加入不同量Vsm蛋白后的細胞存活率約下降至對照組的86%、79%和72%,表明燦爛弧菌的Vsm對刺參體腔細胞具有明顯的細胞毒性[15]。
2.2.2 鐵離子吸收 鐵是宿主和病原微生物必需的營養素。鐵離子的氧化還原電位是導致鐵離子產生生物毒性的主要原因,因此,細胞內鐵離子的濃度和分布受到嚴格的控制。考慮到幾乎所有病原微生物對鐵的絕對需求,宿主通過限制入侵病原微生物的生物可利用性鐵成為宿主先天免疫系統的重要組成部分。病原微生物在宿主體內奪取鐵離子的能力及對鐵離子的利用,已經成為多種病原微生物致病過程的重要組成部分。
研究者從銅綠假單胞菌培養物中經過Cu2+的親和層析獲得了對Fe3+具有高親和力的熒光鐵載體pyoverdine,體外抑制試驗表明,pyoverdine(100 μL, 50 mmol/L)可顯著抑制燦爛弧菌在2216E培養基中的生長;采用pyoverdine對刺參養殖海水進行預處理,可顯著降低燦爛弧菌感染刺參的效率,實驗室條件下浸泡感染試驗顯示,pyoverdine對仿刺參具有90%以上的相對保護效率,這意味著鐵離子對燦爛弧菌感染刺參并導致刺參發病過程具有重要的作用[15]。進一步研究表明,在燦爛弧菌中至少存在兩條鐵吸收通路[16-17]。第一條通路是鐵載體介導的Fe3+吸收,燦爛弧菌可以分泌異羥肟酸鹽類型的鐵載體,通過鐵載體絡合環境中的Fe3+形成鐵載體- Fe3+復合物,鐵載體-Fe3+復合物進而可以被錨定在細胞膜上的識別蛋白IutA受體識別,并將鐵離子轉運到細胞內供菌體自身生長及致病所需;第二條通路是亞鐵離子吸收通路,在燦爛弧菌體內,酪氨酸代謝通路中的關鍵酶羥苯丙酮酸二加氧酶(hydroxyphenylpyruvate dioxygenase,Hppd)催化形成尿黑酸(homogentisic acid,HGA), 在特定條件下HGA聚合形成多聚物HGA-黑色素(HGA-melanine),HGA-黑色素具有鐵離子還原能力,可在菌體外將Fe3+還原為Fe2+,再通過位于細菌周質空間的FeoA和FeoB介導的亞鐵離子轉運系統,將Fe2+轉運至菌體內部,形成了燦爛弧菌中亞鐵離子攝取途徑[18](圖3)。
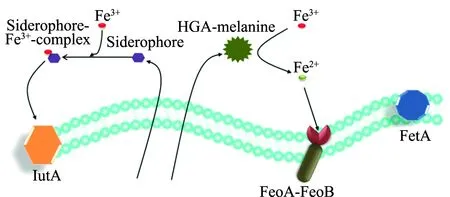
圖3 燦爛弧菌體內存在的鐵吸收通路
多條鐵攝取通路的存在有利于細菌抵抗不利的水體和宿主環境。具有全局性調控作用的鐵離子吸收調節蛋白(ferric uptake regulator, Fur)是細菌響應環境中鐵離子水平,進而調節細菌基因表達并做出響應的關鍵調節因子。利用實時熒光定量PCR技術檢測低鐵環境下燦爛弧菌中fur基因的表達,在燦爛弧菌培養環境下加入鐵離子螯合劑8-羥基喹啉,燦爛弧菌fur基因的表達顯著降低,在RNA水平上驗證了燦爛弧菌的Fur確實具有響應環境中鐵離子濃度的功能[19]。
2.2.3 溶血素 4-羥苯丙酮酸雙加氧酶(4-Hydroxyphenylpyruvate dioxygenase,4-HPPD)是燦爛弧菌中研究較為詳細的燦爛弧菌溶血素,也是鐵離子依賴型的非血紅素加氧酶,其在酪氨酸分解代謝途徑中起關鍵作用。Liang等[20]首先測定了Vshppd的表達,在刺參體腔液的刺激下,Vshppd基因表達在60 min內顯著上調60多倍;用綿羊血細胞進一步測試發現,燦爛弧菌Vshppd蛋白具有明顯的溶血活性,并具有明顯的劑量依賴性;MTT法測定結果顯示,Vshppd蛋白(3~4 μg/μL)對刺參細胞具有明顯的毒性作用,且隨著蛋白質量濃度的增加,刺參體腔細胞的存活率逐漸下降;為了進一步驗證Vshppd在致病過程中的作用,利用基因框內缺失原理,構建了Vshppd基因敲除的燦爛弧菌減毒菌株(MTVs),用野生型(WTVs)和MTVs燦爛弧菌分別感染刺參后,感染了野生型菌株的刺參表現出與腐皮綜合征相關的相同癥狀,并且表皮腐爛面積大,而感染MTVs的燦爛弧菌對刺參的致死率大大降低,突變型菌株感染的刺參只在體表上偶有癥狀不明顯的白點,同時刺參的半致死劑量(LD50)由野生型的5.129×106CFU/mL升高到突變型的2.606×1010CFU/mL,證實了燦爛弧菌Vshppd在病原脅迫中的重要致病作用。
2.2.4 分泌系統 一般認為,細菌有Ⅰ~Ⅳ型分泌系統,不同的病原菌通過特有的分泌系統將毒力因子分泌到細胞外發揮作用,從而導致宿主發病。目前已有研究表明,燦爛弧菌中含有與鞭毛同源性較高的fT3SS,其分泌的效應蛋白參與了燦爛弧菌的致病過程。Zhuang等[21]借助自殺性質粒pDM4,采用基因框內缺失突變的方法構建了燦爛弧菌T3SS ATPase突變菌株ΔvscN,結果表明,T3SS ATPase的敲除導致該菌的LD50升高,該突變體聚集到刺參體腔細胞表面的能力明顯降低,且潛在效應因子Hop不能如野生型菌株中的Hop一樣定位于刺參體腔細胞內,而且突變體中Hop的表達在RNA和蛋白質水平上均明顯降低。這與該學者之前得出的重組的rHop蛋白對刺參體腔細胞具有明顯細胞毒性的結果相一致[22]。這表明,Hop是燦爛弧菌的Ⅲ型分泌系統效應因子,也是迄今為止唯一得以鑒定的燦爛弧菌Ⅲ型分泌系統效應因子。
3 刺參應對燦爛弧菌感染的免疫調節機制
病原菌在進化過程中發展了多種策略以攻擊宿主,其中最重要的一種方式就是通過毒力蛋白對宿主細胞造成損傷。與此同時,疾病的發生還與宿主的免疫防御息息相關。作為無脊椎動物的刺參只存在先天性免疫,缺乏脊椎動物中的獲得性免疫。無脊椎動物主要通過一類被稱為模式識別受體(pattern recognition receptors,PRRs)的免疫識別分子識別入侵病原,進而啟動細胞免疫和體液免疫抵抗或清除病原[23-24]。
3.1 刺參細胞免疫
3.1.1 體腔細胞分類 國內外學者對棘皮動物體腔細胞的研究已經長達30年之久。隨著研究的人員、目的、手段等不同,刺參體腔細胞多樣且不斷變化,其體腔細胞類型至今無統一的標準,體腔細胞和血細胞的確切關系也未見描述。Eliseikina等[25]在研究刺參和瓜參Cucumariajaponica時發現,體腔細胞可以分成祖原細胞、吞噬細胞、有空泡細胞、小(幼)桑椹細胞、桑椹細胞(Ⅰ、Ⅱ和Ⅲ型)、晶體細胞和震顫細胞。劉曉云等[26]利用電鏡技術將刺參體腔細胞分為大顆粒細胞、小顆粒細胞、透明細胞和淋巴樣細胞。而有關刺參血細胞的論述尚未見報道,有學者認為,體腔細胞相當于血細胞,血液類似于體腔液。李華等[27]將刺參體腔細胞分為6類,即淋巴樣細胞、球形細胞、變形細胞、紡錘細胞、透明細胞和結晶細胞,其中以淋巴樣細胞、球形細胞和變形細胞為主,透明細胞、紡錘細胞數量次之,結晶細胞數量最少,并依據細胞形態、運動能力、細胞內顆粒大小,將球形細胞又分為3個類型,即Ⅰ型球形細胞(顆粒小,細胞無運動能力)、Ⅱ型球形細胞(顆粒較小,細胞伸出刺狀偽足)和Ⅲ型球形細胞(顆粒較大,細胞能做阿米巴運動)(圖4)。

A—淋巴樣細胞;B—球形細胞,光鏡下球形細胞呈球形,Ⅰ型球形細胞胞核被胞質中大量的小顆粒遮住,細胞無運動能力,直徑為5~10 μm(a),Ⅱ型球形細胞胞核被胞質中大量的小顆粒遮住,細胞外質伸出很多刺狀偽足,活體觀察猶如“太陽”狀,細胞直徑為7~12 μm,刺狀偽足長為4~7 μm(b),Ⅲ型球形細胞,直徑為6~13 μm,靜止時呈球形,細胞核被許多顆粒狀小球體遮住(c),活體觀察細胞可做阿米巴運動,伸出鈍狀偽足(d);C—變形細胞;D—透明細胞;E—紡錘細胞;F—結晶細胞。
3.1.2 體腔細胞的免疫功能
1)趨化作用。趨化作用是指細胞沿濃度梯度向化學刺激物做定向移動。當病原微生物入侵機體后,受損細胞會釋放某些化學物質,吸引大量的炎癥細胞,并表現為局部炎癥反應,此時鏡下觀察受損組織可見大量炎癥細胞浸潤現象。通過對腐皮綜合征刺參體壁病理切片觀察,發現其患病組織具有類似于高等動物的炎癥現象,出現明顯的白細胞增多、細胞浸潤、組織空泡和肌肉纖維斷裂等炎性組織學特點,同時在患腐皮綜合征的刺參體壁中檢測到了炎癥標志分子NO,其含量比正常組刺參顯著上調1.54倍,總NOS(TNOS)顯著上調1.50倍,誘導型NOS(iNOS)顯著上調1.24倍[28]。
2)細胞殺傷功能。細胞殺傷功能是刺參體腔細胞免疫功能之一,又被稱為細胞毒性。吞噬細胞和桑椹細胞均可產生并釋放殺菌物質來分解外來物質,如脂肪酶、過氧化物酶和絲氨酸蛋白酶等。研究發現,天然狀態的刺參體腔液在體外狀態下處理燦爛弧菌有明顯的殺傷作用,而熱處理過的刺參體腔液在體外狀態下處理燦爛弧菌殺傷能力明顯減弱,并且這種效果隨著燦爛弧菌濃度的升高而減弱,表明刺參體腔細胞的殺傷功能可能是通過蛋白酶活性來實現的[15]。
3)吞噬功能。細胞吞噬作用是刺參體腔細胞免疫的主要防御機制,體腔液中的吞噬細胞能夠有效地識別并吞噬外源粒子,然后將其降解或直接排出體外。大多數免疫反應都是由具有吞噬作用的變形細胞介導的。2016年,Wang等[29]將整合素抗體與刺參體腔細胞孵育,測定了體腔細胞對熒光微球菌的吞噬能力,證明了刺參體腔細胞膜上的整合素蛋白具有促進細胞吞噬的功能。2019年,Yue等[30]鑒定了雷帕霉素靶蛋白復合物2型(mechanical target of rapamycin complex 2,mTORC2)蛋白亞基Rictor對刺參體腔細胞內吞具有正調控作用。為進一步明確mTORC2介導的細胞內吞機制,2021年,Lv等[31]進而檢測了Rictor被干擾后,調節內吞作用的AGC激酶家族成員SGK1、PKCα和AktSer473位點的表達水平,結果顯示,Rictor被干擾抑制后,SGK1和PKCα的表達水平及AktSer473位點的磷酸化水平均受到顯著抑制,而Akt含量未發生變化,這表明,mTOR抑制劑雷帕霉素處理則不能影響SGK1和Akt的表達,但能夠顯著抑制PKCα的表達水平及AktSer473位點的磷酸化水平。上述結果揭示了Akt的磷酸化修飾可能參與mTORC2介導的刺參體腔細胞內吞,而Rictor可能獨立于mTORC2調節SGK1。
4)細胞凋亡。細胞凋亡是細胞為維持內環境穩定,由基因調控的、自主有序的生理性死亡。目前,在刺參中已擴增得到多個細胞凋亡相關基因。2016年,Shao等[32]通過RACE技術擴增得到了4個刺參caspases同源基因,即caspase-2、caspase-3、caspase-6和caspase-8,qPCR分析發現,這4個caspases基因在刺參各個組織中的分布特征及燦爛弧菌誘導后的表達水平均差異顯著,表明不同的caspases基因在免疫反應中發揮不同功能。隨著研究的深入,發現刺參可通過多種途徑誘導其體腔細胞凋亡的發生以對抗燦爛弧菌的感染。
①細胞凋亡線粒體途徑的調控:燦爛弧菌感染可促進刺參組織蛋白酶B活性增加,影響線粒體膜電位的變化并促進細胞色素c的釋放,進而激活下游效應因子caspases-3以執行細胞凋亡[33-34];通過刺參活體體腔注射Bax(Bcl-2-associated X) siRNA并結合拯救試驗,進一步證實了Bax能促進線粒體介導的細胞凋亡[35],而Bcl-2(B-cell lymphoma 2)則能抑制細胞色素c的釋放進而抑制細胞凋亡[36];此外還發現,刺參親環素A可作為NF-κB輔助因子促進其核移位,進而調控Bcl-2表達并誘導細胞凋亡發生[37]。
②細胞凋亡死亡受體途徑的調控:2020年,Zhao等[38]首次闡述了刺參中存在以死亡受體介導的細胞凋亡,caspase-8作為死亡受體介導的凋亡途徑中的關鍵啟動子,其具有 FADD樣DED結構域,能夠與死亡受體蛋白FADD結合,形成死亡復合體,進而誘導下游caspase基因表達,誘導細胞凋亡。
5)細胞自噬。細胞自噬是指細胞通過雙層膜包裹胞質物、入侵病原或損傷的細胞器、蛋白質等待降解物形成自噬體,并與溶酶體融合形成自噬溶酶體將包裹物消化降解,從而實現細胞自身的能量物質代謝和細胞器更新的胞內過程[39-40]。其作為一種維持細胞內環境穩態、實現自我更新的進化保守機制,同時也是免疫防御機制的重要組成部分,在機體免疫防御中發揮重要功能[41]。通過對刺參基因組分析發現,刺參中也存在眾多自噬相關基因,且自噬標志性蛋白已在相關文獻中報道[ 42],表明刺參中存在細胞自噬。但關于刺參在病原感染下的自噬完整通路,還有待深入研究。
6)細胞焦亡。細胞焦亡是一種程序性細胞死亡,具有與細胞壞死相似的形態學特征,如細胞質膜上會有孔的形成、細胞腫脹、細胞質膜破裂,隨后內容物釋放到細胞質外,引發組織急性炎癥反應等[43]。經典的炎癥小體主要通過細胞質內的模式識別受體(如NLR家族蛋白等)識別多種病原體或宿主源性的危險信號來組裝,如NLRC4炎癥小體,主要由細胞內的模式識別受體NLRC4、接頭蛋白ACS和炎性caspase-1前體組裝而成,可以激活炎性caspase-1蛋白[44]。在刺參中,存在模式識別受體NLRC4[45]或NLRP3[46],但在其基因組中未找到GSDMD蛋白和IL-1β。刺參caspase-1可促進HEK293細胞GSDMD和IL-1β的表達[47],表明刺參中可能也存在細胞焦亡,但還需要更深入的研究來進一步證實。
3.2 刺參免疫因子功能
3.2.1 Toll樣受體信號通路 Toll樣受體(toll-like receptor,TLR)屬于固有免疫病原模式識別受體,可識別入侵的病原微生物蛋白、核酸和脂類及其在反應過程中合成的中間產物和代謝產物,如革蘭氏陰性菌的脂多糖(LPS)、革蘭氏陽性菌的肽聚糖和病毒的雙鏈RNA等,這些都屬于分子結構高度保守的病原相關分子模式(pathogen-associated molecular pattern,PAMP)。TLR通過對PAMP的識別,快速激活包括接頭蛋白、信號復合體和轉錄因子復合體負責的細胞內信號級聯反應,最終導致機體產生促炎細胞因子、抗炎細胞因子及趨化因子。
刺參Toll樣受體成員分子已基本鑒定完成(圖5),其中包括TLR受體2個成員分子(TLR3 和 Toll),TLR通路正調控蛋白3個[關鍵接頭分子-髓樣分化因子88(MyD88)、壞死因子受體相關因子6(TRAF6)和MyD88下游的激酶-IL-1R相關激酶1、4 (IL-1R-association kinase 1、4, IRAK 1、4)],以及NF-κB的2個亞基(Rel和p105)。
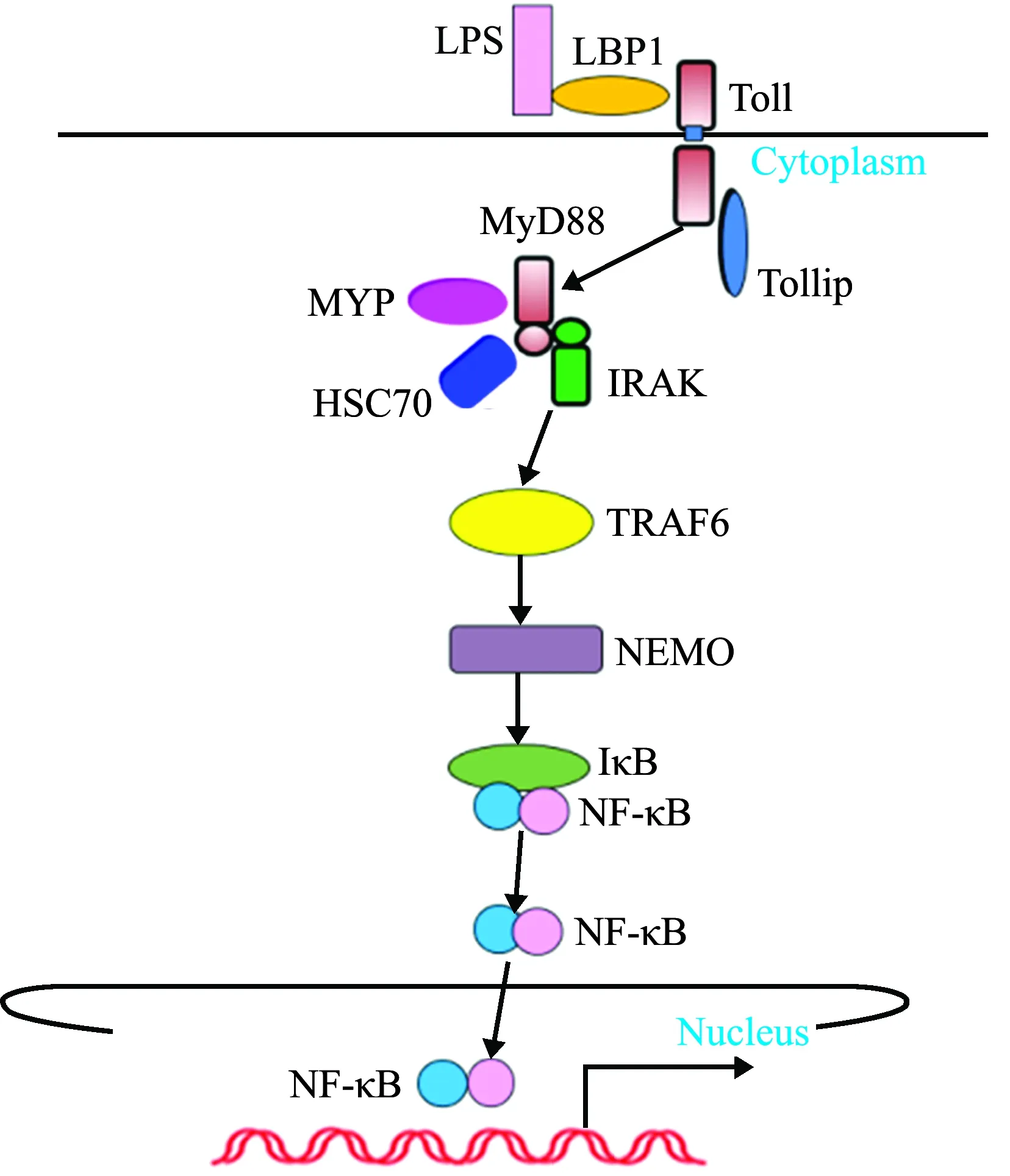
圖5 刺參Toll樣受體模式圖
1)TLR3和Toll的免疫功能分析。2013年,Sun等[48]首次從刺參體腔細胞中克隆得到了兩個TLRs基因TLR3和Toll,SMART結構預測表明,TLR3 和 Toll氨基酸序列均具有典型的TLR結構,即胞外亮氨酸重復序列LRR區、跨膜區(transmembrane, TM)和胞內TIR(toll/interleukin-1 receptor)區,說明TLR在無脊椎動物進化過程中是高度保守的;系統進化分析發現,刺參TLR3和 Toll 分別與脊椎動物類V-TLR、原口動物 P-TLRs聚為一支,表明刺參中存在兩種不同類型的TLR;采用病原革蘭氏陽性菌、革蘭氏陰性菌、真菌和病毒類似物,如肽聚糖(peptidoglycan, PGN)、脂多糖(lipopolysaccharides, LPS)、酵母聚糖(zymosan A)和聚肌胞苷酸(polyinosinic-polycytidylic acid, Poly I:C)脅迫刺參體腔細胞,熒光定量分析表明,這兩個基因的表達模式在刺參不同組織中針對不同的刺激有所不同,即在PGN刺激下,TLR3和Toll基因在體腔細胞中的表達變化最顯著,在LPS和Poly I:C刺激下,兩個基因在管足中表達變化最顯著,在Zymosan A刺激下,兩個基因在呼吸樹中表達變化最顯著。由此推測,刺參TLR3和Toll 在對抗細菌感染過程中發揮著重要作用且功能上可能存在差異。
2)MyD88的鑒定及功能解析。MyD88是TLR信號轉導中觸發先天免疫下游級聯反應的關鍵接頭分子。Lu等[49]分離并鑒定了MyD88基因全長cDNAs序列,該因子與哺乳動物、果蠅直系同源物具有非常高的結構保守性,預測的MyD88氨基酸序列中,存在一個典型的死亡域(death domain,DD)和一個保守的Toll / IL-1R(TIR)結構域;在燦爛弧菌攻毒試驗中,刺參MyD88和TRAF6基因的表達水平均顯著升高,但TRAF6升高的幅度更大,持續時間更長。上述結果表明,MyD88和TRAF6可能在刺參抗菌反應中起重要作用。
在不同物種中TLR信號通路的激活通常涉及不同的相互作用蛋白。Lv等[50]通過GST-pull down試驗鑒定了與刺參MyD88結合的4個蛋白,分別為MYP(major yolk protein)、IRAK1、HSC70(heat shock cognate protein 70)和TIR結構域蛋白;通過免疫共沉淀試驗發現,GST-HSC70和GST-MYP融合蛋白可分別與刺參MyD88結合,激光共聚焦顯微鏡觀察顯示,MyD88、HSC70和MYP均共定位于細胞質,這表明,HSC70和MYP可以與MyD88相互作用;該研究者進一步通過轉染MyD88、HSC70、MYPsiRNA檢測TLR信號通路的變化以探究HSC70和MYP是作為MyD88信號激活過程中所必需的輔助分子還是直接激活分子,結果顯示,MyD88基因被成功干擾后,IRAK1和p105 mRNA顯著降低,且MyD88蛋白表達顯著降低;此外,在HSC70和MYP基因敲除后,IRAK1和p105 mRNA均顯著降低;Western blot分析顯示,MyD88、MYP和HSC70基因敲除48 h后,p50蛋白表達水平顯著降低。這表明,MYP和HSC70是作為MyD88依賴的信號通路的輔助分子參與信號級聯反應的。
3)IRAK1和IRAK4的功能解析。Lu等[51]通過RACE技術,獲得了刺參IRAK1基因全長(GenBank:KJ918751),SMART分析顯示,IRAK1氨基酸序列包含一個長為93個氨基酸的保守的死亡結構域和一個285個氨基酸的典型的中心激酶結構域,在激酶結構域中還包含ATP結合位點和絲氨酸/蘇氨酸蛋白酶激活位點;進一步對刺參體腔細胞吞噬作用的檢測發現,IRAK1基因沉默能夠顯著促進刺參體腔細胞對燦爛弧菌的吞噬作用。
Cui等[52]克隆了刺參IRAK4基因全長,預測IRAK4氨基酸序列中具有典型的死亡結構域(10~113 aa)和激酶結構域(160~426 aa);在燦爛弧菌攻毒和LPS脅迫下,刺參IRAK4基因表達顯著上調,IRAK4基因被干擾后,TLR信號通路中下游成員IRAK1、TRAF6和p105在體內和體外試驗中,均顯著下調表達;在體外/體內沉默IRAK4后,刺參體腔細胞的凋亡水平分別增加了1.82倍和1.95倍。這表明,刺參IRAK4參與了Toll 樣受體信號通路的級聯激活應答。
4)NF-κB亞基的鑒定及功能分析。Wang等[53]鑒定了刺參中NF-κB的兩個亞基Rel和p105;預測的刺參Rel蛋白具有其他物種NF-κB蛋白的保守性,在N端包含一個279個氨基酸(50~328 aa)的RHD結構域,Rel還包含兩個保守的基序,其中一個為NF-κB蛋白共有序列RFRYPCEG,是所有NF-κB蛋白與DNA結合所必需的DNA識別環,NF-κB蛋白包含核定位信號(KRKR),是NF-κB蛋白核定位必不可少的結構域;預測的刺參p105蛋白在N端區域包含一個RHD同源結構域(53~348 aa)和一個帶有6個錨蛋白重復序列的C端IκB樣結構域和死亡結構域,p105還具有保守的DNA結合基序和核定位位點,當p105蛋白被磷酸化時,隨后的26S蛋白酶體降解并激活了p50亞基活性,使得核蛋白結合位點得以暴露,促進p50的核轉移。
Wang等[53]進一步測定了刺參經LPS脅迫0、10、30、60、120、240、360 min后體腔細胞中Rel、p50和p105基因的表達規律,結果顯示,p105基因的下調最為顯著,在10 min時與對照水平有顯著差異,在脅迫60 min后恢復到基線水平;在LPS脅迫10 min后,p50的mRNA表達顯著增加,達到最高水平,并在大約60 min后恢復到正常水平,這表明,p50的增加是由于刺參p105的快速降解引起的;Western blot分析表明,LPS脅迫顯著降低了胞漿中p105和p50蛋白的表達水平,LPS刺激120 min后,細胞核中p50蛋白表達顯著增加,LPS處理后360 min,胞漿中p105和p50蛋白水平有所恢復,但細胞核中未檢測到p50蛋白,同時還發現,在未經LPS刺激的體腔細胞中,Rel蛋白主要存在于細胞質中,而在LPS脅迫的刺參體腔細胞中,Rel蛋白向細胞核轉運,表達模式與p50蛋白相似。
5)NF-κB亞基的其他調控因子。Shao等[54-55]研究發現,在刺參一氧化氮合酶(NOS)、精氨酸酶(arginase)和精胺酶(agmatinase)的啟動子區分別存在多個NF-κB結合位點;通過共轉染鯉魚上皮瘤細胞(endothelial progenitor cells,EPC)發現,刺參Rel是NOS的關鍵轉錄因子,序列分析表明,-375~366 bp是NF-κB的結合位點,對啟動NOS轉錄起重要作用,而共轉染arginase啟動子后,熒光素酶的轉錄活性極顯著下降,表明轉錄因子Rel可能負調控arginase基因的轉錄;此外,共轉染agmatinase啟動子后,熒光素酶活性無顯著變化,表明轉錄因子Rel對agmatinase啟動子的活性無影響。Jiang等[56]研究發現,刺參纖維相關蛋白FREP的表達也受轉錄因子Rel的調控,有趣的是,FREP基因被干擾后,Rel的mRNA表達水平顯著降低[58],表明FREP可以正反饋調節Rel表達。此外,通過GST-pull down和免疫熒光技術發現,刺參親環素A(CypA)能夠與Rel互作,進一步通過干擾技術和Western blot技術分析表明,CypA作為輔助因子促進NF-κB的核移位[37]。
3.2.2 刺參JAK/STAT信號通路 目前,有關刺參JAK/STAT信號通路的研究相對缺乏,僅STAT5被報道。Shao等[57]克隆出cDNA全長為2 643 bp的刺參STAT5基因序列,預測該基因編碼787個氨基酸組成的蛋白,STAT5蛋白由STAT結合結構域、STAT α結構域、STAT DNA結合結構域和SH2結構域組成;經燦爛弧菌和LPS脅迫后,刺參STAT5的mRNA表達水平顯著上調,轉錄因子FOXP的mRNA水平也顯著上調,而SOCS2的表達趨勢與STAT5相反;進一步干擾STAT5的表達后,FOXP的mRNA表達水平顯著下調,表明STAT5可能正調控FOXP轉錄,而SOCS2的mRNA表達水平則極顯著上調,表明STAT5負調控SOCS2表達。關于刺參JAK/STAT信號通路的其他成員,還有待進一步研究。
3.3 刺參腸道微生物與疾病發生
腸道微生物作為生物體一個重要的“器官”,主要通過調控黏膜免疫系統的發育與成熟、維持腸道屏障的完整性、調節腸道微環境的pH、影響脂質的合成與吸收、改變氧化二甲胺與LPS的含量等途徑調控宿主健康狀態,介導宿主多種系統疾病的發生和發展。因此,刺參腸道菌群的組成與營養消化、生物屏障、免疫防御等生理過程密切相關,對機體健康生長具有極其重要的作用。
3.3.1 刺參腸道微生物群落組成、結構和功能 刺參腸道菌群豐富而多樣,研究發現,其腸道內細菌數量為1.85×105~ 2.17×109CFU/g[58],其中大多數為異養細菌[59],以變形菌門Proteobacteria、厚壁菌門Firmicutes、疣微菌門Verrucomicrobia、擬桿菌門Bacteriodetes為主(圖6),以及一定比例的梭桿菌門Fusobacteria、酸桿菌門Acidobacteria和浮霉菌門Planctomycetes等,通過生理生化的方法鑒定發現,刺參腸道組織和內容物菌群由弧菌屬Vibrio、假單胞菌屬Pseudomonas、節桿菌屬Arthrobacter、棒桿菌屬Corynebacterium、不動桿菌屬Acinetobacter、微球菌屬Micrococcus、奈瑟氏球菌屬Neisseria、黃桿菌屬Flavobacterium、黃單胞菌屬Xanthomonas、柄桿菌屬Caulobacter和產堿菌屬Alcaligenes等細菌組成,弧菌屬和假單胞菌屬為腸道中的優勢菌群[60]。
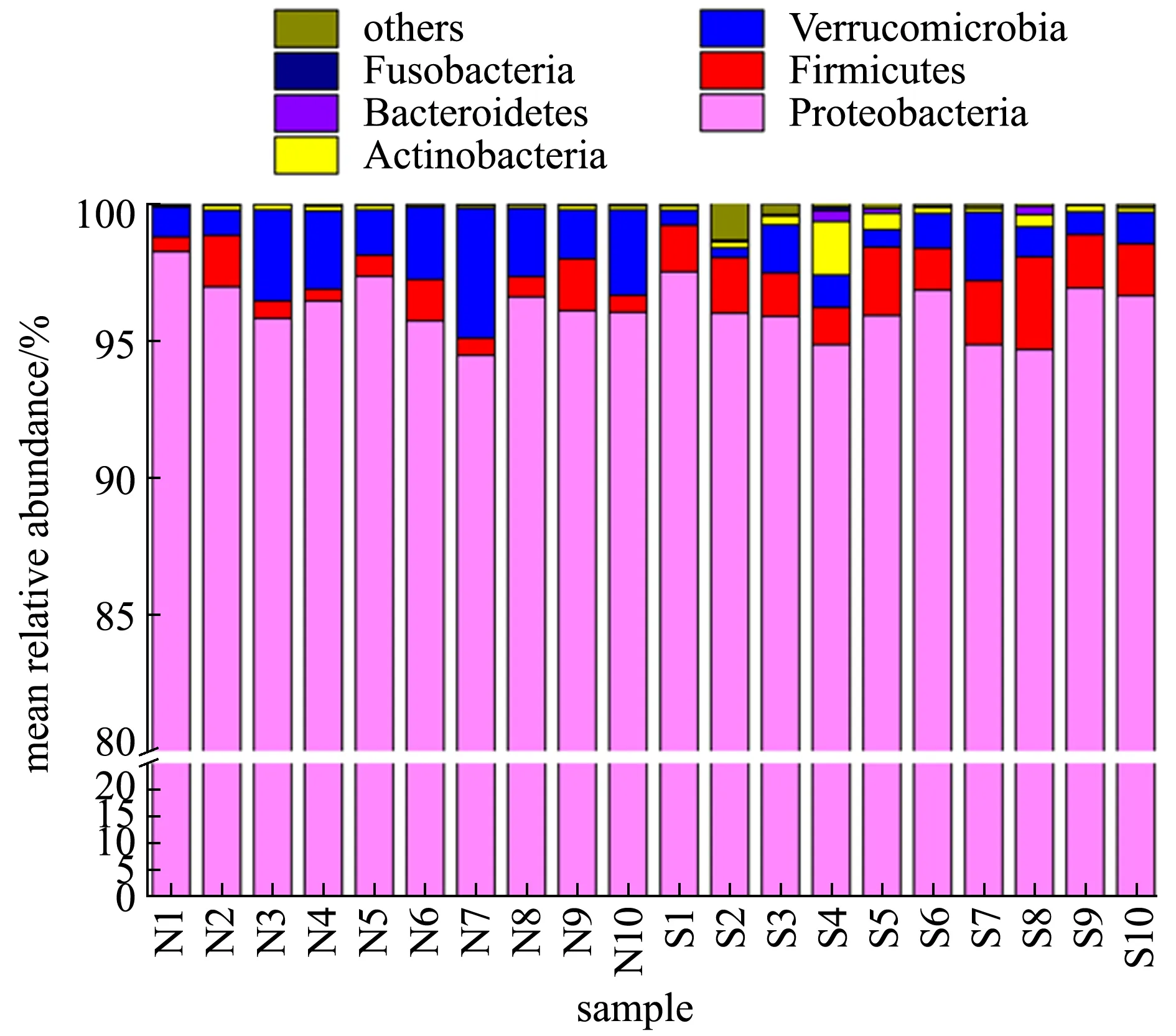
圖6 健康和自然發生腐皮綜合征狀態下刺參腸道菌群群落組成[60]
對于刺參腸道中的可培養細菌,張文姬等[61]通過限制性內切酶片段長度多態性(RFLP)技術分析了2216E、硫代硫酸鹽-檸檬酸鹽-膽鹽-蔗糖瓊脂(TCBS)和葡萄糖瓊脂培養基上分離的刺參腸道可培養菌,共獲得了假單胞菌屬、弧菌屬、芽孢桿菌屬Bacillus、希瓦氏菌屬Shewanella、交替假單胞菌屬Pseudoalteromonas、不動桿菌屬、氣球菌屬Aerococcus、發光菌屬Photobacterium、葡萄球菌屬Staphylococcus和克錫勒氏菌屬Kushneria等細菌,并證明假單胞菌屬為優勢菌屬。對冬季刺參腸道菌群進行平板稀釋涂布培養,再根據形態學特征進行區分,然后對所分離的菌株進行核糖體DNA 擴增片段限制性內切酶分析(ARDRA),證明冬季刺參腸道中優勢菌為厚壁菌門芽孢桿菌綱芽孢桿菌屬的巨大芽孢桿菌B.megaterium、蘇云金芽孢桿菌B.thuringiensis,以及燦爛弧菌和假單胞菌屬的施氏假單胞菌P.stutzeri[58]。應用變性梯度凝膠電泳(PCR-DGGE)技術分析表明,刺參腸道優勢菌依次為變形菌門、擬桿菌門和柔膜菌門,其中γ-變形菌綱豐度最高,相對含量在 32.0%~33.6%之間[62]。研究者從刺參腸道內容物中分離到11株細菌,通過16S rDNA V3區基因測序,將其歸類為厚壁菌門的梭菌屬和變形菌門的假單胞菌屬[63]。
總結分析發現,不同研究人員采用不同研究方法得到的結果也不盡相同,這主要是由于純培養的方法、以16S rDNA為基礎的DNA指紋圖譜技術和高通量測序技術均會受到培養條件、模板質量、測序效率及生物信息學分析等因素的影響,也會對菌群分析造成限制。但不同的研究結果均證實,變形菌門、厚壁菌門和擬桿菌門在刺參腸道菌群中均具有較高的豐度,為刺參腸道菌群中的優勢菌群。
王印庚等[64]研究發現,刺參腸道的位置不同,其腸道菌群的結構和功能也不同。刺參的腸道分為前腸、中腸及后腸,前腸主要負責食物的消化,后腸則發揮對營養物質的吸收和代謝作用[65],腸道功能的差別與腸道內菌群的差異密切相關。應用高通量測序方法分析刺參前中后腸的菌群結構,發現前腸的細菌多樣性高于后腸,乳球菌屬Lactococcus、芽孢桿菌屬為前腸和中腸的共有優勢菌屬,黃桿菌屬Formosa和乳球菌屬Lactococcus為后腸的優勢菌屬,前腸和中腸中的細菌群落多樣化可能在食物的消化分解中扮演著重要角色[66]。而采用細菌培養法研究顯示,弧菌屬和假單胞菌屬為刺參腸道的主要優勢菌屬,后腸的菌群種類呈現出多樣化,而前腸菌群種類略顯單一[67]。利用PCR-DGGE技術分析發現,池塘養殖刺參前腸、中腸、后腸內容物的細菌群落主要為α-變形菌綱、β-變形菌綱、δ-變形菌綱和擬桿菌綱等的細菌,其優勢菌主要為γ-變形菌綱[62]。對刺參中腸和后腸腸道菌群高通量測序發現,中腸和后腸的腸道群落主要以變形菌門、厚壁菌門、擬桿菌門、疣微菌門和放線菌門為主,但是群落組成也根據腸道位置的不同而有所差異,在患腐皮綜合征的刺參樣品中,中腸和后腸的放線菌門豐度均顯著降低,后腸中與弧菌相關的菌群相互作用更緊密,其腸道菌群助力弧菌對宿主的侵染,因此,后腸的腸道菌群能更及時準確地反映刺參病害的發生[68]。
3.3.2 刺參腸道微生物菌群的變化與疾病的發生 腸道微生物從功能上可以分為共生、益生和病原微生物三大類,其中主要是細菌,也包括真菌、病毒和噬菌體,它們在宿主腸道中保持著一種動態平衡。龐大的腸道微生物群體通過與宿主的長期協同進化,已成為一個與宿主密不可分的后天獲得的重要“器官”。腸道微生物這一“器官”發揮的功能多種多樣,包括物質代謝、生物屏障、免疫調控及宿主防御等,腸道微生物不僅幫助宿主從食物中吸收營養,還能夠合成氨基酸、維生素、抗生素等供宿主利用,并可將產生的毒素加以代謝,減少對宿主的毒害。因此,腸道微生物和宿主存在著互利共生的關系,對于維持宿主的健康發揮著重要作用。
Zhang等[60]對健康刺參和腐皮綜合征自然發病刺參腸道菌群的組成和特性分析發現,健康刺參和患腐皮綜合征刺參的腸道菌群結構有顯著差異,健康刺參的優勢菌種類為變形菌門細菌(平均相對豐度為96.37%),其次為疣微菌門(2.47%)和厚壁菌門(0.96%),而腐皮綜合征患病組的優勢菌種類為變形菌門細菌(平均相對豐度為96.01%),其次是厚壁菌門(2.02%)和疣微菌門(1.22%),相比之下,疣微菌門和厚壁菌門的相對豐度在兩組中表現出相反的趨勢,這表明細菌結構的變化可能與疾病的發生相關。同時,兩種不同狀態下刺參腸道菌群優勢菌目的相對豐度也存在顯著差異,患病組的乳酸桿菌目相對豐度明顯高于對照組,而疣微菌目相對豐度顯著低于對照組。與健康刺參相比,患病個體的腸道菌群的多樣性顯著降低;通過對腐皮綜合征刺參腸道菌群指示菌的篩選,發現紅細菌科的細菌和格氏乳球菌等與該病的發生密切相關;對腸道菌群所介導的功能進行預測,發現在腐皮綜合征患病組中腸道菌群介導的與疾病感染和信號轉導相關的信號通路增強,如免疫系統中的NOD樣信號轉導通路等(圖7)。

圖7 健康和患病狀態下刺參腸道菌群所介導的功能差異[60]
3.3.3 環境因子協助腸道微生物促進疾病發生 隨著季節的變化,環境理化因子也不斷發生變化,導致環境中微生物的組成和數目發生動態變化,最終影響刺參腸道中微生物的組成和數量,進而影響疾病發生。有研究發現,低溫對刺參腸道菌群結構有顯著影響,在一定范圍內,隨著溫度的降低,對腸道菌群的影響作用越強[69]。對高溫(20 ℃)下刺參腸道菌群結構分析發現,高溫可以通過改變腸道菌群的結構,協助燦爛弧菌對刺參的侵染[70]。對不同水溫下刺參發病率分析表明,在14~26 ℃,隨著水溫的升高,刺參發病率明顯增加,病情嚴重程度也顯著上升,然而,水溫高于20 ℃時,病菌感染3 d處理組的刺參發病率和發病程度與對照6 d處理組無顯著性差異,甚至呈下降趨勢[71]。這表明,溫度較低時,病菌是刺參發病的主導因素,溫度升高加劇了病菌的感染性。
Zhang等[70]對病原菌燦爛弧菌感染、機械損傷、高溫、亞硝酸鹽和氨氮處理后的刺參腸道菌群結構分析發現,環境因子脅迫下腸道菌群的數量下降,不同的環境脅迫條件導致α-變形菌綱相對豐富(30.31%~70.74%)較正常組(24.69%)顯著增加,而厚壁菌門、放線菌門和δ-變形菌綱相對豐度減少;在細菌科分類水平上,除機械損傷組外,不同環境脅迫條件下,紅桿菌科相對豐度(47.81%~68.57%)較正常組(19.76%)顯著增加,弧菌科相對豐度(3.90%~11.11%)較正常組(0.71%)顯著增加,冷桿菌科Psychromonadaceae相對豐度(2.19%)較正常組(1.30%~7.28%)也顯著增加,相反,OM60和瘤胃球菌科相對豐度較正常組下降;利用基于16S的細菌群落功能預測工具(PICRUSt)進一步分析顯示,環境因子脅迫下刺參腸道菌群介導的功能與正常組相比,不同的環境因子脅迫組腸道菌群介導的細胞通訊途徑(局灶性黏附、緊密連接和黏附連接)、免疫系統(NOD樣受體信號途徑)、脂質代謝、聚糖生物合成和代謝等通路顯著降低(圖8)。
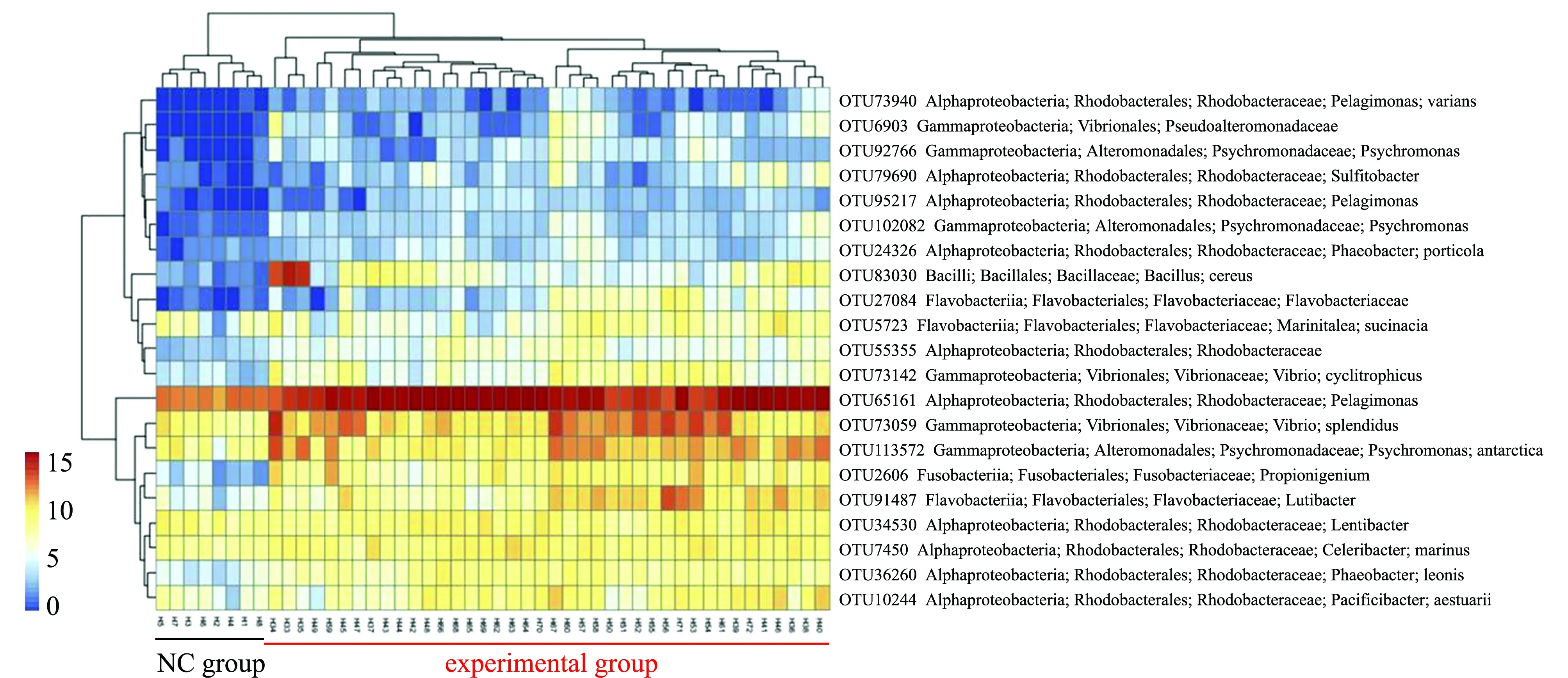
圖8 不同環境脅迫條件下刺參28個細菌指標的相對豐度變化[70]
基于IndVal大于0.8,對不同環境因子脅迫下導致刺參腐皮綜合征的后腸腸道指示菌進行篩選,獲得了21個具有顯著指示病害發生的OTU,主要隸屬于紅細菌科[70]。有研究報道紅細菌科細菌是導致水生動物疾病的病因之一,如蟹的乳狀病[72]。同時,在各個環境脅迫下,刺參腸道中蠟樣芽孢桿菌Bacilluscereus、黃桿菌科、燦爛弧菌和嗜環弧菌Vibriocyclitrophicus豐度均增加;進一步利用RT-qPCR定量各環境因子脅迫組中燦爛弧菌的數量,發現其均高于單獨的燦爛弧菌處理組,而機械損傷組燦爛弧菌豐度最高[70]。這說明環境因子在不同程度上協助了燦爛弧菌在刺參腸道中的定植。
4 刺參病害生態防治
4.1 刺參抗病育種
隨著刺參產業規模的不斷拓展,種質退化、生長緩慢、養殖周期長、抵御環境變化能力差和病害頻發,以及商品參品質下降等一系列制約或潛在制約產業發展的問題也日益凸顯。為有效解決產業面臨的上述問題,遼寧、山東沿海各養殖單位紛紛培育出刺參苗種。目前,已培育的刺參新品種有山東省海洋生物研究院與好當家集團有限公司聯合培育的“魯海1號”、中科院海洋所與山東煙臺東方海洋通過產學研結合選育的“東科1號”、山東省海洋資源與環境研究院與多家單位聯合培育的刺參新品種“崆峒島1號”、大連海洋大學培育的“水院1號”、山東安源水產公司培育的“安源1號”和中國水產科學研究院黃海水產研究所與青島瑞滋集團有限公司合作培育的“參優1號”等。 其中,“參優1號”是中國首個具有抗逆性狀的刺參新品種,于2017年通過國家水產原種與良種委員會評審(品種登記號為GS-01-016-2017[73])。歷經12年培育的新品種,具有抗病力強、生長速度快和耐高溫等優點,成功選育填補了中國抗逆刺參良種培育的空白。刺參“參優1號”抗燦爛弧菌能力強,在6月齡時燦爛弧菌侵染后成活率提高11.68%,可顯著提高刺參抗化皮病的能力;生長速度快,池塘養殖收獲時其平均體質量提高38.75%,可顯著提高刺參的產量和經濟效益;成活率高,池塘養殖收獲時成活率提高23%以上。
4.2 免疫增強劑
免疫增強劑是指單獨或同時與抗原使用均能增強機體免疫應答的物質, 其通過提高養殖動物的非特異性免疫力以增強機體對病原的抵抗力。免疫增強劑的主要作用方式包括提高養殖動物的非特異性免疫、提高養殖動物的特定生長率和抑制病原菌[74]。免疫增強劑對宿主免疫力提升和病原抵抗力的作用主要通過細胞免疫和體液免疫方式來實現。由于免疫增強劑具有比抗生素更安全、比疫苗作用范圍廣等優點,越來越受到重視,特別是對于提高以非特異性免疫為主的無脊椎動物(對蝦、貝類及海參)的免疫力尤為重要。目前,水產養殖中常用的免疫增強劑主要有中草藥、多糖類物質、益生菌、動植物與細菌提取物及化學合成物質類等物質。
4.2.1 中草藥制劑 中草藥對于增強刺參機體免疫力、預防及治療病原微生物引起的刺參病害,以及促進刺參生長等具有良好效果,同時又因其無抗藥性、無殘留、無副作用、不引發藥源性疾病及抑菌殺菌效果明顯而備受人們關注。2009年,Wang等[75]首次研究了黃芪的根及其多糖對刺參非特異性免疫應答的增強作用,使用3%的黃芪細粉(CP)、超細粉(SP)和0.3%的黃芪多糖(APS)喂養刺參60 d后,屬于體液反應的溶菌酶活性、活性氧ROS的水平均明顯增加;用黃芪超細粉和黃芪多糖喂養60 d后,分別采用燦爛弧菌進行刺參攻毒試驗,刺參累計出現癥狀的比率從對照組的66.67%下降到16.67%和33.34%,而用黃芪細粉喂養60 d后的刺參累計出現癥狀的比率與對照組相同。之后閆茂倉等[76]對22 味中草藥進行了燦爛弧菌體外抑制試驗,篩選到黃連、黃芩、連翹和黃柏對燦爛弧菌具有較好的抑菌和殺菌效果。賈晨晨等[77]研究了菊芋全粉對平均體質量為4.7 g稚參的免疫增強作用,結果顯示,在燦爛弧菌感染下,15 g/kg菊芋全粉可顯著增強刺參免疫因子活力。
中草藥雖然可提高刺參的免疫力,然而其在刺參養殖中的使用需謹慎。姚剛等[78]進行了五倍子、烏梅、石榴皮、黃芩和甘草5種中草藥的單劑和復方藥劑對稚參的急性毒性試驗,結果表明,中草藥的濃度和配伍是中草藥使用過程中最為重要的兩個參數,高濃度的中草藥對稚參表現出了一定的急性毒性。因此,中草藥的使用必須在安全濃度范圍內,方可用作刺參細菌性疾病的防治藥物。
4.2.2 免疫多糖類 大量的藥理和臨床研究結果表明,從生物體中提取的天然多糖,具有免疫增強作用強、安全性高和應用廣譜等優點,是理想的免疫增強劑。目前水產養殖中使用的多糖類免疫增強劑通常有微生物多糖、甲殼素、殼聚糖和植物多糖等。已用于刺參免疫增強劑的多糖有β-葡聚糖、甘露寡糖、殼聚糖和海藻多糖等(表1),其中β-葡聚糖在刺參免疫增強中的作用得以廣泛研究。Zhao等[79]研究表明,飼料中添加一定濃度的β-葡聚糖,對刺參生長、免疫應答和抗燦爛弧菌感染等活性有顯著提高,投喂含濃度為1.25 g/kg β-葡聚糖飼料的刺參比投喂含2.50 g/kg β-葡聚糖飼料的刺參生長速度更快,體腔細胞的呼吸爆發活性更高,且死亡率更低,表明β-葡聚糖能夠顯著降低刺參在燦爛弧菌感染下的死亡率,且具有明顯的濃度依賴性。Wei等[80]等報道了來源于滸苔的多糖PEP2具有提高刺參體腔細胞的吞噬能力(PC)、呼吸爆發活性,以及體腔液中酸性磷酸酶(ACP)、過氧化氫酶(CAT)和超氧化物歧化酶(SOD)活性的能力,并顯著降低燦爛弧菌感染的刺參累計死亡率。

表1 應用于刺參免疫增強的多糖類免疫增強劑
4.2.3 免疫增強類菌劑 已有研究表明,健康動物體內或養殖環境中具有產酶能力的微生物是益生菌的有效來源。目前已獲得了多株潛在的益生菌,并測定了益生菌對刺參生長、消化、免疫及抗病力的影響。楊志平等[84]從健康刺參(體質量為10~30 g)腸道中分離出50株細菌,并對該菌株產淀粉酶、蛋白酶、脂肪酶和纖維素酶等的能力進行了測定,結果獲得了3株產酶能力高且不產生溶血的菌株BC26、BC228和BC232,通過注射模式和浸泡感染模式進行了這3株菌的安全性測定,結果表明無論何種感染方式,注射或浸泡感染使用濃度為107CFU/mL 的菌懸液,或投喂含109CFU/g的菌體作為飼料添加劑,都不會引起刺參發病,初步表明這3株菌具有可在刺參養殖中應用的潛力。Yan等[85]篩選到了另一株芽孢桿菌BacillusbaekryungensisYD13,使用濃度為104、106、 108CFU/g的YD13添加到基礎飼料中喂養刺參,104、106CFU/g濃度的B.baekryungensisYD13表現出了較強的免疫激活作用,喂養60 d后,刺參體腔液LSZ、ACP及血清ALP、SOD、CAT酶活性均有不同程度的升高,喂養結束后,采用燦爛弧菌進行感染試驗,結果表明,104、106、 108CFU/g濃度的B.baekryungensisYD13可使刺參的死亡率下降至15%、5%和30%,均顯著低于對照組的50%。
酵母菌也是刺參養殖中常用的免疫增強劑。Liu等[86]篩選獲得了對刺參具有免疫激活效果的酵母Metschnikowiasp.C14并投喂刺參,即使在其較低的水平,即104CFU/g時也獲得了100%的相對保護率。Ma等[87]分析了仙人掌有孢漢遜酵母菌HanseniasporaopuntiaeC21對刺參的保護效應,H.opuntiaeC21可顯著提高刺參體腔細胞的吞噬能力、體腔液的LZM、T-NOS、SOD、AKP和ACP活性,以及刺參體腔細胞裂解上清液中LSZ、T-NOS、AKP和ACP的活性,采用含有H.opuntiaeC21的飼料喂養刺參45 d后,使用燦爛弧菌進行感染試驗,結果表明,H.opuntiaeC21可以對燦爛弧菌感染的刺參產生100%的保護率,刺參的死亡率由對照組的50%降低至H.opuntiaeC21飼養組的0%。Wang等[88]使用3種不同濃度(105、106、107CFU/g)的海洋紅酵母RhodotorulabenthicaD30添加到飼料中并投喂刺參,刺參體腔液中的淀粉酶、纖維素酶和褐藻酶活性均有所提高,且隨著D30濃度的增加,消化酶的活性亦有所增加,喂養后的刺參使用燦爛弧菌感染,結果表明,用濃度為105、106CFU/g的R.benthicaD30喂養后的刺參死亡率均為10%,用濃度為107CFU/g的R.benthicaD30喂養后的刺參死亡率為0%,而喂養基礎飼料的對照組刺參死亡率為54.45%。
綜合芽孢桿菌和酵母菌作為刺參免疫增強劑的研究,不難發現,在使用相同量的菌劑條件下,酵母菌明顯具有更強的免疫增強作用,且菌劑對刺參的免疫刺激作用具有菌株特異性和劑量依賴性。這一特點在Yang等[89]的研究中表現得更為突出。Yang等同時研究了B.cereusG19、B.cereusBC-01和ParacoccusmarcusiiDB11 菌株對刺參的免疫增強作用,采用含有B.cereusG19的飼料喂養刺參后,其體腔細胞的吞噬能力、呼吸爆發活性和AKP酶活性增強,采用含有B.cereusBC-01的飼料喂養刺參后,其體腔細胞的呼吸爆發活性和AKP酶活性增強,采用含有P.marcusiiDB11的飼料喂養刺參后,其體腔細胞的PC、AKP和SOD酶活性增強。因此,可以得出結論,補充B.cereusG19和BC-01的飼料可以顯著改善刺參的生長性能和體腔細胞的免疫反應,而補充P.marcusiiDB11的飼料可以積極改善刺參的生長性能和體腔細胞的免疫反應。
此外,不同的細菌復合物也被用于刺參免疫增強作用的研究。使用枯草芽孢桿菌B.subtilisYB-1和B.cereusYB-2的益生菌混合物[90],以及使用乳酸菌、鞘氨單胞菌和醋酸桿菌的組合[91],均獲得了比使用單菌更好的免疫刺激效果。使用枯草芽孢桿菌BacillussubtilisT13喂養刺參30 d后,B.subtilisT13對刺參的特定生長率有顯著影響,飼料中加入109CFU/g的B.subtilisT13可顯著提高刺參體腔細胞的PC、呼吸爆發活性及T-NOS、TCC、SOD酶活性,使用含有109CFU/g的B.subtilisT13的飼料喂養30 d,在燦爛弧菌感染后,刺參的累計死亡率為20.0%,顯著低于對照組刺參的56.2%,而使用105、107CFU/g的T13飼養后,刺參的累計死亡率均為50.0%[92]。使用蠟樣芽孢桿菌B.cereusEN25喂養刺參30 d,B.cereusEN25對刺參的特定生長率及TCC、ACP活性均無顯著性影響,但可顯著提高刺參的PC、呼吸爆發活性和T-NOS活性,飼料中添加濃度為107CFU/g的EN25的刺參在燦爛弧菌感染后死亡率為33.3%,遠低于對照組刺參的64.2%[93]。
4.3 拮抗菌劑
燦爛弧菌是刺參養殖的主要病原菌,目前已經報道的拮抗菌劑的篩選多是針對燦爛弧菌展開的(表2)。從來自大連三山島的健康刺參體表及腸道中分離得到37株細菌,采用十字交叉劃線法和紙片法篩選出對燦爛弧菌具有拮抗作用的菌株28株,其中7株菌均是通過競爭營養物質與生存空間或者產生有抑菌活性的胞外產物兩種方式協同抑菌獲得的,其中假單胞菌Pseudoalteromonassp.CG-6-1主要分泌蛋白類等極性的生物大分子,其胞外產物經過80%的硫酸銨沉淀時獲得的沉淀物抑菌活性最高,產生的抑菌圈直徑可達到25 mm[94]。使用同樣的篩選策略,對刺參體表的細菌進行了分離和拮抗活性的篩選,獲得一株枯草芽孢桿菌B.subtilisCG,并通過正丁醇提取、硅膠G薄層層析、官能團顯色反應和紅外光譜分析,最終推斷主要的拮抗物質為氨基糖苷類化合物[95]。從紅島刺參養殖區泥樣中分離出27株可培養細菌,其中包含一株燦爛弧菌LJ08,采用科赫法則回歸感染表明,LJ08對幼參具有致病性,泥樣中分離獲得的可培養細菌經安全性、抑菌活性和毒性檢測,篩選出對燦爛弧菌LJ08有明顯拮抗作用的檸檬黃假交替單胞菌PseudoalteromonascitreaLJ03、海水芽孢桿菌BacillusaquimarisLJ04和白色食瓊脂菌AgarivoransalbusLJ06[96]。

表2 拮抗菌的篩選及拮抗特性
以刺參腐皮綜合征主要致病菌假交替單胞菌P.nigrifaciens、燦爛弧菌V.splendidus、副溶血弧菌V.parahaemolyticus和溶藻弧菌V.alginolyticus為指示菌,對山東東營的刺參養殖池塘水樣和底泥樣品中的可培養細菌進行了拮抗菌的分離鑒定,獲得了拮抗菌貝萊斯芽孢桿菌BacillusvelezensisDY-6,該菌對受試致病菌均有較好的抑制作用;進一步對該菌的安全性進行了評估,使用高濃度的B.velezensisDY-6菌體浸泡刺參,在試驗期間浸浴組和投喂組刺參狀態良好,無發病和死亡現象[97]。這表明B.velezensisDY-6具有良好的抑菌能力,對刺參養殖過程中的細菌病害具有較好的防治潛力。
從健康的虎斑烏賊體內篩選到一株可以拮抗刺參病原燦爛弧菌V.splendidusAJ01的弧菌Vibriosp.V33,將Vibriosp.V33的上清液加入燦爛弧菌V.splendidusAJ01培養液中,可抑制38%的燦爛弧菌生長;將Vibriosp.V33的無菌上清液于100 ℃加熱5 min,其拮抗活性未發生顯著變化,這提示弧菌Vibriosp.V33產生的拮抗為非蛋白類物質;為了量化Vibriosp.V33對燦爛弧菌的拮抗作用,在自然海水中,將Vibriosp.V33與V.splendidusAJ01共孵育24 h后,與對照組相比,V.splendidusAJ01的數量大大減少,數量約降低89%;進一步對Vibriosp.V33上清液中所含的拮抗物質活性從分子量、熱穩定性、極性等角度進行了表征,結果表明,Vibriosp.V33分泌的拮抗物質具有熱穩定、水溶性及分子量小等特點[98]。
另外,對Vibriosp.V33和V.splendidusAJ01分別進行鐵吸收的測定,發現Vibriosp.V33具有更高的鐵吸收效率,因此,推測Vibriosp.V33主要是通過拮抗燦爛弧菌的鐵吸收過程實現對燦爛弧菌V.splendidusAJ01生物量的抑制[102]。分別使用Vibriosp.V33、V.splendidusAJ01及二者的混合菌進行刺參感染試驗,結果表明,Vibriosp.V33浸泡感染的刺參未出現死亡和病癥,而V.splendidusAJ01浸泡感染的刺參累計死亡率為70%,采用二者混合菌共浸泡感染的刺參累計死亡率為40%[98]。這說明,Vibriosp.V33是一株安全性較高的菌株,且其對燦爛弧菌感染的刺參具有43%的相對保護率。
從健康刺參腸道微生物中篩選出對V.splendidusAJ01具有拮抗活性的蠟狀芽孢桿菌BacilluscereusLS2,B.cereusLS2的上清液對V.splendidusAJ01的生長具有較強的抑制作用,抑制率可達到86.83%;采用活性追蹤試驗進一步表征了該拮抗物質的性質,B.cereusLS2分泌的拮抗物質為相對分子質量小于3 000的小分子物質,且對胰蛋白酶敏感,對溫度具有較高的穩定性;采用6 mol/L的鹽酸沉淀B.cereusLS2的無菌上清液,得到的沉淀物僅溶于甲醇中,表明該物質具有脂溶性;原位酸水解和茚三酮顯色試驗顯示,未經水解的沉淀物呈現紫色,而水解后的沉淀物呈現橙黃色,因此,該拮抗物質具有多肽的性質[99]。結合所測定的性質推斷,蠟狀芽孢桿菌LS2產生的拮抗燦爛弧菌物質為小分子的脂肽。
4.4 噬菌體在控制刺參病害微生物中的應用
噬菌體是一類能夠感染細菌、真菌、螺旋體或放線菌等微生物的病毒總稱。噬菌體本身不能繁殖,必須在活菌內寄生。噬菌體是自然界中存在的最豐富的物種之一,據估計其數量高達1031數量級[103]。相較于普通真核細胞病毒,噬菌體的培養更加簡便、經濟、快捷且其對化學和物理因素較穩定,易于獲得純培養。噬菌體具有極高的宿主特異性,對人和動物沒有感染性,只寄生于其易感染的宿主細胞內,因此,可作為一種理想的抗菌生物制劑替代抗生素[104-105]。
目前,關于噬菌體在抑制病原菌感染刺參過程中的應用已有較多的報道。Zhang等[106]利用溶藻弧菌噬菌體研究其對刺參的保護效果發現,噬菌體感染復數為10、1和0.1的刺參(10 g±2 g)存活率分別為73%、50%和47%,這一結果與沒有噬菌體的對照組(3%的存活率)具有顯著差異,而用兩種抗生素治療(5 mg/L多西環素和10 mg/L卡那霉素)后的存活率分別為80%和47%,顯示抗生素和噬菌體具有類似的治療效果。Li等[107]用3種噬菌體單獨或以1∶1∶1的比例分別對燦爛弧菌進行體外抑制試驗,與未處理組相比,對所有被噬菌體處理的燦爛弧菌生長有顯著的抑制作用,且混合噬菌體(噬菌體雞尾酒)比3種噬菌體單獨使用具有更明顯的抑制效果;進一步進行噬菌體雞尾酒與抗生素及單一噬菌體對刺參的保護效果研究中發現,未添加抗生素的刺參存活率為18%,抗生素處理的為82%,混合噬菌體處理的為82%,噬菌體pps-1、pps-2和pps-3處理的分別為65%、58%和50%。這表明,利用噬菌體,特別是用不同噬菌體的組合來控制刺參中的弧菌感染,可能是一種可行的方法。
5 存在問題及展望
疾病的發生是宿主免疫力和病原致病力斗爭的結果和呈現形式,在這之中環境因子發揮著重要的調節作用。因此,宿主、病原體和環境是決定疾病發生的關鍵三要素,也是建立刺參疾病綠色防治的理想靶點。目前,在刺參免疫防御機制方面取得了重要進展,鑒定了機體免疫調控的多種信號通路及其調控途徑,獲得了具有潛在應用價值的效應分子,選育了抗病力強的“參優1號”刺參新品種,但在病原致病機制研究方面進展相對遲緩,主要聚焦在燦爛弧菌溶血素、鐵吸收等毒力因子發掘和功能方面,而涉及環境因子的研究更多地集中在某一特定環境因子的變化對宿主免疫指標的影響,對于環境因子如何調控疾病發生的研究幾乎是空白。因此,今后應在以下幾方面開展深入研究。
1)為實現刺參產業健康可持續發展,亟須強化宿主免疫力、病原致病力和環境因子三者研究的深度和交叉融合。在刺參免疫防御研究方面,應拓寬細胞免疫研究的深度和廣度,強化體腔細胞分型和功能研究,建立穩定傳代的刺參特定體腔細胞系。基于病原-宿主互作理論,闡明病原微生物激活免疫信號通路,實現免疫逃逸的分子機制。
2)在病原致病機制方面,加強燦爛弧菌以外的其他病原致病因子的發掘和功能研究,突出不同病原感知宿主免疫細胞/效應分子的分子和細胞學機制,強化宿主對病原毒力因子表達的調控作用研究。
3)在環境調控疾病發生研究方面,闡明關鍵環境因子對宿主免疫防御能力和病原毒力因子表達的調控關系,明確環境污染物介導刺參疾病發生的分子機制,闡釋環境微生物(包含病原微生物)在宿主體內的遷移、定植和功能。
致謝:郭明老師和段雪梅老師參與了本文的資料搜集與寫作工作。

