山臘梅葉揮發油對血管性癡呆大鼠認知障礙的改善作用
王延 伍沙沙 徐婷 饒光玲 劉曉龍 李亞鋒 錢海兵
摘要 [目的]探討山臘梅葉揮發油對血管性癡呆(vascular dementia,VD)大鼠認知功能障礙的影響及其機制。[方法]將SD大鼠隨機分為假手術組、模型組、銀杏葉組、山臘梅葉揮發油高劑量和低劑量組,除假手術組外,皆采用雙側頸總動脈永久性結扎法(2VO)復制VD模型。通過Morris水迷宮試驗和曠場試驗測定大鼠的認知功能,HE染色觀察海馬CA1區病理變化,并檢測血清中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。[結果]與假手術組比較,模型組大鼠逃避潛伏期延長(P<0.01)、平臺穿越次數減少(P<0.01)、垂直得分和水平得分下降(P<0.05)、SOD活性降低(P<0.01)、MDA含量增高(P<0.01);與模型組比較,山臘梅葉揮發油高、低劑量組大鼠逃避潛伏期縮短(P<0.05)、穿越原平臺次數增多(P<0.05)、垂直得分和水平得分增高(P<0.05),血清指標SOD活性升高(P<0.05)、MDA含量下降(P<0.05);HE染色結果顯示,山臘梅葉揮發油高、低劑量組海馬CA1區神經元細胞較完整,排列相對密集有序。[結論]山臘梅葉揮發油具有改善大鼠血管性癡呆認知障礙的作用,其機制可能與糾正大鼠腦組織氧化/抗氧化失衡,保護腦組織免于氧化損傷,并減輕海馬區損傷有關。
關鍵詞 山臘梅葉;揮發油;血管性癡呆;認知障礙;改善作用
中圖分類號 R285文獻標識碼 A
文章編號 0517-6611(2021)02-0170-05
doi:10.3969/j.issn.0517-6611.2021.02.046
開放科學(資源服務)標識碼(OSID):
Improving Effect of Volatile Oil from Chimonanthus nitens Oliv.Leaves on Cognitive Disorder in Rats with Vascular Dementia
WANG Yan,WU Shasha,XU Ting et al (Guizhou University of Traditional Chinese Medicine,Guiyang,Guizhou 550025)
Abstract [Objective]To investigate the effect and mechanism of essential oil from Chimonanthus nitens Oliv.leaves on cognitive disorder in rats with vascular dementia.[Method]SD rats were divided randomly into sham operation group,model group,ginkgo leaf group,high and low dose of essential oil from Chimonanthus nitens Oliv.leaves groups.Except the sham operated group,all the other groups received twovessel occlusion (2VO) method to establish VD models.Morris water maze and open field test were used to determine the cognitive function of rats.HE staining was used to observe the pathological changes in the CA1 region of the hippocampus.Activity of superoxide dismutase (SOD) and malonaldehyde (MDA) content were detected to explore the mechanism of the essential oil from Chimonanthus nitens Oliv.on VD.[Result]Compared with sham operation group,the rats in model group had longer average escaping latency period (P<0.01),fewer number of crossplatform (P<0.01),fewer vertical and horizontal scores (P<0.05),higher MDA content (P<0.01) and lower SOD activity (P<0.01).Compared with model group,the rats in high and low dose of essential oil from Chimonanthus nitens Oliv.leaves groups had shorter average escaping latency period (P<0.05),more number of crossplatform (P<0.05),more vertical score and horizontal scores (P<0.05),higher SOD activity (P<0.05),lower MDA content (P<0.05).HE staining results showed that the morphological structure of vertebral cells in hippocampal CA1 area were regular,orderly and normal,the structure of cells was intact.[Conclusion]The essential oil from Chimonanthus nitens Oliv.leaves can improve the cognitive disorder of vascular dementia in rats.The potential mechanism may be related to antioxidant and reduction of hippocampal injury.
Key words Chimonanthus nitens Oliv.leaves;Essential oil;Vascular dementia;Cognitive disorder;Improving effect
血管性癡呆(vascular dementia,VD) 是由各類腦血管疾病致使腦功能受損而引起的后天智力障礙綜合征。近年來VD的發病率逐年上升,是僅次于阿爾茲海默癥(Alzheimers disease,AD)的第二大常見癡呆類型[1-2]。 VD的認知變化遠遠大于AD等其他疾病,主要為注意力、信息處理和執行功能等缺陷,且抑郁和冷漠等癥狀在VD患者中表現尤為突出[3]。一系列認知障礙及精神心理活動的轉變嚴重影響老年人的生活質量。目前尚無食品藥品監督管理局(FDA)批準的VD治療方案,臨床上的VD藥物主要為僅針對癥狀性治療的藥物,暫不能減緩VD的進展或逆轉VD的過程[4],這也使從民族藥物中嘗試發現具有治療VD作用的藥物成為當下研究的熱點之一。山蠟梅為貴州地區少數民族用藥,研究表明,山蠟梅葉不僅在抗炎、抗氧化、抗病毒、抗菌、解熱等方面有作用,也可影響中樞神經系統[5-6]。近年來的研究發現,揮發油成分對于認知功能障礙具有一定的改善作用[7-10],且李姝臻等[5]研究也發現臘梅葉具有改善癡呆小鼠學習能力的功能,基于此,該研究將基于氧化損傷探討山臘梅葉揮發油對大鼠血管性癡呆認知功能障礙的改善作用及其機制。
1 材料與方法
1.1 材料
1.1.1 試驗動物。
成年雄性SD大鼠,體重(280±20)g,購買于長沙市天勤生物技術有限公司,許可證號:SCXK(湘)2014-0011。動物適應性喂養7d后開始試驗。
1.1.2 試驗藥物。
山臘梅葉在2019年7月采自貴州省貴陽市烏當區,采回的藥材經貴州中醫藥大學藥學院劉曉龍博士準確鑒定為臘梅科臘梅屬山臘梅(Chimonanthus nitens Oliv.)。每次稱取粉碎后的山臘梅葉300 g置于3 000 mL燒瓶中,加1 000 mL去離子水,用揮發油提取器按水蒸氣蒸餾法提取5 h,所得的山臘梅葉揮發油為具有濃郁香味的淡黃色透明油狀物,用無水硫酸鈉脫水,密封避光保存備用,其提取率為0.14%。銀杏葉片,規格0.21 g/粒,產品批號190102,廣州一力羅定制藥有限公司。
1.1.3 主要試劑及儀器。
MDA測定試劑盒(南京建成生物工程研究所,批號 20181226);SOD測定試劑盒(南京建成生物工程研究所,批號 20181220);HE染色試劑盒(北京索萊寶科技有限公司,批號 20180820);DRT-TW電熱套(鄭州長城科工貿有限公司);Morris水迷宮系統(中國醫學科學院藥物研究所,DNS-2);曠場試驗系統(貴州中醫藥大學提供);80-1醫用離心機(江蘇新康醫療器械有限公司);InfiniteM200酶標儀(北京新風機電技術公司);YZB/0009-2003組織包埋機(浙江省金華市科迪儀器設備有限公司);RM2265組織切片機(浙江省金華科迪儀器設備有限公司)。
1.2 方法
1.2.1 模型建立與篩選。
采用雙側頸總動脈永久性結扎法(2VO)[11-12]予大鼠復制VD模型,假手術組大鼠除不結扎血管外,其余操作同VD模型大鼠。在造模完成后第1天進行神經行為學評分以鑒定造模是否成功,評分標準按Longa等[13]制定的5級評分法改進:0分,無神經功能缺損,提尾懸空時,大鼠兩前肢可向地面伸直;1分,輕微神經功能缺損,提尾懸空時,大鼠一側前肢不能充分伸展;2分,中度局灶性神經功能缺損,大鼠向一側環行運動;3分,重度局灶性神經功能缺損,大鼠行走時向一側傾倒;4分,喪失行走能力。評分達到1~4分鑒定為造模成功[14-15]。
1.2.2 分組及給藥。
除假手術組外,符合1~4分的合格大鼠根據隨機數字表法分為模型組、山臘梅葉揮發油高、低劑量組(19.60、4.90 mg/kg,相當于生藥量的14.0、3.5倍)和銀杏葉片組(6.72 mg/kg,相當于成人臨床用量的7倍),無造模僅分離血管的為假手術組。每組8只。各組大鼠均灌胃給藥,灌胃體積為10 mL/kg,假手術組、模型組給予同等劑量的生理鹽水,每天1次,28 d后開始水迷宮試驗,水迷宮和曠場試驗期間持續給藥。
1.2.3 Morris水迷宮試驗(Morris water maze,MWM)。
MWM系統由圓柱形水池、自動錄像設備和分析系統構成。水池直徑150 cm、深度50 cm,均分為4個象限且四周有視覺提示,池中設置一個直徑9.5 cm、高度28.0 cm的透明圓柱形站臺,并使其位于第三象限中間位置,其頂部沒于水下1 cm處,水溫(25±1)℃。給藥28 d后,將各組大鼠進行MWM測試:第1~3天為訓練期,每天進行2次定位練習,不記錄成績;第4天將各組大鼠隨機從第一象限的入水點面向池壁放入水中,記錄其逃避潛伏期和游泳路徑;在第5天撤除站臺,記錄2 min 內大鼠在池內的游泳軌跡和跨越平臺次數等指標。
1.2.4 曠場試驗(open field test,OFT)。
MWM結束后,提前2 h 將大鼠放在OFT實驗室適應環境。取一個5×5方格的曠場,隨機將各組大鼠放入曠場方格內固定點,在曠場上方安置攝像機,記錄大鼠5 min內運動情況,測定大鼠的水平活動得分和垂直活動得分等指標。每完成一次測試立即用75%乙醇擦拭敞箱,去除大鼠氣味影響,待敞箱干燥后再進行下一次曠場試驗。
1.2.5 大鼠血清SOD活性、MDA含量檢測。
OFT結束后,實驗大鼠在麻醉狀態下腹主動脈取血,室溫靜置30 min使血液分層。3 000 r/min下離心10 min,分裝血清,按試劑盒說明書操作,在550 nm的波長下測量各孔OD值即吸光度,繪制酶標曲線,計算樣本濃度。
1.2.6 大腦組織HE染色。
取血后,快速斷頭取出大鼠腦組織,浸泡于4%多聚甲醛中固定48 h,按常規方法脫水包埋處理。將組織制作成5 μm厚度切片,常規HE染色,分別觀察各組大鼠大腦海馬組織CA1區病理改變。
1.3 統計學分析 采用SPSS 17.0軟件進行t檢驗,結果以均數±標準差(±S)表示,P<0.05為差異有統計學意義。
2 結果與分析
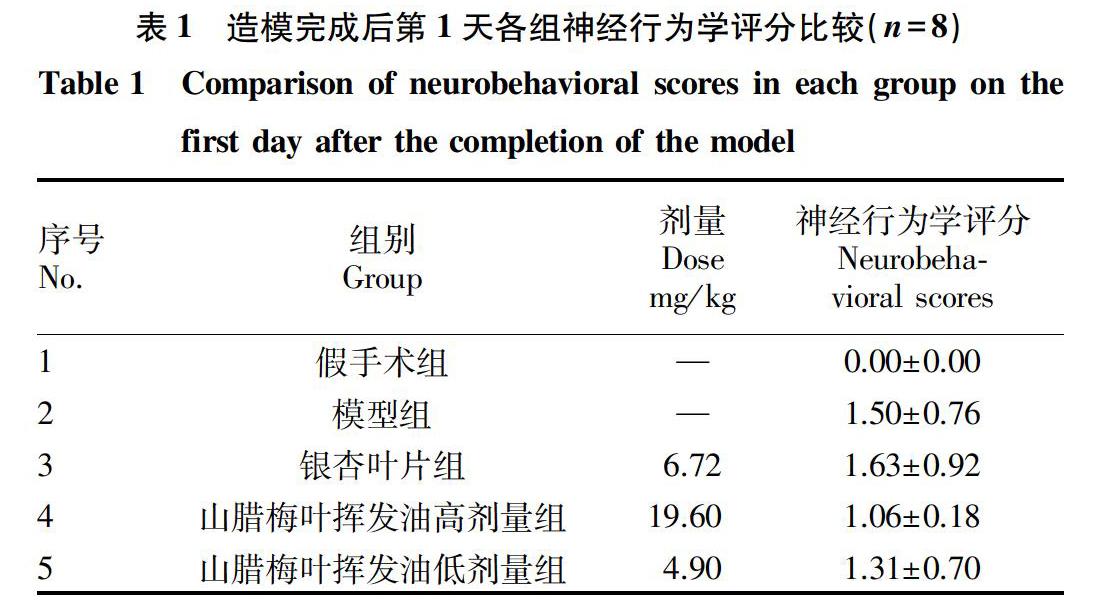
2.1 各組大鼠神經行為學評分比較 從表1可以看出,模型組、銀杏葉片組、山臘梅葉揮發油高劑量組和山臘梅葉揮發油低劑量組4組大鼠的神經行為學評分均高于假手術組,差異具有統計學意義(P<0.05),提示大鼠VD模型復制成功;4組之間兩兩比較,差異均無統計學意義(P>0.05),表明以上4組分組均衡。綜上所述,各組大鼠均可用于該試驗研究。
2.2 水迷宮試驗結果比較
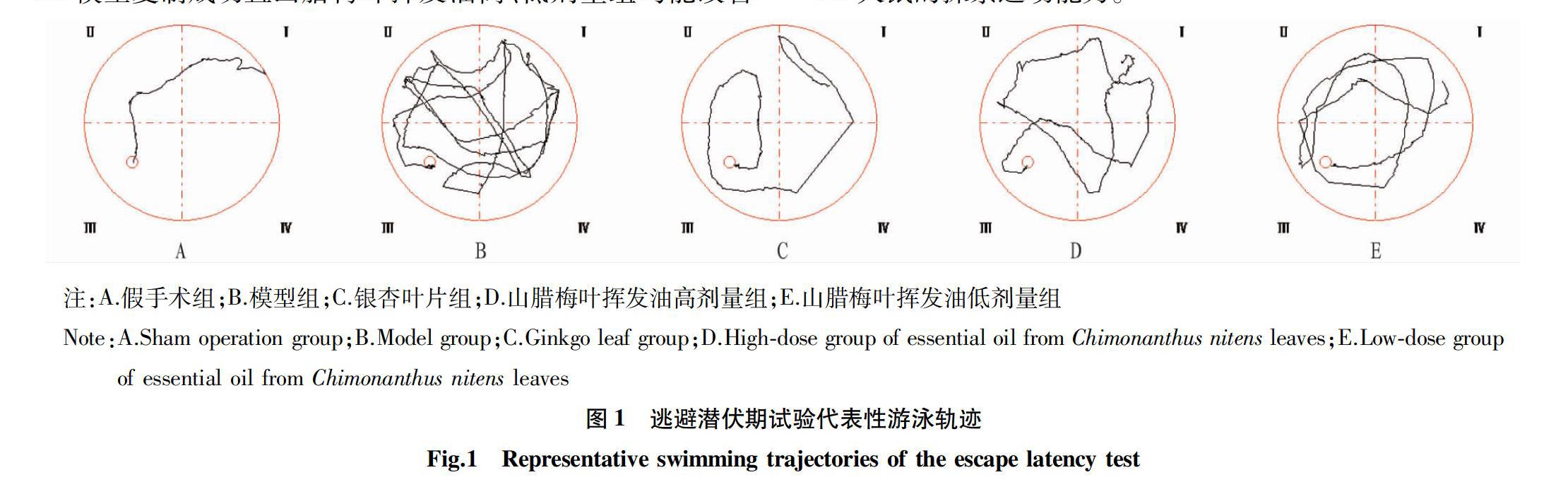
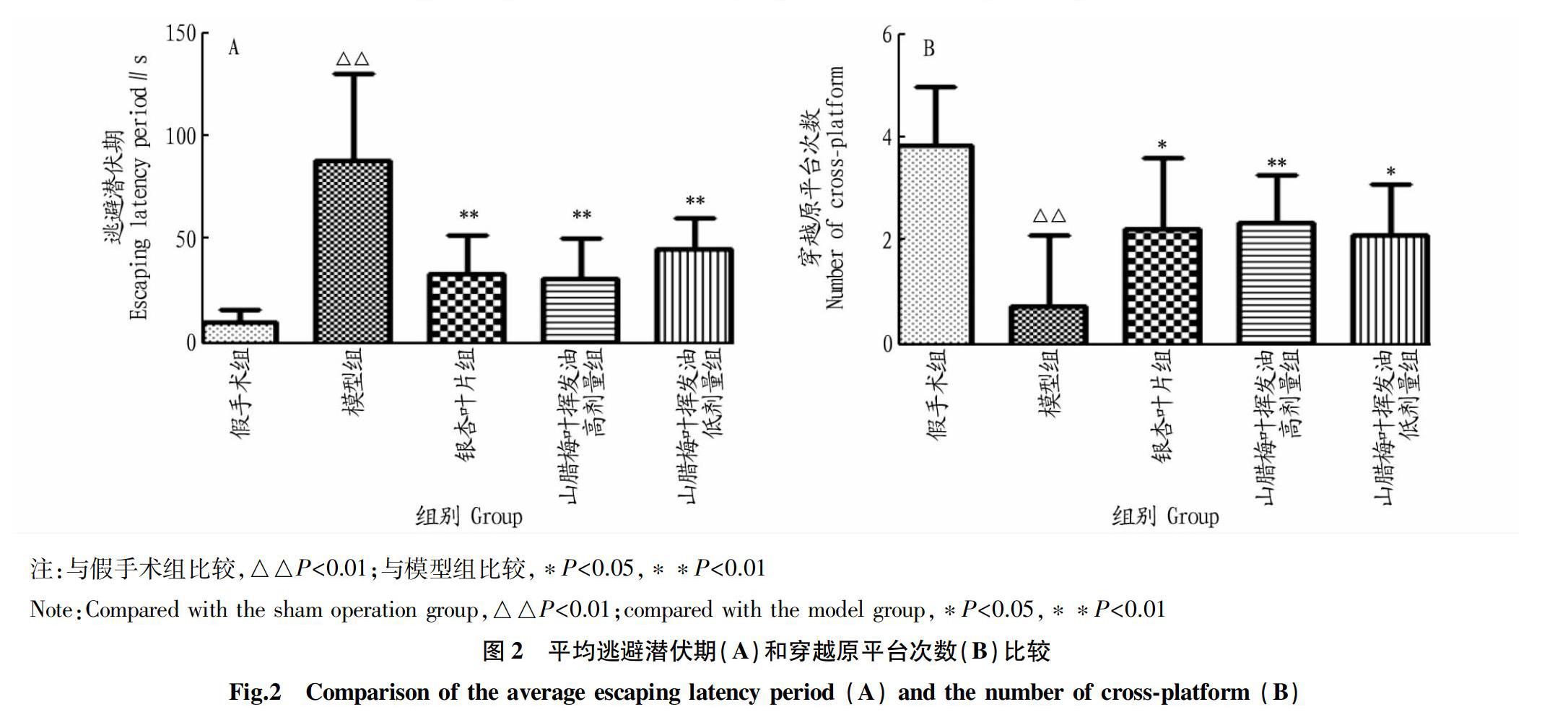
各組大鼠MWM逃避潛伏期軌跡圖見圖1。5組大鼠逃避潛伏期比較(圖2A),模型組大鼠逃避潛伏期較假手術組顯著延長(P<0.01);與模型組比較,銀杏葉片組、山臘梅葉揮發油高和低劑量組大鼠到達平臺的潛伏期明顯縮短(P<0.01)。5組大鼠穿越原平臺次數比較(圖2B),模型組大鼠穿越原平臺次數明顯少于假手術組(P<0.01);與模型組比較,銀杏葉片組、山臘梅葉揮發油高和低劑量組大鼠穿越原平臺次數明顯增多(P<0.05),其中,山臘梅葉揮發油高劑量組差異極顯著(P<0.01)。表明大鼠VD模型復制成功且山臘梅葉揮發油高、低劑量組均能改善VD大鼠的學習、記憶及認知能力。
2.3 各組大鼠曠場試驗結果比較
5組大鼠曠場軌跡圖見圖3。對比各組垂直得分(圖4A),模型組大鼠垂直得分明顯低于假手術組(P<0.05);與模型組比較,銀杏葉片組、山臘梅葉揮發油高、低劑量組大鼠垂直得分明顯增高(P<0.05),其中,山臘梅葉揮發油高、低劑量組差異極顯著(P<0.01)。對比各組水平得分(圖4B),模型組大鼠水平得分明顯低于假手術組(P<0.01);與模型組比較,銀杏葉片組、山臘梅葉揮發油高、低劑量組大鼠水平得分明顯增高(P<0.05),其中,山臘梅葉揮發油高、低劑量組差異極顯著(P<0.01)。表明大鼠VD模型復制成功且山臘梅葉揮發油高、低劑量組均能改善VD大鼠的探索運動能力。
2.4 各組大鼠血清SOD活性比較
從圖5A可以看出,模型組大鼠血清中SOD活性明顯低于假手術組(P<0.01),表明模型組大鼠氧自由基清除能力降低;與模型組比較,銀杏葉片組、山臘梅葉揮發油高、低劑量組大鼠血清中SOD活性明顯升高(P<0.05),表明山臘梅葉揮發油高、低劑量組均能提高VD大鼠氧自由基清除能力。
2.5 各組大鼠血清MDA含量比較
從圖5B可以看出,模型組大鼠血清中MDA含量較假手術組顯著升高(P<0.01);銀杏葉片組、山臘梅葉揮發油高、低劑量組大鼠血清中MDA含量則明顯低于模型組(P<0.05),表明山臘梅葉揮發油高、低劑量組均能降低VD大鼠腦組織脂質過氧化程度。
2.6 各組大鼠海馬組織CA1區病理切片比較
常規HE染色后,在光學顯微鏡(×200)下觀察海馬CA1區,結果顯示(圖6),假手術組椎體細胞排列整齊,結構完整,細胞數目多,細胞核圓形居中清晰可見;模型組大鼠海馬CA1區椎體細胞結構排列稀疏錯雜,細胞數目較其他組明顯減少,并且大部分細胞壞死,核仁模糊;銀杏葉片組和山臘梅葉揮發油高劑量組大鼠海馬CA1區神經元細胞較完整,排列較密集規整,細胞數目較多,有散在少量壞死神經元。山臘梅葉揮發油低劑量組較銀杏葉片組和山臘梅葉揮發油高劑量組次之。表明山臘梅葉揮發油高、低劑量組均能減輕VD大鼠腦組織海馬CA1區損傷程度。
3 討論與結論
癡呆在老年慢性疾病中占有突出地位[16],VD是AD之后最常見的癡呆原因之一,約15%的病例是由VD引起[3]。VD是癡呆中唯一一種可藥物預防的疾病[2],但目前尚無針對VD的正規治療方法及特異性藥物,故研發安全有效的治療藥物十分必要。
MDA是脂質過氧化反應的重要產物,能較好反映體內自由基程度,SOD是機體清除自由基的重要酶類之一,可間接反映機體抗氧化水平的強弱。腦部缺血缺氧,會引起細胞膜和細胞質的脂質過氧化,從而產生大量自由基,導致SOD被消耗,MDA大量產生[17-19]。氧化應激反應是引發腦血管損傷的主要原因之一,腦內自由基的大量堆積最終會導致腦細胞受損,加重VD病情[20]。故大鼠體內MDA、SOD的生成水平能間接反映VD的病情程度。此次試驗結果表明,模型組大鼠有明顯的氧化應激損傷,而治療組在山臘梅葉揮發油的干預下減輕了氧化應激反應對機體的損傷,說明山臘梅葉揮發油能夠通過減少氧化應激損傷而發揮VD的防治和治療作用。
海馬組織是儲存記憶的重要部位,被認為是認知功能及記憶的關鍵結構,其中CA1是腦缺血缺氧最敏感的區域[21]。研究發現,血管性癡呆大鼠海馬區神經元大量凋亡丟失,而海馬缺血性損傷是VD的重要病理基礎之一[22-24]。海馬CA1區與空間探索和認知功能有著密切聯系,故在該試驗中主要以海馬CA1區作為病理切片的觀察對象。此次試驗結果表明,模型組大鼠海馬CA1區大量神經細胞壞死且排列稀疏錯亂,治療組在山臘梅葉揮發油的干預下減輕了海馬CA1區神經細胞損傷程度,說明山臘梅葉揮發油對神經細胞有一定的保護作用。
氧化損傷被認為是VD發生的機制之一,該試驗結果中山臘梅葉揮發油高、低劑量組均能提升VD大鼠腦組織內SOD活性,有效降低MDA含量,清除大鼠腦組織內氧自由基,減輕了氧化應激對中樞神經系統的損傷,一定程度上保護了大鼠腦海馬CA1區的神經元細胞,從而改善大鼠的認知功能障礙,提高了VD大鼠學習、記憶、認知、探索運動等能力。這可能是山臘梅葉揮發油改善VD大鼠認知功能的機制之一,但進一步機制尚需深入研究,也為山臘梅葉的深度開發提供了研究方向和基礎。
參考文獻
[1]
韓鮮艷.血管性認知障礙的危險因素分析及其與腦血流動力學的相關性研究[D].南京:東南大學,2016.
[2] 孫惠萍,詹小蘭,孫張弛.納米脂質體包載輔酶Q10改善血管性癡呆小鼠學習記憶功能的實驗研究[J].中國醫院藥學雜志,2020,40(4):406-411.
[3]OBRIEN J T,THOMAS A.Vascular dementia[J].Lancet,2015,386(10004):1698-1706.
[4] SINHA K,SUN C C,KAMARI R,et al.Current status and future prospects of pathophysiologybased neuroprotective drugs for the treatment of vascular dementia[J].Drug discovery today,2020,24(4):793-799.
[5] 李姝臻,錢海兵.民族藥臘梅葉總黃酮對老年癡呆小鼠的影響[J].時珍國醫國藥,2014,25(2):330-331.
[6] 王玉婷,丁虹,邱春玉,等.山臘梅葉醇提物對慢性應激抑郁模型小鼠行為學及腦內單胺類神經遞質的影響[J].中成藥,2015,37(5):1087-1090.
[7] MOHAMMED SUR T,AKBABA H,HASSAN S A,et al.Neuropharmacological profile of Hypericum scabrum L.essential oil in rats[J].Journal of essential oil research,2020,32(1):79-87.
[8] SCUTERI D,ROMBOL L,MORRONE L A,et al.Neuropharmacology of the neuropsychiatric symptoms of dementia and role of pain:Essential oil of bergamot as a novel therapeutic approach[J].International journal of molecular science,2019,20(13):3327-3340.
[9] SATOU T,HANASHIMA Y,MIZUTANI I,et al.The effect of inhalation of essential oil from Rosmarinus officinalis on scopolamineinduced Alzheimer's type dementia model mice[J].Flavour and fragrance journal,2018,33(3):230-234.
[10] 蔣征奎,李曉,陳卓.石菖蒲揮發油對鏈脲佐菌素致大鼠癡呆模型學習記憶能力的影響[J].中國老年學雜志,2018,38(2):263-265.
[11] 王群,王擁軍.嚙齒類血管性癡呆動物模型[J].中國卒中雜志,2015,10(4):279-283.
[12] 梁慧英,廖琳,游國清,等.電針對血管性癡呆大鼠記憶力及海馬BDNF、PSD-95蛋白表達的影響[J].中國康復醫學雜志,2019,34(8):902-906,949.
[13] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[14] 井杰.耳針對血管性癡呆大鼠認知功能改善的動態評價研究[D].合肥:安徽中醫藥大學,2014.
[15] 楊超,程紅亮,薛曉婕,等.針刺對血管性癡呆大鼠TNF-α水平及神經行為學的影響[J].長春中醫藥大學學報,2018,34(4):645-648.
[16] KORCZYN A D,VAKHAPOVA V,GRINBER L T,et al.Vascular dementia[J].Journal of the neurological sciences,2012,322(1/2):2-10.
[17] 趙奕.通督調神針刺法治療血管性癡呆的臨床研究[D].廣州:廣州中醫藥大學,2013.
[18] 胡躍強,唐農,吳林,等.中醫綜合治療方案配合治療血管性癡呆110例臨床觀察[J].中醫雜志,2015,56(6):487-491.
[19] 閆安,謝云亮.當歸多糖對腦缺血再灌注損傷大鼠腦組織氧化應激水平及炎癥因子表達的影響[J].中國實驗方劑學雜志,2018,24(2):123-127.
[20] 李建瑞,馬冉冉,樊新紅,等.血清MDA、SOD、IL-1β、IFN-γ在血管性癡呆中的表達及與神經功能、預后的關系[J].海南醫學,2020,31(4):433-437.
[21] 李曉曉.骨髓間充質干細胞移植對慢性腦缺血大鼠認知功能及海馬區EphB2的影響[D].鄭州:鄭州大學,2013.
[22] 沈瑞樂.丁基苯酞對慢性腦缺血老齡大鼠海馬區Chat的影響[D].鄭州:鄭州大學,2007.
[23] ZHAO T F,FU Y X,SUN H,et al.Ligustrazine suppresses neuron apoptosis via the Bax/Bcl2 and caspase3 pathway in PC12 cells and in rats with vascular dementia[J].IUBMB Life,2018,70(1):60-70.
[24] 陳婷婷,周雪,徐旖旎,等.天麻超微粉調控膽堿能系統改善血管性癡呆大鼠學習記憶能力[J].中國實驗方劑學雜志,2020,26(15):26-32.

