DFG-STYK1/NOK對小鼠胚胎成纖維細胞系NIH3T3增殖以及細胞周期G1/S的影響
陳建苗
(中國醫學科學院基礎醫學研究所 北京協和醫學院基礎學院 病原生物學系, 北京 100005)
受體酪氨酸激酶(receptor tyrosine kinases,RTKs)是一種對細胞增殖、分化、細胞周期、胚胎形成、血管生成和新陳代謝等細胞活動的進行具有重要意義的蛋白酶[1-2]。因此,RTKs表達異常會引起多種疾病和腫瘤[3-4]。RTKs胞外區與配體結合,激活RTKs胞內區的激酶活性,使含有Src同源區2(Src homology 2,SH2)和磷酸酪氨酸結合區(phosphotyrosine binding,PTB)結構域的蛋白與胞內區段結合被激活蛋白酶活性[1]。NOK(the novel oncog-ene with kinase-domain,NOK)是一種新型受體酪氨酸激酶。研究發現 NOK具有致癌作用[5]。對多種腫瘤的發生發展以及預后具有重要意義[6-8]。Asp-Phe-Gly(DFG)基序位于激酶活性中心活化環的起始部位,由天冬氨酸殘基、苯丙氨酸殘基和甘氨酸殘基3個氨基酸殘基組成,對調節激酶活性具有重要意義[9-11]。然而,研究發現,NOK激酶中沒有此結構。于是,本研究擬通過同源配對定點加入DFG基序,以探究DFG-NOK對NIH3T3細胞增殖和細胞周期G1/S的影響。
1 材料與方法
1.1 材料
小鼠胚胎成纖維細胞系NIH3T3(中國醫學科學院基礎醫學研究所細胞資源中心);新生牛血清(蘭州民海生物工程有限公司);DMEM培養基(Gibco公司);Neofect 轉染試劑(北京碼因科技有限公司);MTT試劑(Sigma公司);CCK8試劑(MedChenExpress公司);Western blot相關試劑和PI染料(北京鼎國昌盛生物技術有限公司);PCR引物、pcDNA3.0-DFG-NOK的構建及測序(上海生工公司);感受態大腸桿菌(天根生化科技有限公司);限制性內切酶和定點突變試劑盒(TaKaRa公司);抗β-actin和NOK抗體(Proteintech公司);抗Akt、p-Akt、 Erk、p-Erk和cyclin D1抗體(北京中杉金橋生物技術有限公司);抗STAT1抗體(北京博奧森生物技術有限公司);抗p-STAT1抗體(Bioworld公司);抗STAT3和p-STAT3抗體(Cell Signaling公司);抗JAK3和p-JAK3抗體(Anbo公司)。
1.2 方法
1.2.1 細胞的培養與轉染:將NIH3T3細胞置于含有10%新生牛血清DMEM的50 mm培養皿中,于37 ℃,5% CO2培養箱中培養,3 d傳代1次。貼壁細胞達到90%匯合后,接種到30 mm培養皿中,24 h后換液。用Neofect高效轉染試劑順時轉染NIH3T3細胞,分別轉入pcDNA3.0、 pcDNA3.0-NOK和pcDNA3.0-DFG-NOK,轉染6 h后換液,48 h后收細胞。
1.2.2 定點突變:突變使用定點突變試劑盒,按說明書操作。
1.2.3 質粒的構建:NOK激酶cDNA全長和HA(人流感病毒血凝素)標簽蛋白融合,插入到pcDNA3.0載體的HindⅢ和XbaⅠ位點形成pcDNA-NOK質粒;DFG-NOK和FLAG標簽蛋白融合,插入到pcDNA3.0載體的HindⅢ和NotⅠ位點形成pcDNA3.0-DFG-NOK質粒。pcDNA-DFG-NOK質粒的上游引物5′-ATAAGCTTATGGGCATGACACGGATG CT-3′,下游引物5′-ATGCGGCCGCTCACTTATCGT CGTCATCCTTGTAATCAAGCATGCTATAGTTGTAGA-3′。PCR反應擴增30個循環,94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1 min。擴增產物經雙酶切再亞克隆進pcDNA3.0載體,在感受態大腸桿菌中轉化克隆,提取質粒并對擴增片段進行測序分析。
1.2.4 Western blot檢測蛋白表達:收集細胞,裂解液冰上裂解30 min,12 000 r/min離心5 min收取蛋白,BCA工作液紫外分光光度計檢測蛋白樣品濃度,每孔蛋白上樣量15 μg,100 ℃沸水浴5 min。12% SDS-聚丙烯酰胺凝膠分離膠電泳,轉膜,5%脫脂牛奶37 ℃封閉1 h,一抗按比例用0.5%牛奶稀釋后4 ℃孵育過夜,用1×TBST洗4次,每次5 min,37 ℃孵育二抗1 h,清洗,ECL發光液反應,暗室曝光。
1.2.5 CCK8法檢測增殖:12孔板培養NIH3T3細胞,轉染pcDNA3.0、 pcDNA3.0-NOK或pcDNA3.0-DFG-NOK,再將細胞鋪置96孔板,培養48 h后,每孔加5 μL CCK8溶液,孵育1~2 h,酶標儀測定450 nm吸光度值;MTT法:12孔板培養NIH3T3細胞,轉染pcDNA3.0、 pcDNA3.0-NOK或pcDNA3.0-DFG-NOK,再將細胞鋪置96孔板,培養48 h后,每孔加10 μL MTT溶液,孵育4 h后棄上清,加入150 μL DMSO,在37 ℃搖床上振蕩10 min,測定490 nm處吸光度(A)值。
1.2.6 Accuri C6流式檢測細胞周期:收集2×106個細胞,1 000 r/min離心5 min,棄上清,加1 mL預冷的1×PBS重懸,1 000 r/min離心5 min,棄上清;加入0.3 mL預冷1×PBS,再逐滴加入3倍體積的4 ℃預冷的無水乙醇,輕輕振蕩成單細胞懸液;-20 ℃固定1 h以上;4 000 r/min離心5 min去乙醇,PBS洗兩遍,加100 μL 1×PBS重懸,加100 μL PI染色液避光染色10 min;流式細胞儀檢測,保存為FCS文件格式,使用Modfit軟件分析細胞周期分布。
1.2.7 同源比對:SWISS MODEL是一種同源建模服務器,根據NOK氨基酸序列同源構建蛋白三級結構,NOK的同源模板為成纖維細胞生長因子受體1(FGFR1),以FGFR1內DFG基序的位置,確定在NOK加入DFG基序的位置。
1.3 統計學分析

2 結果
2.1 DFG基序加入NOK的位置
根據其DFG基序位置確定NOK中DFG基序位置(圖1)。將第269、270位G、L改為D、F,和第271位氨基酸組成DFG基序,對應于NOK cDNA第806、807、810位核苷酸G、A、A突變為A、C、T。
2.2 DFG-NOK對NIH3T3細胞增殖的影響
與瞬時轉染pcDNA3.0組相比,瞬時轉染pcDNA3.0-DFG-NOK的NIH3T3細胞組吸光度降低,增殖受到抑制(圖2A,B)(P<0.05)。
2.3 DFG-NOK對NIH3T3細胞周期G1/S期的影響
與轉染pcDNA3.0組相比,轉染pcDNA3.0-DFG-NOK組,G1期所占比例升高,S期所占比例降低。DFG-NOK抑制細胞周期G1期進入S期(圖3)(P<0.05)。
2.4 DFG-NOK對細胞信號通路和周期蛋白表達的影響
與轉染pcDNA3.0組相比,轉染pcDNA3.0-DFG-NOK組Erk、STAT1、STAT3和JAK3蛋白的磷酸化水平(圖4A~C,E~H) 以及細胞周期蛋白cyclinD1表達水平均降低(圖4D, I)。
3 討論
NOK是一種新型受體酪氨酸激酶,包含422個氨基酸,鑲嵌在細胞膜上,具有完整的胞內區、跨膜區和遠小于其他受體酪氨酸激酶胞外區段的胞外區[5],它參與多種信號通路的激活,比如RAS-MAPK、PI3K-AKT和JAK-STAT等信號通路[12]。NOK在不同物種或組織器官中異常表達,人體內前列腺中的NOK表達量最高,小鼠體內小腸和結腸中表達量最高。293T和HeLa等細胞系中的NOK表達高于其他細胞系[5]。NOK在膠質瘤和鼻咽癌中激活PI3K-AKT信號通路[7-8]。此外,NOK對細胞周期也有重要作用,研究證明NOK可促進293T cyclin D1表達和細胞周期G1期進入S期[13]。
DFG分為兩種構像DFG-in和DFG-on,存在于Src和P38等激酶中,對激酶活性起到重要作用[9-11]。比對NOK氨基酸序列發現其沒有DFG基序。至今沒有關于DFG基序和NOK激酶相關聯的研究。基于以上科研背景,展開此項關于DFG-NOK的研究。
本研究選擇NIH3T3細胞為研究對象,展開DFG-NOK對細胞信號通路、細胞周期及細胞增殖影響的研究。實驗發現,NOK加入DFG基序后抑制增殖信號通路Erk、STAT3、JAK3的磷酸化和周期蛋白cyclin D1的表達;同時,也抑制NIH3T3細胞增殖和細胞周期由G1期進入S期。因此,推論NIH3T3細胞增殖的抑制可能是由于p-Erk、p-STAT3和p-JAK3表達下降引起的;細胞周期G1期進入S期阻滯可能是周期蛋白cyclin D1表達水平下降引起的,而G1期進入S期的抑制也引起細胞增殖的抑制。STAT1是細胞凋亡相關信號通路,對于結果中pcDNA3.0-DFG-NOK抑制p-STAT1表達原因還不清楚,需進一步對NIH3T3細胞進行凋亡檢測。DFG-NOK中GLG突變為DFG,甘氨酸突變為天冬氨酸,非極性氨基酸變為酸性氨基酸,亮氨酸突變為苯丙氨酸,非極性氨基酸變為芳香族氨基酸,氨基酸性質的改變,致使各氨基酸殘基之間的空間構象和相互作用力改變。
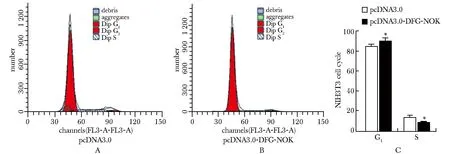
A.Accuri C6 result of NIH3T3 transiently transfected pcDNA3.0;B.Accuri C6 result of NIH3T3 transiently transfected pcDNA3.0-DFG-NOK;C.statistics analysis of the G1/S phase distribution; *P<0.05 compared with pcDNA3.0
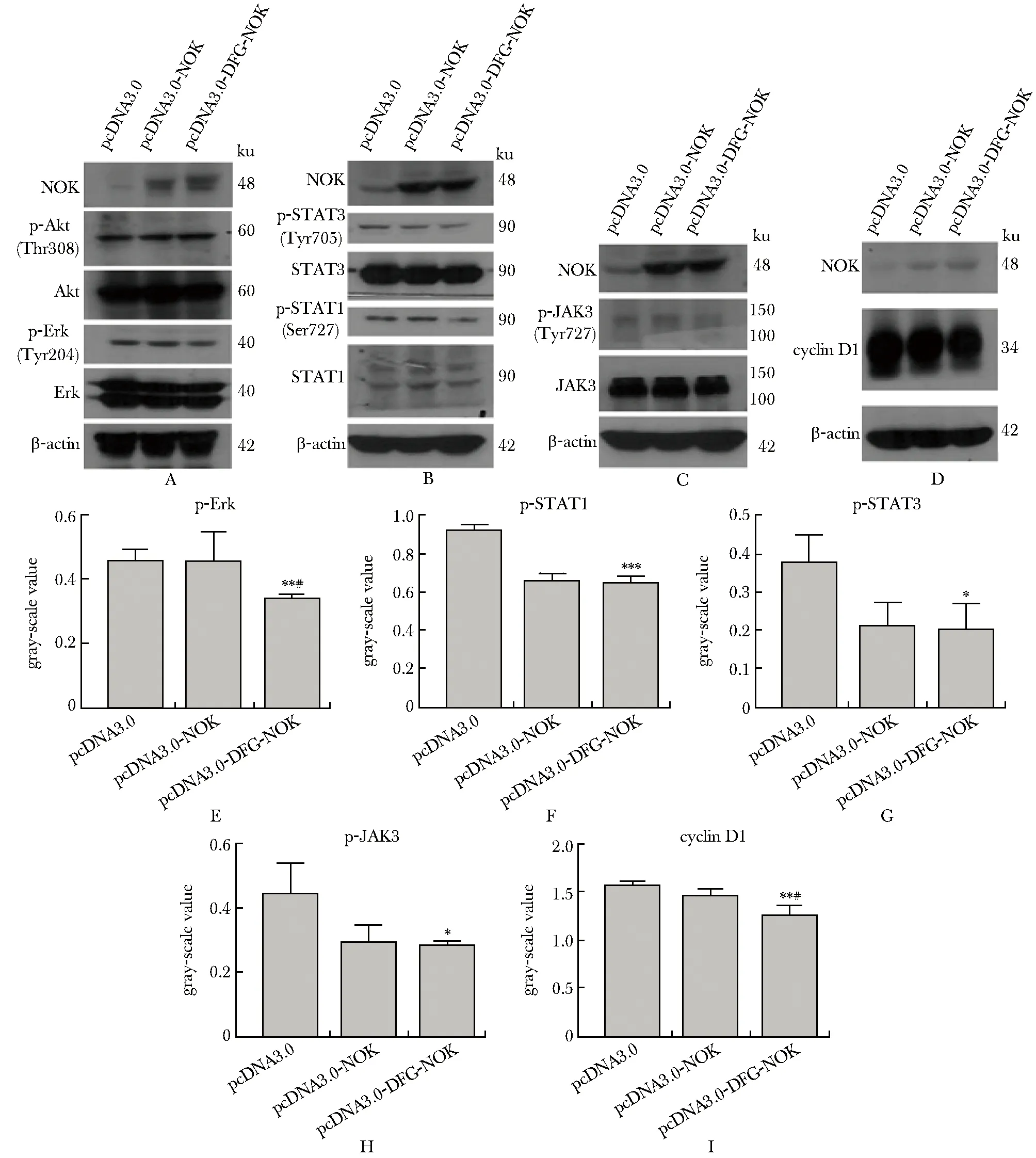
A.changes of Akt,p-Akt、Erk,p-Erk protein expression in responding to DFG-NOK over expression; B.changes of STAT1,p-STAT1,STAT3,p-STAT3 protein expression in responding to DFG-OK over expression;C.changes of JAK3,p-JAK3 protein expression in responding to DFG-NOK over expression;D.changes of cyclinD1 protein expression in responding to DFG-NOK over expression;E.gray-scale value of p-Erk in responding to DFG-NOK over expression;F.gray-scale value of p-STAT1 in responding to DFG-NOK over expression;G.gray-scale value of p-STAT1 in responding to DFG-NOK over expression; H.gray-scale value of p-STAT1 in responding to DFG-NOK over expression; I.gray-scale value of p-STAT1 in responding to DFG-NOK over expression; *P<0.05,**P<0.01,***P<0.001 compared with pcDNA3.0 group; #P<0.05 compared with pcDNA3.0-NOK group
本工作雖然證實DFG-NOK抑制NIH3T3細胞增殖和細胞周期G1期進入S期。但對于DFG-NOK的結構和引起這些作用的機制還未明確,需做進一步研究。

