CT檢查磨玻璃結節最大徑、實性成分比例及CT值與肺腺癌分型的關系研究
符浩男 王芬 樊樹峰 陳盈 楊海
隨著肺癌低劑量篩查的普及,CT檢出肺磨玻璃結節(ground glass nodule,GGN)越來越多。多數肺腺癌患者早期以GGN結節為主要表現,早期識別惡性GGN并分型是肺癌早期治療的關鍵[1]。依據當中的密度將GGN劃分成了兩種類型,若病灶中不存在實性成分為純磨玻璃結節(pure ground glass nodules,pGGN);病灶中有實性成分為混雜磨玻璃結節(mixed ground glass nodules,mGGN)[2-3]。若能建立簡單易行的CT定量參數系統判斷肺腺癌GGN的病理類型,對GGN的治療具有指導意義。基于此,本研究旨在探討肺腺癌GGN大小、實質成分比例、CT值在不同肺腺癌病理類型中的最佳界值,現報道如下。
1 對象和方法
1.1 對象 回顧2017年1月至2018年6月在臺州恩澤醫院經手術切除、病理確診為肺腺癌GGN的133例患者臨床資料,其中男60例,女73例;年齡28~81(54.5±11.2)歲;肺原位腺癌26例,肺微浸潤性腺癌40例,肺浸潤性腺癌67例。納入標準:(1)胸部CT薄層掃描顯示含磨玻璃密度結節;(2)肺窗(-450 HU,1 500 HU)GGN 橫斷面最大徑≤3 cm;(3)GE PACS內存中有完整的術前CT薄層掃描圖像,層厚為1.25 cm;(4)CT檢查前未行穿刺活檢或任何抗腫瘤治療;(5)臨床及病理資料保存完整。排除標準:(1)結節最大徑>3 cm;(2)肺內多發 GGN;(3)患者有肺內及其他部位原發腫瘤。
1.2 CT檢查方法 所有患者術前均采用Lightspeed 16層螺旋CT掃描儀(由美國GE公司生產)檢查,參數:管電流 100~180 mA、管電壓 120 kV、矩陣 512×512、螺距1.375、機架旋轉時間0.5 s。患者取仰臥位,深吸氣后屏氣,掃描范圍從肺尖至肺底。部分患者根據臨床需要,加做了靶結節三維掃描。通過多平面重建、最大密度投影對胸片薄層圖像進行后處理,從而可以更清晰地顯示結節的特點。
1.3 CT圖像評價 將CT圖像數據傳至圖像存儲和傳輸系統(picture archiving and communication systerms,PACS)(美國GE公司)后,由2位副主任醫師分別提取病灶特征,有異議時共同討論。分別記錄原位腺癌、微浸潤性腺癌、浸潤性腺癌的大小、CT值及CT值分布曲線。若整個病灶密度淺淡,無實性成分,定為pGGN;如果在病灶中有實性成分,定為mGGN[4-5]。病變大小用軸面圖像的最大徑表示。在對病變密度進行測量時,需要對3個位置進行CT值測量,并取其均值。CT值選取橫斷位病灶中心層面、肺窗薄層圖像、避開血管及支氣管。實性成分比例的計算為通過選定感興趣區、GE后處理圖像自動生成的CT值分布曲線進一步計算得出。因pGGN不含實性成分,本研究中實性成分比例計算實際是計算mGGN實性成分比例。據文獻報道,肺窗(-450 HU,1 500 HU)下,采用閾值為-350 HU 分析磨玻璃成分時,其相關性相對更好[6]。因此,本研究中GGN與實性成分的閾值限定為-350 HU,即若CT值>-350 HU,判定為病灶的實性成分,計算GGN中CT值>-350 HU部分占總GGN的比例。感興趣區的選擇:應包含病灶的全部成分,包括磨玻璃成分及實性成分,避開病灶內血管及支氣管。生成的CT值分布曲線,橫坐標為感興趣區的范圍,縱坐標為感興趣內不同CT值的構成。CT值分布曲線上-350 HU閾值的判斷由2位高年資醫師根據CT薄層圖像上的CT值及經驗綜合分析判斷,意見不一時協商達成一致。
1.4 病理診斷 病灶取材后將病灶整體切片HE染色,所有病變的病理診斷由2位病理科醫師討論后確定,按照2011年IASLC/ATS/ERS肺腺癌新分類標準[2]將所有病灶分為:(1)原位腺癌:病灶直徑≤3 cm,無間質、血管或胸膜浸潤;(2)微浸潤性腺癌:病變≤3 cm,腫瘤細胞完全沿肺泡壁生長且浸潤范圍≤0.5 cm;(3)浸潤性腺癌:病變≤3 cm,浸潤范圍>0.5 cm。
1.5 統計學處理 采用SPSS 22.0統計軟件。計量資料以表示,多組比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。繪制ROC曲線分析GGN大小、mGGN實性成分比例與CT值對肺腺癌分型的診斷價值。P<0.05為差異有統計學意義。
2 結果
2.1 各型肺腺癌GGN最大徑、mGGN實性成分比例與CT值比較 各型肺腺癌GGN最大徑、mGGN實性成分比例與CT值比較差異均有統計學意義(均P<0.05)。兩兩比較,肺浸潤性腺癌GGN大小、mGGN實性成分比例、mGGN CT值均>微浸潤性腺癌及肺原位腺癌(均P<0.05)。見表1。

表1 各型肺腺癌GGN大小、mGGN實性成分比例與CT值比較
2.2 GGN最大徑、mGGN實性成分比例與CT值對肺腺癌分型的診斷價值 ROC曲線分析顯示,肺微浸潤性腺癌與肺浸潤性腺癌間GGN大小的最佳界值為0.90 cm,AUC為 0.854,靈敏度為 0.842,特異度為0.750;肺微浸潤性腺癌與肺浸潤性腺癌間mGGN CT值的最佳界值為-436.5 HU,AUC為0.689,靈敏度為0.789,特異度為0.667;肺微浸潤性腺癌與肺浸潤性腺癌間mGGN實性成分比例的最佳界值為0.333,AUC為0.714,靈敏度為0.711,特異度為0.667。ROC曲線見圖1-3。
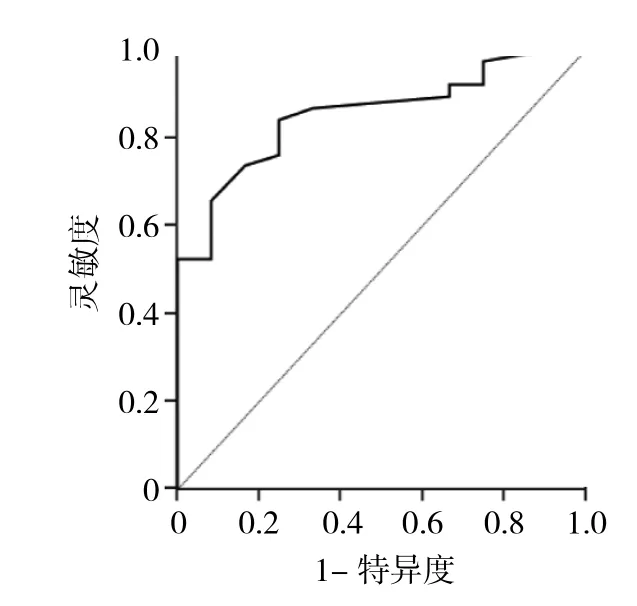
圖1 磨玻璃結節(GGN)最大徑診斷肺腺癌分型的ROC曲線
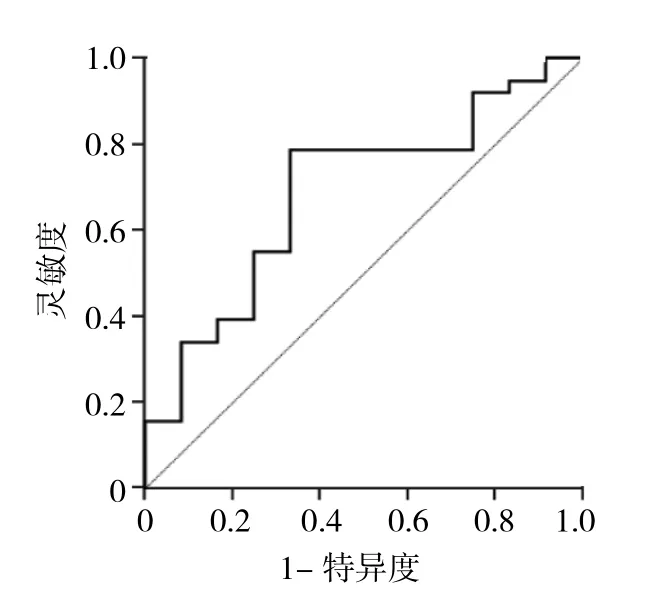
圖2 混雜磨玻璃結節(mGGN)實性成分比例診斷肺腺癌分型的ROC曲線
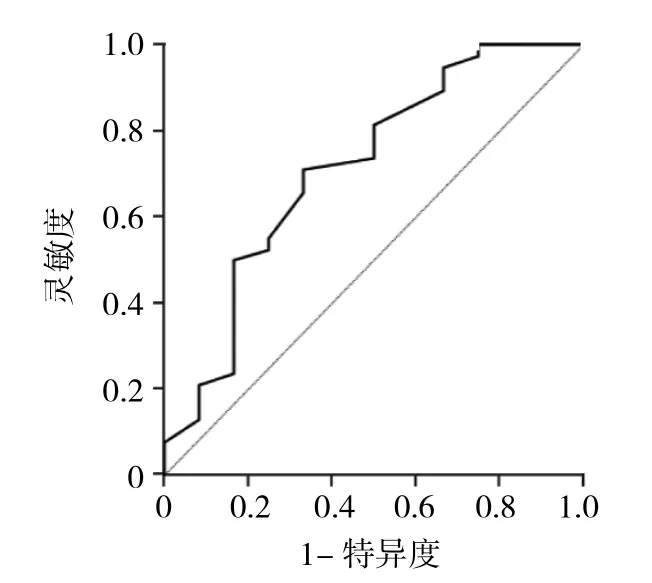
圖3 混雜磨玻璃結節(mGGN)CT值診斷肺腺癌分型的ROC曲線
3 討論
多數肺腺癌患者早期以GGN為主要表現,早期識別惡性GGN是肺癌早期治療的關鍵[1]。若能根據GGN影像特征,檢出惡性分險較高的結節并進行病理分型,具有重要的臨床意義。
國內外關于GGN病灶大小與病理分型間的相關性已有不少研究。Liu等[7]認為病變大小能預測病變浸潤性。有研究人員表明惡性GGN的最大徑普遍要大于不典型腺瘤樣增生;GGN越小越均勻,具有非常高的良性概率,然而也有部分研究人員發現GGN與良惡性診斷無太大關聯。Lee等[8]分析得出,當GGN的半徑<7 mm能夠有效診斷出浸潤前的病變,其靈敏度為0.6666,而特異度為0.7375。Liu等[7]對361例GGN的研究中得出GGN大小1.25 cm為鑒別侵襲性病變與非侵襲性病變的最佳界值;金鑫等[9]研究表明,鑒別浸潤性腺癌與其他類型腺癌的最佳界值為1.05 cm。Jin等[10]也得出類似結果,他們報道當GGN最大徑>1.05 mm時,GGN具侵襲性可能性為 88.73%。Eguchi等[11]將1.1 cm作為閾值來區分浸潤前病變與浸潤性病變。本研究顯示肺微浸潤性腺癌與肺浸潤性腺癌間GGN大小的最佳界值為 0.90 cm,AUC為 0.854,靈敏度為0.842,特異度為0.750,與文獻報道相符。
國內外對GGN密度有一些研究。Eguchi等[11]對肺內161例亞實性結節的研究表明肺原位腺癌、肺微浸潤性腺癌及肺浸潤性腺癌GGN CT值分別約為-650、-625、-560 HU。Kitami等[12]的研究指出,浸潤前病變的直徑≤1 cm且CT值多≤-600 HU,而浸潤性病變的直徑>1 cm且CT值多>-600 HU。Jiang等[13]研究顯示肺原位腺癌的CT值約-600 HU,浸潤性病變與浸潤前病變相比,實性成分更高,平均CT值約-439 HU。考慮到mGGN用其單一層面CT值輔助評價可能帶來較大的組內或組間差異,本研究引入結節平均CT值即結節的平均密度來輔助評價。本研究顯示平均CT值在肺原位腺癌、肺微浸潤性腺癌及肺浸潤性腺癌間比較差異有統計學意義。腫瘤細胞早期沿著肺泡壁貼壁生長,不侵犯周圍結構,隨著腫瘤細胞向細胞壁浸潤,腫瘤細胞的增多及體積的增大,組織細胞內的組織增生,實性物質含量上升,造成結節密度的升高。另外,本組數據得出對于mGGN,侵襲性腺癌(肺微浸潤性腺癌、肺浸潤性腺癌)的CT值明顯較肺原位腺癌高,與肺浸潤性腺癌間mGGN CT值的最佳界值為-436.5 HU,AUC為0.689,靈敏度為0.789,特異度為0.667,與文獻報道相似。因此,mGGN的CT值也可以作為一項預測肺腺癌浸潤性的指標。
國內外關于實性成分與磨玻璃成分的閾值沒有定論,本文根據陳群慧等[6]的52例肺部孤立性小腺癌的研究,肺窗(-450 HU,1 500 HU)下,當采用閾值為-350 HU進行分析時,其相關性相對更好(r=0.691,P=0.000)。本組數據顯示對于mGGN,肺微浸潤性腺癌與肺浸潤性腺癌間mGGN實性成分比例的最佳界值為0.333,AUC為 0.714,靈敏度為 0.711,特異度為 0.667,與文獻報道相似。因此,mGGN的實性成分比例也可以作為一項預測浸潤性及預后的指標。
綜上所述,本研究結果顯示,GGN最大徑>0.90 cm,mGGN CT值>-436.5 HU且實性成分比例>0.333較有可能是浸潤性肺腺癌。本研究采用了-350 HU閾值法測量實性成分,避免了肉眼觀察的誤差,優于傳統的肺窗條件下對實性成分的定量測量。本研究中CT值分布曲線上-350 HU閾值的判斷由2位高年資醫師根據CT薄層圖像上的CT值及經驗綜合分析判斷,可能存在誤差,還需進一步完善。

