外周血炎癥指標(biāo)水平對HER-2陽性乳腺癌患者預(yù)后的影響*
黨少華 徐 敏 胡金月 孫永強(qiáng)
河南省鄭州市第三人民醫(yī)院 1 乳腺甲狀腺外科 2 內(nèi)分泌科 450000
人表皮生長因子受體2(Human epidermal growth factor receptor 2,HER-2)是一種存在于乳腺癌細(xì)胞表面的蛋白質(zhì),主要介導(dǎo)細(xì)胞的生長與分化,可導(dǎo)致乳腺癌細(xì)胞的增殖及惡性轉(zhuǎn)化,是乳腺癌發(fā)生發(fā)展過程中重要的信號傳導(dǎo)通道[1]。原發(fā)性乳腺癌中有15%~20%存在HER-2基因的擴(kuò)增或過表達(dá),HER-2陽性乳腺癌定義為激素受體(Hormone receptor, HR)陰性和HER-2陽性,HER-2陽性表達(dá)的乳腺癌患者較HER-2陰性表達(dá)的乳腺癌患者表現(xiàn)出更差的預(yù)后。目前,抗HER-2靶向的新輔助治療(Neoadjuvant chemotherapy, NAC)被廣泛用于治療HER-2陽性的乳腺癌[2],可明顯改善預(yù)后,提高病理完全緩解(pathological complete response,pCR)率。近年來研究發(fā)現(xiàn)外周血炎癥免疫因子在多種惡性腫瘤的發(fā)生及發(fā)展過程中發(fā)揮了重要的作用,炎癥反應(yīng)通過改變腫瘤微環(huán)境,使其產(chǎn)生多種細(xì)胞因子及趨化因子加重腫瘤炎癥反應(yīng),進(jìn)而促進(jìn)腫瘤的發(fā)生發(fā)展與轉(zhuǎn)移[3]。中性粒細(xì)胞能促進(jìn)腫瘤細(xì)胞增殖及血管生長,促使腫瘤發(fā)生轉(zhuǎn)移,淋巴細(xì)胞則在抗腫瘤免疫發(fā)揮著重要的作用,是炎癥反應(yīng)中的關(guān)鍵免疫細(xì)胞[4],中性粒細(xì)胞/淋巴細(xì)胞比值(Neutrophilto lymphocyte ratio,NLR)代表炎癥激活因子中性粒細(xì)胞與炎癥調(diào)節(jié)因子淋巴細(xì)胞之間的平衡狀態(tài),NLR作為機(jī)體炎癥反應(yīng)最直觀的生物標(biāo)志物,可反映機(jī)體的炎癥反應(yīng)狀態(tài)和免疫水平。多項(xiàng)研究證明[5-6]乳腺癌中系統(tǒng)性炎癥反應(yīng)被認(rèn)為是預(yù)后不良的獨(dú)立危險(xiǎn)因素,且對乳腺癌復(fù)發(fā)及轉(zhuǎn)移有預(yù)測價(jià)值。本研究收集HER-2陽性乳腺癌患者的臨床資料,進(jìn)行回顧性的分析,探討外周血炎癥指標(biāo)對HER-2陽性乳腺癌NAC療效預(yù)測及預(yù)后的關(guān)系,為評估HER-2陽性乳腺癌患者治療的療效和監(jiān)測HER-2陽性乳腺癌患者預(yù)后提供臨床證據(jù)。
1 對象與方法
1.1 對象 回顧性分析2012年1月—2018年1月于我院乳腺甲狀腺外科接受新輔助化療的85例HER-2陽性的乳腺癌患者的臨床資料。所選對象均經(jīng)空芯針穿刺活檢及免疫組化學(xué)證實(shí)為HER-2陽性的乳腺癌,患者均為女性,年齡28~65歲,平均年齡(42.91±7.36)歲,病理類型均為浸潤性癌。 納入標(biāo)準(zhǔn):(1)初診,年齡≥18歲;(2)腫瘤分期為Ⅱ~Ⅲ;(3)免疫組化學(xué)檢測為HER-2陽性;(4)行新輔助化療。排除標(biāo)準(zhǔn):(1)妊娠以及哺乳期者;(2)病理確診結(jié)果為除浸潤性乳腺癌之外的其他組織學(xué)分型者;(3)合并其他惡性腫瘤者;(4)術(shù)前影像學(xué)檢查結(jié)果提示存在遠(yuǎn)處可疑轉(zhuǎn)移;(5)存在嚴(yán)重肝、腎以及心臟功能不全者;(6)術(shù)前接受內(nèi)分泌治療或行局部放療者。本研究經(jīng)我院醫(yī)學(xué)倫理委員會批準(zhǔn),所有患者均簽署知情同意書,并自愿參加本研究。
1.2 檢測方法 所有入組患者均于NAC前進(jìn)行血液樣本采集,通過血液分析儀Sysmex XS-800i (Sysmex公司,Japan)檢測結(jié)果報(bào)告中提取外周血免疫炎癥因子的指標(biāo)信息,包括淋巴細(xì)胞計(jì)數(shù)、中性粒細(xì)胞計(jì)數(shù)及兩者之間的比值。
1.3 治療方案 根據(jù)患者個(gè)人意愿及經(jīng)濟(jì)條件選擇是否接受曲妥珠單抗治療。(1)TAC方案:多西他賽(江蘇恒瑞醫(yī)藥股份有限公司,國藥準(zhǔn)字H20020543)75mg/m2;環(huán)磷酰胺(山西普德藥業(yè)股份有限公司,國藥準(zhǔn)字H14023686)500mg/m2;吡柔比星(海正輝瑞制藥有限公司,國藥準(zhǔn)字H20045983)50mg/m2,以上化療藥物均經(jīng)靜脈滴注,每21d為1個(gè)治療周期,共4~6 個(gè)周期,每次入院第2天給予化療藥物。(2)TCH方案:曲妥珠單抗(上海羅氏制藥有限公司,國藥準(zhǔn)字J20110020)首次8mg/kg,后續(xù)每次6mg/kg;多西他賽(江蘇恒瑞醫(yī)藥股份有限公司,國藥準(zhǔn)字H20020543)75mg/m2,卡鉑(齊魯制藥有限公司,國藥準(zhǔn)字H20020180)0.3g/m2,以上化療藥物均經(jīng)靜脈滴注,每21d為1個(gè)治療周期,共6個(gè)周期,每次入院第2天給予化療藥物。NAC完成后接受手術(shù),手術(shù)方式均為乳腺癌改良根治術(shù)。
1.4 病理診斷及病例隨訪 對本研究中的85例患者,采用電話、門診復(fù)查、再次住院等方式進(jìn)行隨訪調(diào)查,以首次確診日為起點(diǎn),失訪和死亡發(fā)生日為終點(diǎn),隨訪截至2019年12月。將手術(shù)日后初次發(fā)生遠(yuǎn)處轉(zhuǎn)移或局部區(qū)域性復(fù)發(fā)定義為無病生存期(Disease-free survival,DFS)事件,若未發(fā)生復(fù)發(fā)轉(zhuǎn)移,將以隨訪終點(diǎn)或死亡為截尾時(shí)間。將任何原因引起的死亡定義為總生存期(Overall survival, OS)事件,若未發(fā)生OS事件,以末次隨訪時(shí)間為截點(diǎn)。HER-2陽性評估標(biāo)準(zhǔn):免疫組織化學(xué)結(jié)果顯示:“+++”或“++”且熒光原位雜交(Fluorescent in situ hybridization,F(xiàn)ISH)檢測結(jié)果顯示HER-2基因拷貝數(shù)擴(kuò)增>2.0。腋窩淋巴結(jié)及乳腺原發(fā)病灶均無浸潤性腫瘤細(xì)胞的殘留定義為pCR。
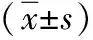
2 結(jié)果
2.1 外周血炎癥指標(biāo)的界值確定 85例HER-2陽性乳腺癌患者治療前外周血中性粒細(xì)胞計(jì)數(shù)(NC)為(3.23±1.59)×109/L[范圍(0.93~11.00)×109/L],根據(jù)ROC曲線結(jié)果顯示,敏感度和特異度分別為0.676、0.874,最佳臨界值為2.45×109/L(圖1a),根據(jù)最佳臨界值分為低中性粒細(xì)胞組(≤2.45×109/L)38例與高中性粒細(xì)胞組(>2.45×109/L)47例。85例HER-2陽性乳腺癌患者治療前外周血淋巴細(xì)胞計(jì)數(shù)(LC)為(1.84±0.56)×109/L[范圍(0.82~3.70)×109/L],根據(jù)ROC曲線結(jié)果顯示,敏感度和特異度分別為0.627、0.748,最佳臨界值為1.89×109/L(圖1b),根據(jù)最佳臨界值分為低淋巴細(xì)胞(≤1.89×109/L)57例與高淋巴細(xì)胞(>1.89×109/L)28例。85例HER-2陽性乳腺癌患者治療前外周血中性粒細(xì)胞計(jì)數(shù)/淋巴細(xì)胞計(jì)數(shù)比值(NLR)為(2.32±1.25)(范圍0.43~11.15),根據(jù)ROC曲線結(jié)果顯示,敏感度為0.615、特異度為0.883,最佳臨界值為2.06(圖1c),根據(jù)最佳臨界值分為低NLR(≤2.06)44例與高NLR(>2.06)41例。
2.2 85例HER-2陽性乳腺癌患者外周血炎癥指標(biāo)與pCR的相關(guān)性 治療前NLR低的患者較NLR高的患者獲得pCR率更高,差異具有統(tǒng)計(jì)學(xué)意義(P=0.038)。中性粒細(xì)胞計(jì)數(shù)、淋巴細(xì)胞計(jì)數(shù)則與病理完全緩解沒有明顯差異(P均>0.05)。見表1。
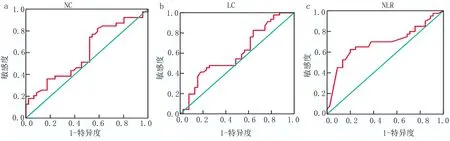
圖1 外周血炎癥指標(biāo)ROC曲線圖
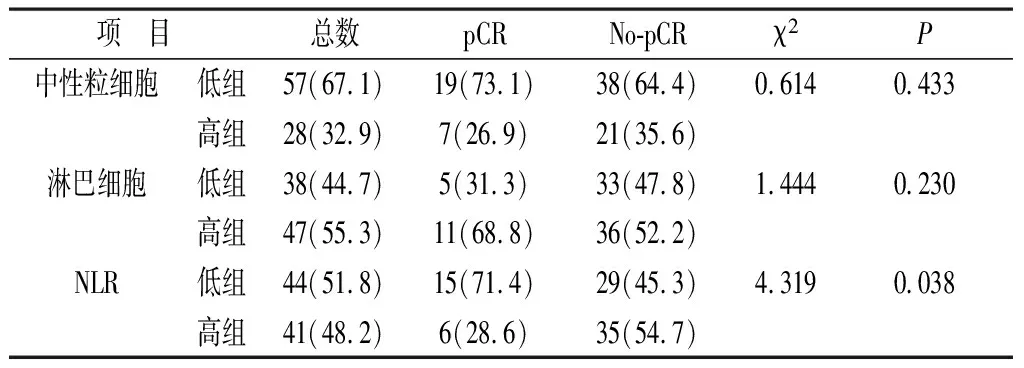
表1 85例HER-2陽性乳腺癌患者外周血炎癥指標(biāo)與pCR的相關(guān)性[n(%)]
2.3 外周血中炎癥指標(biāo)對HER-2陽性乳腺癌預(yù)后的評估價(jià)值 85例HER-2陽性乳腺癌患者隨訪時(shí)間10~61個(gè)月,平均隨訪(39.75±4.31)個(gè)月。隨訪過程中14例患者出現(xiàn)局部復(fù)發(fā)或轉(zhuǎn)移,由Kaplan-Meier生存分析顯示,中性粒細(xì)胞(圖2a)及淋巴細(xì)胞(圖2b)與DFS無明顯相關(guān)性(P=0.315、P=0.663),治療前NLR低的患者較NLR高的患者獲得更高的DFS(圖2c),差異具有統(tǒng)計(jì)學(xué)意義(P=0.011)。但治療前中性粒細(xì)胞(圖3a)、淋巴細(xì)胞(圖3b)及NLR(圖3c)與OS均未見顯著相關(guān)性(P均>0.05)。
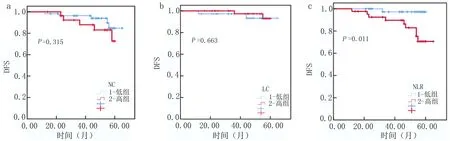
圖2 外周血炎癥指標(biāo)DFS Kaplan-Meier曲線圖

圖3 外周血炎癥指標(biāo)OS Kaplan-Meier曲線圖
3 討論
HER-2陽性是乳腺癌的一種亞型,約有20%的乳腺癌患者表現(xiàn)為HER-2基因的擴(kuò)增或過表達(dá),該亞型具有侵襲性強(qiáng)、預(yù)后差及易復(fù)發(fā)的特點(diǎn)[7]。近年來多項(xiàng)研究證明在乳腺癌的發(fā)生發(fā)展中炎癥反應(yīng)發(fā)揮著極其重要的作用,炎癥反應(yīng)通過改變腫瘤微環(huán)境,激活炎癥反應(yīng)通路,使其產(chǎn)生多種細(xì)胞因子與趨化因子加重腫瘤炎癥反應(yīng),改變機(jī)體免疫細(xì)胞分化與發(fā)育,促進(jìn)腫瘤的發(fā)生發(fā)展及轉(zhuǎn)移[8]。目前多項(xiàng)研究表明,炎癥微環(huán)境中的炎癥標(biāo)志物可以預(yù)測乳腺癌的進(jìn)展與預(yù)后,炎癥指標(biāo)反應(yīng)也可能是乳腺癌轉(zhuǎn)歸的一個(gè)重要標(biāo)志,對臨床病情評估及治療策略制定有指導(dǎo)意義。
外周血中性粒細(xì)胞/淋巴細(xì)胞比值(NLR)作為機(jī)體炎癥免疫反應(yīng)的一項(xiàng)指標(biāo),可以反映出機(jī)體全身炎癥反應(yīng)及免疫狀態(tài),術(shù)前NLR已被證實(shí)與包括乳腺癌在內(nèi)的多種腫瘤的預(yù)后相關(guān)。在乳腺癌中NLR升高刺激乳腺腫瘤血管生成,侵襲鄰近組織和轉(zhuǎn)移進(jìn)展細(xì)胞因子分泌,進(jìn)而抑制免疫細(xì)胞毒性發(fā)生抗腫瘤免疫反應(yīng),最終導(dǎo)致乳腺癌的發(fā)生與發(fā)展[9]。此外, NLR升高引起粒細(xì)胞集落刺激因子相關(guān)的中性粒細(xì)胞增多,淋巴細(xì)胞減少,導(dǎo)致腫瘤細(xì)胞發(fā)生免疫逃逸,為腫瘤細(xì)胞的增殖、侵襲、轉(zhuǎn)移提供有利條件,增加了乳腺癌患者復(fù)發(fā)風(fēng)險(xiǎn)[10]。由此表明,免疫細(xì)胞在乳腺癌的發(fā)生與發(fā)展中發(fā)揮著重要的作用,全身炎癥反應(yīng)結(jié)果將反映在NCR比值增加中,NCR比值越高炎癥反應(yīng)越嚴(yán)重且機(jī)體的免疫抑制越強(qiáng)烈,因此通過觀察乳腺癌患者NCR比值能間接地反映機(jī)體腫瘤相關(guān)的炎癥免疫狀態(tài),能更好地預(yù)測乳腺癌患者的病情發(fā)展及預(yù)后情況。Krenn等[11]通過對762名乳腺癌患者的研究結(jié)果顯示,治療前評估的NLR最佳臨界值>3時(shí)DFS存在明顯相關(guān)性,表明最佳臨界值NLR>3是乳腺癌患者DSF的一個(gè)獨(dú)立危險(xiǎn)因素,但與OS則無明顯相關(guān)性。關(guān)于NLR最佳截點(diǎn)的選擇,多項(xiàng)研究各不相同,本研究中通過ROC曲線選取NLR的最佳臨界值2.06,兼顧敏感性(0.615)及特異性(0.883),結(jié)果發(fā)現(xiàn)治療前外周血炎癥指標(biāo)與HER-2陽性乳腺癌不良預(yù)后因素密切相關(guān),即治療前NLR低的患者較NLR高的患者獲得更高的DFS,差異具有統(tǒng)計(jì)學(xué)意義(P=0.011),該結(jié)果與既往的研究相似,表明NLR升高對HER-2陽性乳腺癌患者具有更強(qiáng)的預(yù)測性。
在乳腺癌抗HER-2治療中無論是單靶治療還是雙靶治療,患者均可在新輔助治療后獲得較好的pCR率, pCR提示了較好的臨床結(jié)局[12]。然而,至今為止外周血炎癥因子對乳腺癌患者NAC后pCR率的影響的報(bào)道較少,有研究表明[13],乳腺癌患者NAC前進(jìn)行NLR檢測,NLR水平較低者NAC后pCR率相對較高。本研究分析外周血炎癥因子對HER-2陽性乳腺癌NAC后pCR率的影響,結(jié)果顯示85例入組患者中,21例患者(24.7%)于NAC后獲得pCR,進(jìn)一步研究表明NLR低水平組的pCR率明顯高于NLR高水平組(P<0.038),差異具有統(tǒng)計(jì)學(xué)意義,該結(jié)果與既往的研究結(jié)果相符,本研究中淋巴細(xì)胞計(jì)數(shù)與中性粒細(xì)胞計(jì)數(shù)與pCR率無明顯相關(guān)性,NLR對pCR的影響可能與NLR對機(jī)體的高抗腫瘤免疫潛能有關(guān),預(yù)示了機(jī)體對化療藥物的高應(yīng)答,而NLR比值越高pCR率越低,預(yù)示著NAC療效越差。
綜上所述,HER-2陽性乳腺癌患者NAC前檢測外周血炎癥細(xì)胞計(jì)數(shù)可以預(yù)測患者的化療敏感性及預(yù)后,該結(jié)果表明NAC前外周血NLR低的患者較NLR高的患者可明顯獲得更高的DFS與pCR率。本研究雖然提出NLR可以作為HER-2陽性乳腺癌患者NAC前的預(yù)測評價(jià)的指標(biāo),但筆者的樣本量相對有限,且樣本來源比較單一,因此具有一定的局限性,NLR最佳臨界值目前還沒有確定統(tǒng)一的標(biāo)準(zhǔn),不同樣本NLR最佳臨界值也盡不相同,仍需結(jié)合臨床應(yīng)用以及與傳統(tǒng)療效評價(jià)方式進(jìn)行進(jìn)一步的驗(yàn)證。

