常見有機化合物中碳原子的雜化方式與成鍵情況
陳謙,朱國磊,鄧麗華
西南林業大學化學工程學院,西南地區林業生物質資源高效利用國家林業和草原局重點實驗室,昆明 650224
結構決定性質、性質反映結構,這一辨證關系在有機化學中得到充分體現。在理解有機化合物結構的基礎上來學習有機化合物的性質(包括物理性質和化學性質)可以達到事半功倍的效果。由相同種類的原子構成的有機化合物中,由于各種原子的雜化方式及其成鍵情況的不同,可以形成不同的官能團,進而體現出不同的物理性質和化學性質[1]。所以,掌握有機化合物中各種原子的雜化方式及其成鍵情況是理解有機化合物結構的重要一環。本文針對常見有機化合物中碳原子的雜化方式及其成鍵情況進行了較為全面的歸納與整理,以方便讀者準確地把握有機化合物的結構與性質。
1 碳原子核外電子排布的基態與激發態
碳原子核外有6個電子,基態電子排布為1s22s22p2。由于同處于第二電子層的2s軌道與2p軌道的能級相近,所以2s軌道的電子吸收能量后可以躍遷到2p軌道中,其基態與激發態的電子在軌道中的排布如圖1所示。
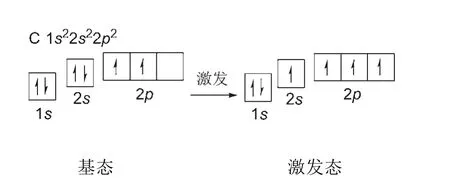
圖1 碳原子基態與激發態電子的軌道能級分布圖
由于碳原子中參與成鍵的只是最外層電子,即2s軌道和2p軌道中的電子,所以基態與激發態電子的軌道能級分布圖可省略為圖2所示。
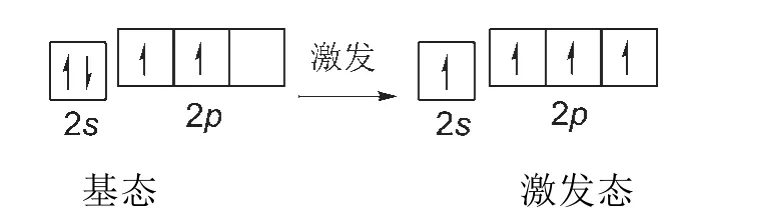
圖2 碳原子第二電子層基態與激發態電子的軌道能級分布圖
由圖2所知,處于激發態的2s軌道和2p軌道中的電子都是未成對電子,所以都有變成成對電子的趨勢,也即都有成鍵的趨勢。
2 碳原子雜化方式與成鍵
碳原子在與碳原子及其他原子(如氫原子、氧原子、氮原子等)結合成鍵的過程中,根據成鍵的要求,其能量相近的原子軌道進一步線性組合形成新的原子軌道[2]。不同原子軌道的線性組合,稱為原子軌道的雜化。雜化軌道的數目等于參與雜化的原子軌道數目,并包含原來的原子軌道的成分。同時,通過原子軌道線性組合所形成的雜化軌道方向性更強,成鍵的能力更強,也即原子軌道線性組合形成雜化軌道后更有利于成鍵。根據成鍵的需要,處于激發態的含有未成對電子的三個2p軌道中,可以貢獻出一個2p軌道與2s軌道雜化,形成兩個sp雜化軌道;也可以貢獻出兩個2p軌道與2s軌道雜化,形成三個sp2雜化軌道;還可以把三個2p軌道全部貢獻出來與2s軌道雜化,形成四個sp3雜化軌道。所以根據激發態中參與雜化的2p軌道的數目的不同,可以采取sp雜化、sp2雜化,sp3雜化[3]。
2.1 sp雜化
當處于激發態的含有未成對電子的三個2p軌道中貢獻出一個2p軌道與2s軌道雜化,此時形成兩個sp雜化軌道。兩個sp雜化軌道的空間分布呈直線型,未參與雜化的p軌道相互垂直且都垂直于雜化軌道的對稱軸。通過雜化形成的兩個新的sp雜化軌道可以與碳原子、氫原子、氮原子、氧原子等形成兩個σ鍵(一氧化碳分子中只形成一個σ鍵);而未參與雜化的兩個 2p軌道,各有一個電子,可以與碳原子、氮原子、氧原子等形成兩個π鍵(如圖3所示)。

圖3 碳原子sp雜化軌道形成示意圖
sp雜化軌道主要用于形成碳碳三鍵、碳氮三鍵、碳氧三鍵,存在于炔烴、氰基、一氧化碳、聯烯、碳化二甲酰亞胺、二氧化碳、烯酮等化合物中,如圖4所示。
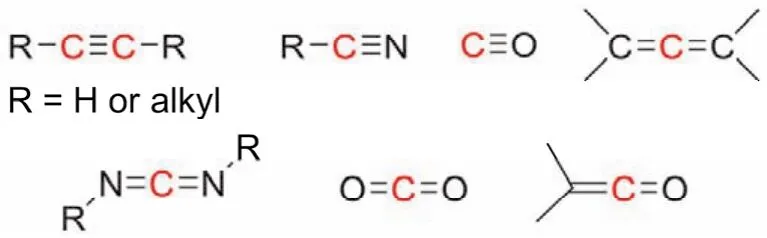
圖4 含有sp雜化軌道的化合物示意圖
在炔類化合物中,碳碳三鍵的碳原子采取sp雜化,形成兩個sp雜化軌道,其中的一個sp雜化軌道用于形成碳碳三鍵中的一個碳碳σ鍵,另一個sp雜化軌道用于與其他原子如氫(乙炔、端炔中)、碳(內炔、芳炔、烯炔中)等形成σ鍵。而每一個碳原子剩下的兩個未參與雜化的p軌道,則以肩并肩的形式從側面形成兩個π鍵。
在腈類化合物中碳氮三鍵的碳原子采取sp雜化,形成兩個sp雜化軌道,其中的一個sp雜化軌道用于形成碳氮三鍵中的一個碳氮σ鍵,另一個sp雜化軌道用于與其他原子如氫(氫氰酸中)、碳(腈類)等形成σ鍵。而碳原子剩下的兩個未參與雜化的p軌道,則以肩并肩的形式從側面與sp雜化的氮原子形成兩個相互垂直的π鍵。應用較為廣泛的溶劑乙腈的成鍵示意圖如圖5所示。
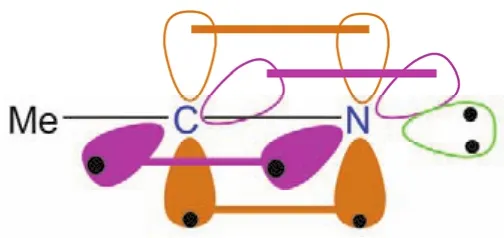
圖5 乙腈分子的成鍵情況
聯烯(丙二烯)中,中心碳原子采取sp雜化,形成兩個sp雜化軌道,分別與兩端sp2雜化的碳原子各形成一個碳碳σ鍵,而中心碳原子剩下的兩個未參與雜化的p軌道,則以肩并肩的形式從側面分別與兩端sp2雜化的碳原子形成兩個π鍵,此時形成的兩個π鍵是相互垂直的(圖6,丙二烯分子)。
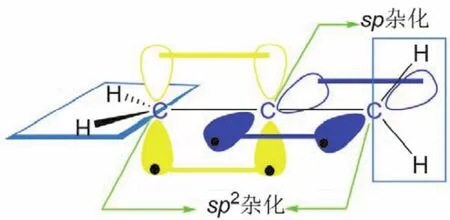
圖6 丙二烯分子的成鍵情況
碳化二甲酰亞胺分子結構與聯烯分子結構相似,中心碳原子采取sp雜化,形成兩個sp雜化軌道,分別與兩端sp2雜化的氮原子各形成一個碳氮σ鍵,而中心碳原子剩下的兩個未參與雜化的p軌道,則以肩并肩的形式從側面分別與兩端sp2雜化的氮原子形成兩個π鍵。用于肽鍵形成中的脫水劑二環己基碳化二甲酰亞胺(DCC)的成鍵示意圖如圖7所示。

圖7 二環己基碳化二甲酰亞胺(DCC)的成鍵示意圖
二氧化碳分子結構與碳化二甲酰亞胺分子結構相似,碳原子采取sp雜化,形成兩個sp雜化軌道,分別與兩端sp2雜化的氧原子形成一個碳氧σ鍵,碳原子剩下的兩個未參與雜化的p軌道,則以肩并肩的形式從側面分別與兩端sp2雜化的氧原子形成兩個π鍵,如圖8所示(二氧化碳分子)。
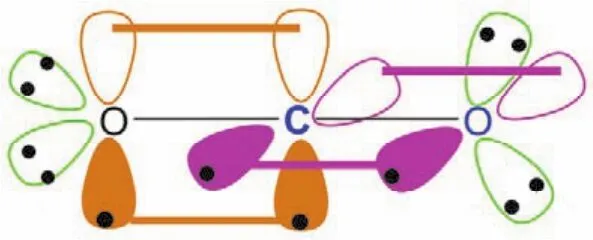
圖8 二氧化碳(CO2)的成鍵示意圖
烯酮分子結構與聯烯或二氧化碳分子結構相似,中心碳原子采取sp雜化,形成兩個sp雜化軌道,分別與兩端sp2雜化的氧原子及碳原子形成一個碳氧σ鍵和一個碳碳σ鍵,而中心碳原子剩下的兩個未參與雜化的p軌道,則以肩并肩的形式從側面分別與兩端sp2雜化的氧原子及碳原子形成兩個π鍵,二甲基烯酮的成鍵示意圖如圖9所示。

圖9 二甲基烯酮的成鍵示意圖
一氧化碳分子中的碳原子采取sp雜化,形成兩個sp雜化軌道,其電子的排布與上述幾種sp雜化略有不同。其中的一個sp雜化軌道用于形成碳氧三鍵中的一個碳氧σ鍵,另一個sp雜化軌道用于填充碳原子的一對孤對電子。碳原子剩下的兩個未參與雜化的p軌道中,其中一個含有未成對電子的p軌道用于與氧原子中含有未成對電子的p軌道形成π鍵;而另一個空的p軌道則用于填充來自于氧原子的孤電子對,以形成配位性π鍵,如圖10所示(一氧化碳分子)。
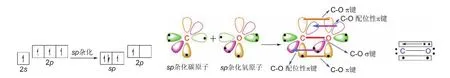
圖10 一氧化碳的成鍵示意圖
2.2 sp2 雜化
如圖11所示,處于激發態的含有未成對電子的三個2p軌道中貢獻出兩個2p軌道與2s軌道雜化,此時形成三個sp2雜化軌道。三個sp2雜化軌道的空間分布呈平面三角形,未參與雜化的p軌道垂直于雜化軌道所在的平面。通過雜化形成的三個新的sp2雜化軌道可以與碳原子、氫原子、氮原子、氧原子等形成三個σ鍵;而未參與雜化的一個2p軌道,含有1個電子,可以與含有1個電子的碳、氮、氧等原子的軌道形成一個π鍵。

圖11 碳原子sp2雜化軌道形成示意圖
sp2雜化軌道主要用于形成碳碳雙鍵、碳氮雙鍵、碳氧雙鍵、碳硫雙鍵等,存在于烯烴、芳環、芳雜環、醛、酮、亞胺、羧酸、酯、酰氯、酸酐、酰胺等化合物中,如圖12所示。
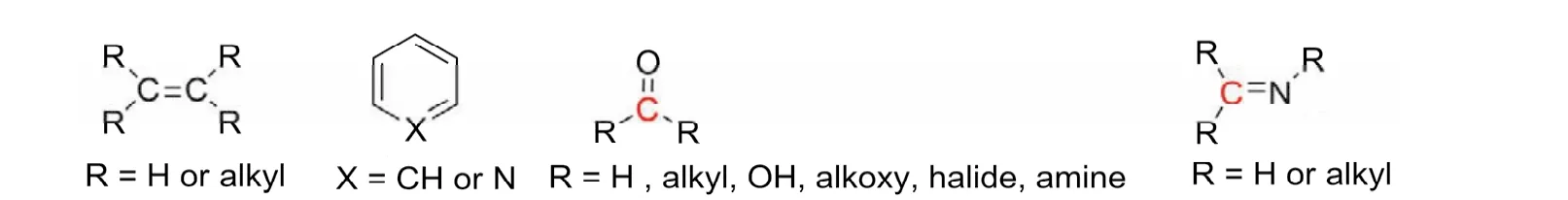
圖12 含有sp2雜化軌道的化合物示意圖
在烯烴類化合物中,碳碳雙鍵的碳原子采取sp2雜化,形成三個sp2雜化軌道,其中的一個sp2雜化軌道用于形成碳碳雙鍵中的一個碳碳σ鍵,另兩個sp2雜化軌道用于與其他原子如氫(乙烯)、碳(取代烯烴)等形成σ鍵。而形成碳碳雙鍵的兩個碳原子剩下的一個未參與雜化的p軌道,則以肩并肩的形式從側面形成一個π鍵(如圖13所示,肉桂醛分子中的烯烴部分)。
在芳烴類化合物中,芳香環的碳原子采取sp2雜化,形成三個sp2雜化軌道,其中的一個sp2雜化軌道用于形成一個環外碳氫σ鍵、碳碳σ鍵或碳雜σ鍵(取代芳烴),另兩個sp2雜化軌道用于與相鄰兩個碳原子形成σ鍵。芳香環上的每個碳原子剩下的一個未參與雜化的p軌道,則以肩并肩的形式從側面形成一個大π鍵(如圖13所示,肉桂醛分子中的苯基部分)。
在醛、酮、羧酸及其衍生物中,羰基的碳原子采取sp2雜化,形成三個sp2雜化軌道,其中的一個sp2雜化軌道用于與sp2雜化的氧形成碳氧σ鍵,另兩個sp2雜化軌道可用于與氫形成碳氫σ鍵(醛)(如圖13所示,肉桂醛分子中的醛基部分);可用于與碳形成碳碳σ鍵(酮),可用于與羥基、烷氧基或羧基中的氧形成碳氧σ鍵(注:羧酸在水溶液中易電離成羧酸根負離子,電離成負離子后,氧原子上帶有一個負電荷,這樣更有利于共軛,形成共振雜化體,在羧酸根負離子中兩個碳氧鍵是等價的,即兩個碳氧鍵都介于碳氧單鍵和碳氧雙鍵之間);可用于與鹵素形成碳鹵σ鍵;可用于與氮形成碳氮σ鍵。羰基碳原子剩下的一個未參與雜化的p軌道,則以肩并肩的形式從側面與sp2雜化的氧形成一個碳氧π鍵。

圖13 肉桂醛分子成鍵示意圖
亞胺類化合物結構與醛、酮類似,亞胺的碳原子采取sp2雜化,形成三個sp2雜化軌道,其中的一個sp2雜化軌道用于與sp2雜化的氮形成碳氮σ鍵,另兩個sp2雜化軌道用于與氫形成碳氫σ鍵(醛亞胺)或與碳形成碳碳σ鍵(酮亞胺)。亞胺碳原子剩下的一個未參與雜化的p軌道,則以肩并肩的形式從側面與sp2雜化的氮形成一個碳氮π鍵(如圖14所示,苯甲醛縮苯胺(亞胺)分子成鍵示意圖)。
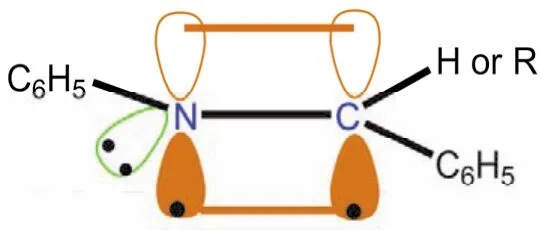
圖14 亞胺分子C=N成鍵示意圖
2.3 sp3雜化
如圖15所示,當處于激發態的含有未成對電子的三個2p軌道全部貢獻出來與2s軌道雜化,此時形成四個sp3雜化軌道。四個sp3雜化軌道的空間分布呈正四面體形。通過雜化形成的四個新的sp3雜化軌道可以與碳原子、氫原子、氮原子、氧原子等形成四個σ鍵。
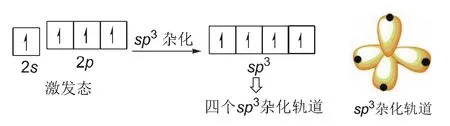
圖15 碳原子sp3雜化軌道形成示意圖
sp3雜化軌道主要用于形成飽和的碳碳σ鍵及碳氫σ鍵、碳氧σ鍵、碳氮σ鍵、碳硫σ鍵等飽和碳雜鍵,存在于飽和烷烴、醇、硫醇、醚、硫醚、脂肪胺等化合物中,如圖16所示。
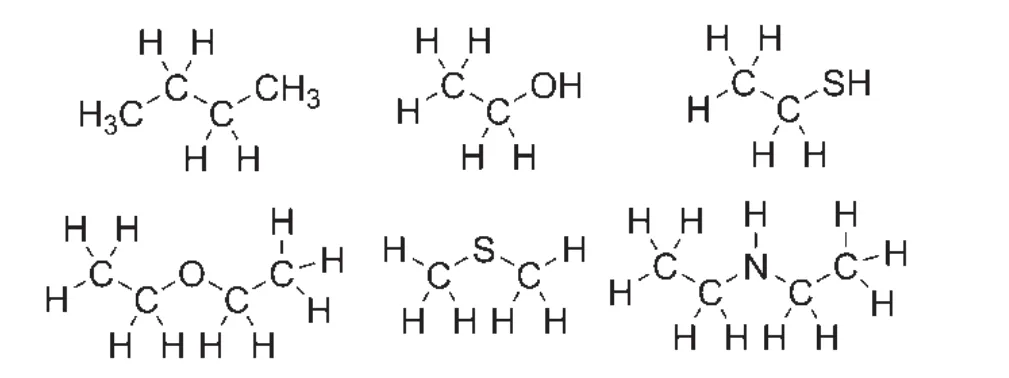
圖16 含有sp3雜化軌道的化合物示意圖
在飽和烷烴類化合物中,所有碳原子采取sp3雜化,形成四個sp3雜化軌道,sp3雜化軌道的碳原子要么用于與鄰近的碳原子形成碳碳σ鍵,要么用于與鄰近的氫原子形成碳氫σ鍵。
在醇及醚類化合物中,碳原子采取sp3雜化,形成四個sp3雜化軌道,sp3雜化軌道的碳原子除了兩類用于與鄰近的碳原子、氫原子形成碳碳σ鍵及碳氫σ鍵外,連氧碳原子的sp3雜化軌道還用于與sp3雜化的氧原子形成碳氧σ鍵(醇、醚中的連氧碳含有一個碳氧σ鍵;縮醛/酮中的連氧碳含有兩個碳氧σ鍵;原酸酯中含有三個碳氧σ鍵)。硫醇及硫醚類化合物中成鍵情況類似于醇及醚類化合物中,區別在于此時連硫碳原子形成的是碳硫σ鍵。
在脂肪胺類化合物中,碳原子采取sp3雜化,形成四個sp3雜化軌道,sp3雜化軌道的碳原子除了兩類用于與鄰近的碳原子或氫原子形成碳碳σ鍵及碳氫σ鍵外,連氮碳原子的sp3雜化軌道還用于與sp3雜化的氮原子形成碳氮σ鍵。
3 結語
大學生學習有機化學時覺得有機化學知識龐雜,覺得有機化合物性質不易掌握,對學習有機化學有畏難情緒,給有機化學教學帶來一定的困擾。在有機化學的教學中,讓學生學會從分析有機化合物結構入手來學習有機化合物的性質和規律則能較容易地掌握有機化學知識,從而提高教學效果。一方面,碳原子與碳原子之間可以形成碳鏈;另一方面,碳原子還可以與碳原子或其他雜原子之間形成官能團,而不同的碳鏈(如烷烴鏈、烯烴鏈)和不同的官能團中碳原子的雜化方式是不一樣的。所以,想要正確地分析有機化合物結構和理解、掌握有機化合物性質,熟知各種有機化合物中碳原子的雜化方式與成鍵情況是必要的。本文以碳原子的核外電子排布、基態、激發態為基礎,按照碳原子sp雜化、sp2雜化、sp3雜化的順序歸納了碳原子的雜化方式,并列舉了各種雜化狀態的常見有機化合物中的成鍵情況。對幫助學生學習有機化學知識、掌握有機化合物性質和規律,克服學生對學習有機化學的畏難情緒,提高有機化學教學效果將起到積極的作用。

