5株纖維菌屬菌株的分離、鑒定及產酶活性研究
王光琴,黃 鶯,溫明霞,芶劍渝,代 飛,丁夢嬌
(1貴州大學煙草學院,貴陽 550025;2貴州省煙草品質研究重點實驗室,貴陽 550025;3貴州省煙草公司遵義市公司,貴州遵義 563000;4貴州省煙草公司安順市公司,貴州安順 561000)
0 引言
全世界秸稈年產量超過29億t,中國是糧食生產大國,也是秸稈生產大國,每年生產的作物秸桿超過7億t,約占全世界秸稈總量的20%~30%[1]。作物秸稈作為農業生產的生物質副產品,具有巨大的潛在利用價值[2],特別是在改良土壤養分上被廣泛認可。秸稈還田可為作物生長提供必需的C、N等營養元素,也能改善土壤通氣疏水性,是構建肥沃耕層、提升土壤質量的重要措施[3-4]。作物秸稈結構極為穩定,其中纖維素是主要成分,占總量的35%~50%,是自然界中儲量最豐富的生物高分子[5],只有濃酸溶液、高濃度的氯化鋅水溶液、銅氨溶液和離子液體才可能破壞纖維素的晶體結構使其溶解[6]。所以秸稈直接還田降解速度慢不僅影響下茬作物的種植,還田不當也會造成農田面源污染[7]。
生物降解法是綠色高效分解纖維素的主要途徑之一,近年來,中外大量學者從多種材料中篩選出具有纖維素降解能力的菌株,菌劑的施用不僅有效加快秸稈腐解,還對土壤養分、土壤微生物及作物產量有一定的促進作用。金海洋等[8]研究表明與秸稈直接還田相比,水稻秸稈還田中應用由分解纖維素的芽抱桿菌屬(Bacillus)和分解脂肽梭菌屬(Clostridium)7個菌株組成的菌劑,可以降低水稻秸稈的強度,增加土壤纖維素酶的活性,加速秸稈的降解,增加下季作物產量。趙偉等[9]通過3年菌劑降解秸稈直接還田試驗,菌劑降解秸稈直接還田增加了土壤有機質、微生物量碳、全氮、微生物量氮含量和C/N。Hart等[10]篩選的一株真菌添施于小麥秸稈,顯著降低了其C/N值,提高了土壤團聚體穩定性。
但大部分篩選的秸稈分解菌劑存在生產周期長,產品質量不穩定,易污染,纖維素酶活較低等問題。基于此,本研究以貴州典型煙區植煙土壤為高效篩選纖維素分解菌材料,以玉米秸稈粉為碳源,旨在篩選出具有高效降解玉米秸稈能力、適宜于貴州煙區秸稈還田適用菌株。
1 材料與方法
1.1 試驗材料
1.1.1 土樣采集 供高效纖維素分解菌篩選的土壤以無菌方式采自貴州典型植煙區安順、畢節和遵義,玉米秸稈粉來自安順平壩。試驗是在貴州省煙草品質研究重點實驗室,于2019年11月—2020年10月份進行。
1.1.2 主要培養基及主要試劑 培養基:富集培養基[11];分離培養基:NA培養基,馬丁氏瓊脂培養基,改良高氏Ⅰ號培養基[12];鑒別培養基(CMC培養基)[13];液體發酵產酶培養基[14]。
試劑:0.1%剛果紅染液;0.05 mol/L檸檬酸-檸檬酸鈉緩沖液(pH 4.8);1%CMC-Na溶液;3,5-二硝基水楊酸顯色劑[15]。
1.2 研究方法
1.2.1 纖維素分解菌的富集、分離純化與初篩 稱取10.0 g土樣于90 mL滅菌含玻璃珠的蒸餾水中,并在搖床上以150 r/min振蕩1 h后靜置5 min,隨后取2 mL上清液于已滅菌冷卻的富集培養基中,20℃180 r/min振蕩培養3天。按無菌操作要求,將富集后的培養液梯度稀釋,取稀釋液10-6、10-7、10-80.1 mL涂布于NA培養基用于細菌的分離、取稀釋液10-4、10-5、10-60.1 mL分別涂布于孟加拉紅培養基用于真菌的分離和高氏一號培養基用于放線菌的分離。每個梯度分別設置3組平行,細菌于37℃倒置培養1~2天,真菌、放線菌于28℃倒置培養6~7天。將平板中長出的單菌落在相應培養基中純化,用無菌接種環挑取純化單菌株三點法將其點接在CMC-Na鑒別培養基上,選擇能在培養基上生長的菌株,用0.1%剛果紅染液染色10 min,再用1 mol/L NaCl溶液脫色15 min,倒出平板上多余的溶液,最后,根據培養基平板上透明圈直徑(D)與菌落直徑(d)比值的大小,初步篩選出纖維素優勢分解菌。
1.2.2 菌株拮抗實驗 將初篩純化后獲得的單菌株于LB培養基上兩兩相交劃線,28℃倒置培養2~3天,待長豐滿看菌株相交處是否有抑菌圈產生,沒有抑菌圈產生表示菌株間沒有拮抗作用,可進行復合菌劑的制備。
1.2.3 生長曲線測定 挑取純化活化單菌株于LB培養基中28℃180 r/min培養,每隔4 h取樣,用可見分光光度計測定其濃度,繪制生長曲線,對濃度大的菌懸液用未接種的LB培養基適當稀釋后測定,使其OD值在0.10~0.65以內,經稀釋后測得的OD值乘以稀釋倍數。
1.2.4 單菌株及復合菌劑的酶活測定
(1)粗酶液的制備。分別將在CMC-Na鑒別培養基上D/d值大于2.5的純化菌株于LB培養基28℃180 r/min振蕩培養制成種子液。取2 mL的種子液接種至100 mL的產酶發酵培養基中,28℃180 r/min的搖床中培養連續培養10天后5000 r/min離心15 min,收集上清,作為粗酶提取液。
(2)羧甲基纖維素鈉酶活力(CMCase)測定。取0.5 mL粗酶液,依據劉霄[16]測定纖維素酶活方法,得出菌株纖維素酶活性,每隔24 h取樣測定。酶活力單位(U/mL)定義為:1 mL酶液1 min催化底物水解生成1 μg葡萄糖所需要的纖維素酶量為一個單位酶活。
1.3 菌株形態學鑒定
將菌株分別于LB培養基與高氏一號培養基進行純化,菌株生長穩定進行菌落形態描述。采用革蘭氏染色法對篩選得到的纖維素分解菌進行革蘭氏染色試驗,通過顯微鏡觀察形態特征,通過染色反應呈現顏色不同判定屬革蘭氏陽性菌(G+)或革蘭氏陰性菌(G-)。
1.4 菌株分子生物學鑒定
1.4.1 菌株DNA的提取 本研究選擇使用天根生化科技(北京)有限公司的細菌基因組DNA提取試劑盒(離心柱型)進行菌株DNA的提取。
1.4.2 PCR擴增 PCR擴增引物采用細菌16SrDNA通用引物,正向引物為27F(5'-AGAGTTTGATCCTG GCTCAG-3'),反向引物為 1492R(5'-GGTTACC TTGTTACGACTT-3')。PCR反應體系25 μL:1.1×T3 Super PCR Mix 22 μL,引物 27 F(10 μmol/L)1.0 μL,引物 1492 R(10 μmol/L)1.0 μL,Template DNA 1 μL。PCR熱循環條件:98℃預變性2 min 98℃變性10 min,55℃退火 10 s,72℃延伸 20 s,72℃修復延伸 2 min,4℃終止反應∞,32個循環。取2 μL PCR產物在2%的瓊脂糖凝膠上進行電泳檢測。
1.4.3 序列測定 將PCR擴增產物通過1%瓊脂糖凝膠電泳確定條帶亮度。將PCR擴增產物送往北京擎科生物科技有限公司重慶分公司進行基因序列的測定,將測序結果通過國家生物技術信息中心(NCBI)BLAST程序進行序列相似性搜索。并利用MEGA X.0軟件構建系統發育樹。
1.5 菌株對玉米秸稈降解率的測定
選擇最佳處理菌劑(單菌劑或復合菌劑)以5%的接種量添施于已滅菌的玉米秸稈,通過失重法測定其降解率。秸稈處理為2~3 cm長度,稱取20 g放置于500 mL的容量瓶蓋上封口膜以保持其充足的透氣空間而不被污染,將容量瓶放置于室溫(28℃左右)下,約2天晃動一次,當觀察到明顯腐解現象時測定其降解率。將培養相應時間的秸稈用無菌水清洗數次以除去秸稈表面大量菌體,棄去液體部分,60℃烘干至恒重后稱重計算失重率。秸稈腐解率的計算見公式(1)。
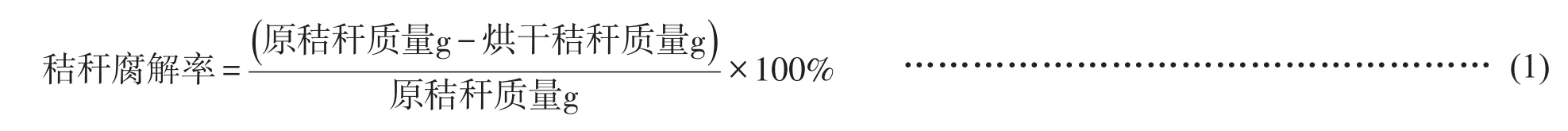
2 結果與分析
2.1 纖維素分解菌的富集、分離與純化
通過以玉米秸稈為唯一碳源富集培養基培養,細菌、放線菌、真菌培養基上單菌株的分離、純化,最終共獲得純菌株44株。
2.2 纖維素分解菌的初篩
通過在CMC鑒別培養基平板上利用剛果紅染色法對分離純化的菌株進行染色,對纖維素分解菌進行初步篩選。根據培養基平板上是否能產生水解圈以及透明圈直徑(D)與菌落直徑(d)比值的大小,初步篩選出能夠分解纖維素以及降解效果較好的菌株,共20株,其中細菌8株、放線菌8株、真菌4株。D/d越大,說明菌株產生的纖維素酶活性高或其纖維素酶量越大,因此初步篩選出5株優勢纖維素分解菌,其中3株來源于遵義湄潭煙區土壤,命名為FCM-1、FCM-10、FCM-11、1株來源于安順楊武煙區土壤,命名為FCY-2,1株來源于畢節威寧植煙土壤,命名為FCW-2。經過2天培養后,剛果紅染色結果發現,5株菌株菌體直徑較小(約為0.2 cm)卻產生了較大的透明圈(圖1),其中比值最大的是FCM-10,D/d為4.2(表1)。
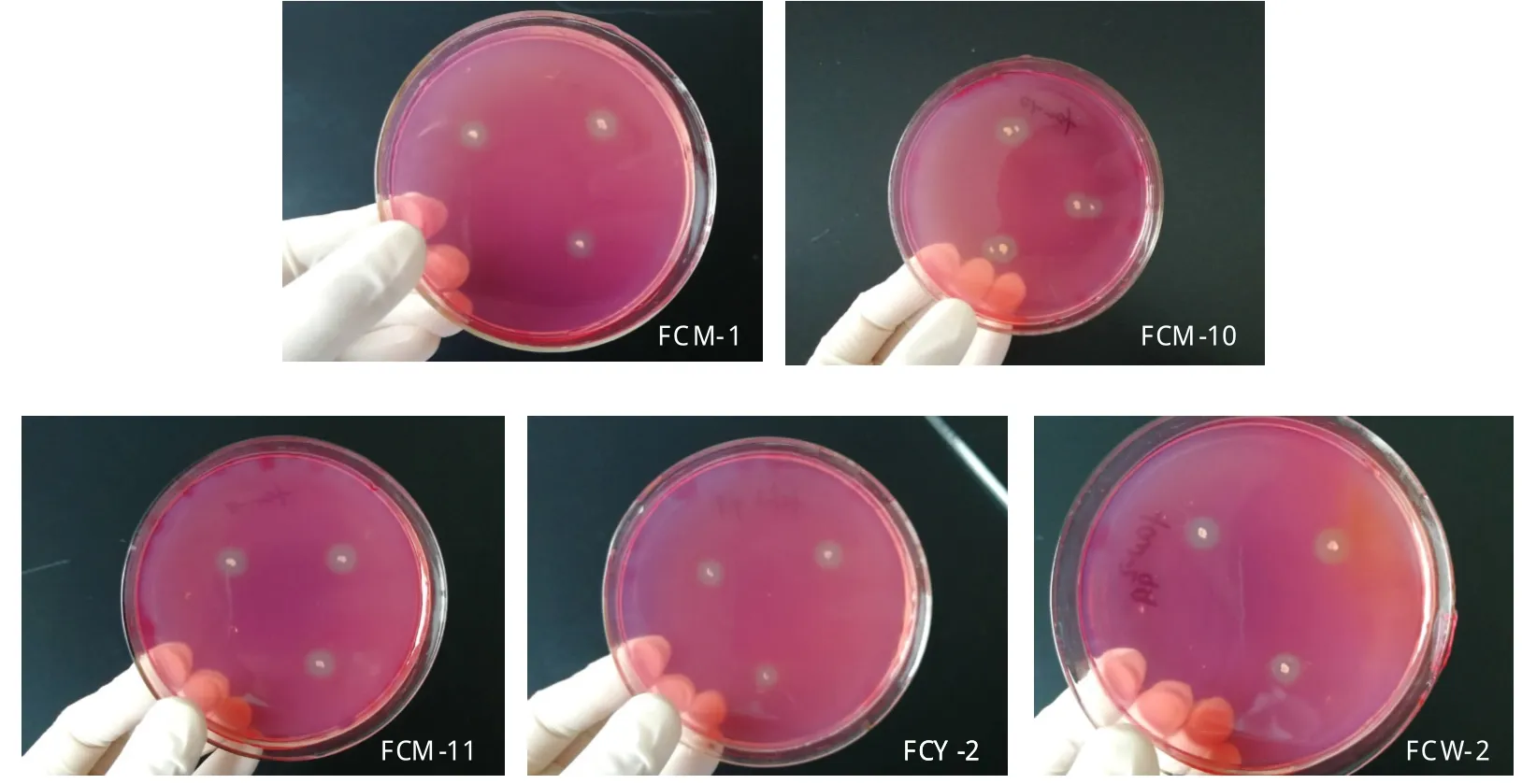
圖1 纖維素分解菌菌株剛果紅染色
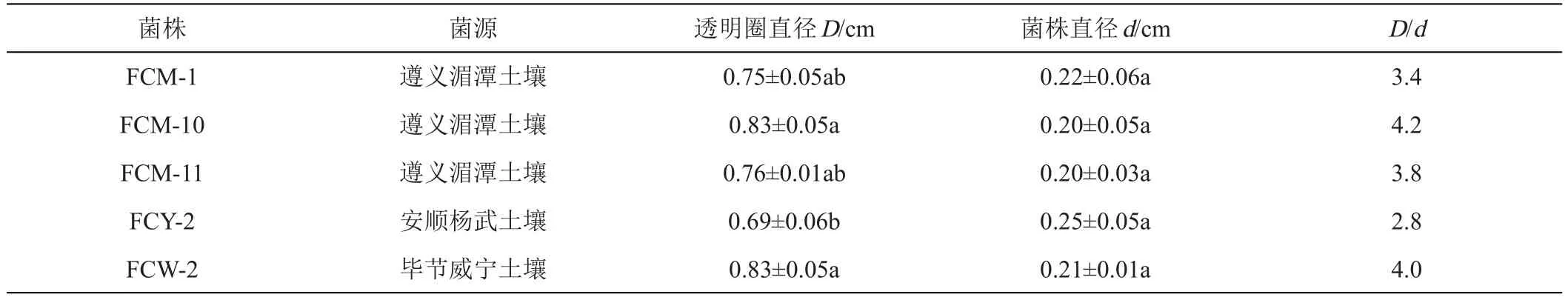
表1 纖維素分解菌菌株剛果紅染色初篩結果
2.3 纖維素分解菌的拮抗實驗
通過對初篩出的5株纖維素分解菌進行拮抗實驗,結果顯示,5株菌株生長交接處無抑菌圈或抑生孢子產生,說明菌株間無拮抗作用,可進行復合菌劑的配制。通過菌株兩兩配制,共得到10個復合菌劑。這可能是由于這些菌株都是由貴州煙區植煙土壤中篩選而得,生長環境大致相同,所以菌株間無拮抗作用。
2.4 纖維素分解菌生長曲線的測定
通過對5株纖維素分解菌生長曲線的測定(圖2),可知5株菌株4~12 h為生長遲緩期,16 h開始一直到44 h較快增長,48 h后趨于穩定。對數期酶系活躍,代謝旺盛,所以選擇16~44 h時間段作為提取菌株DNA最佳時期以及測定酶活最佳接種期。
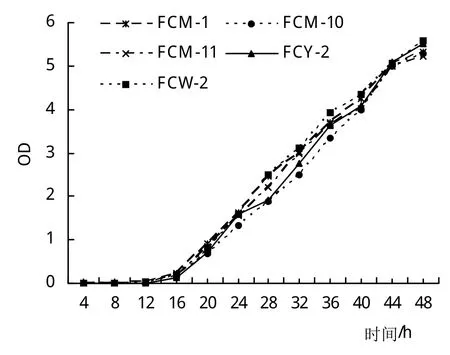
圖2 纖維素分解菌菌株生長曲線
2.5 纖維素分解菌酶活力測定
通過發酵產酶培養,對菌株FCM-1、FCM-10、FCM-11、FCY-2和FCW-2及其配制的復合菌劑共15個處理分別于2、5和7天測定其CMCase活性,結果表明(表2),5株纖維素分解菌單菌株中FCM-10菌株除了5天時與FCM-11差異不顯著,在2天和7天時CMCase活性最大,在7天達最大(260.45 U/mL)與其他單菌株呈顯著性差異,其次為FCM-11菌株,在5天達最大(243.85 U/mL)。在10種復合菌劑中,不同時間不同菌株復合所產酶活不同,在2天時CMCase活性值最大的是15號菌劑FCY-2+FCW-2,達290.38 U/mL,是其單菌株的1.48倍和1.98倍;在5天時CMCase活性值最大的是11號菌劑FCM-10+FCY-2,達314.39 U/mL,是其單菌株的1.2倍和1.53倍;在7天時CMCase活性值最大的是6號菌劑FCM-1+FCM-10,達358.11 U/mL,是其單菌株的2.51倍和1.37倍。
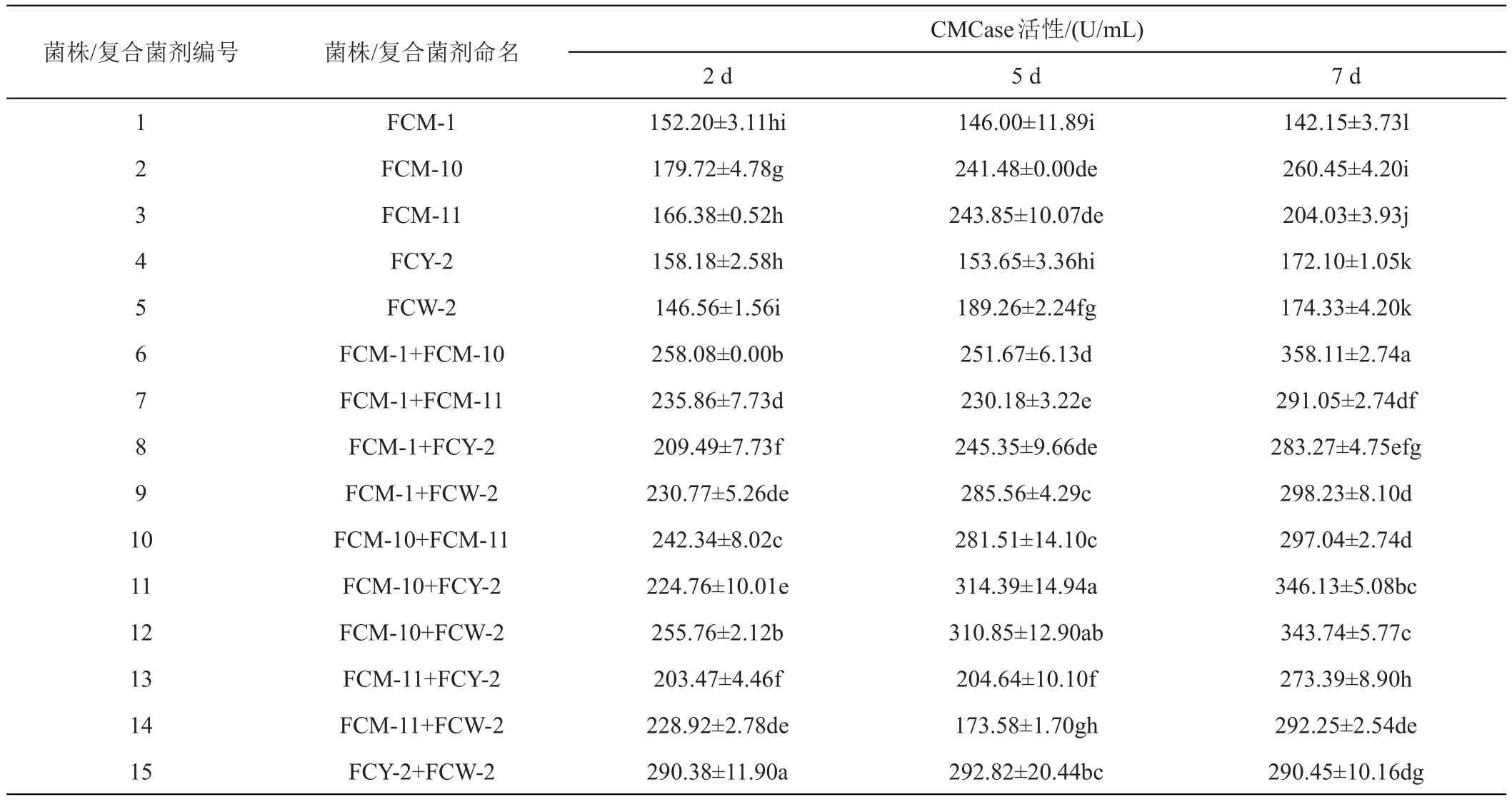
表2 纖維素分解菌菌株及其復合菌劑CMC酶活性
2.6 5株纖維素分解菌菌株鑒定
2.6.1 形態學鑒定 將5株纖維素分解菌分別于LB培養基與高氏一號培養基平板上劃線純化,28℃培養箱內培養,48 h后觀察。5株高效纖維素分解菌在同一種培養基上外觀形態差異不大,但在不同培養基之間卻有較大差別(圖3)。2種培養基上生長的菌落在大小、顏色、形成單菌落的劃線區、生長速度不相同。LB培養基上的菌落顏色為檸檬黃,菌落略大(0.2~0.4 cm),約2天于劃線C區長出單菌落,易挑起;而高氏一號培養基的菌落顏色較淺,偏白,菌落小(0.1~0.2 cm),約4天于劃線B區長出單菌落,C區菌落數較少,不易挑起。2種培養基上的菌落都為圓形、濕潤、光滑、隆起、有光澤、不透明,有可見基質菌絲。5株菌株都為革蘭氏陽性菌,在油鏡下觀察菌體細短而密集。
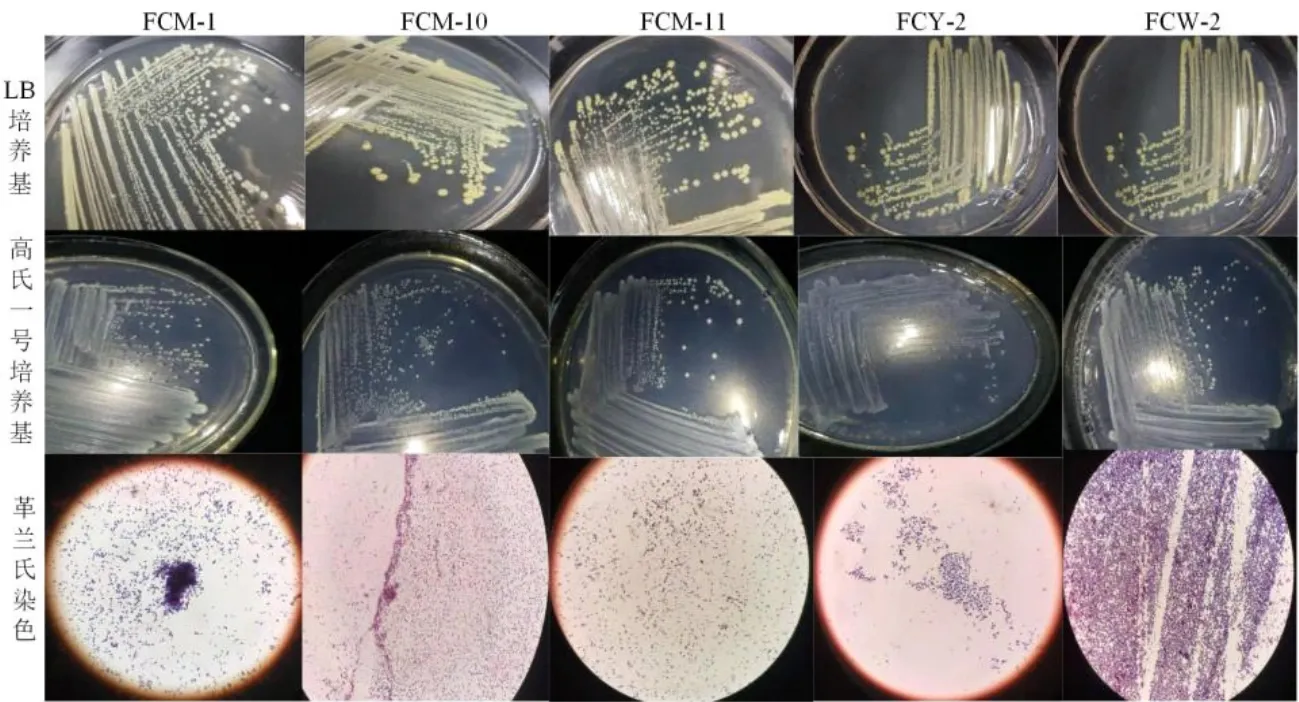
圖3 維素分解菌菌株形態及其革蘭氏染色
2.6.2 分子生物學鑒定 對5株纖維素分解菌16S rDNA的PCR擴增產物在1%瓊脂糖凝膠電泳上驗證,得到1500 bp左右的條帶,送至北京擎科生物科技有限公司重慶分公司進行基因序列的測定,FCM-1、FCM-10、FCM-11、FCY-2和FCW-2菌株的序列長度分別為1359、1355、1373、1373、1337、1364 bp。將測得的序列在NCBI中比對,發現其與Cellulosimicrobium cellulans與Cellulosimicrobiumfunkei16S rDNA序列一致性高達100%。將測序序列信息提交Genbank,下載該屬其他序列及所隸屬科相近序列,利用MEGA X基于鄰接法構建菌株的系統發育進化樹(圖4)。結果顯示此5株菌隸屬于Cellulosimicrobium屬,與Cellulosimicrobiumcellulans與Cellulosimicrobium funkei及Cellulosimicrobiumaquatile,結合菌株形態學和革蘭氏染色結果,可初步判定該菌隸屬纖維菌屬(Cellulosimicrobium)。
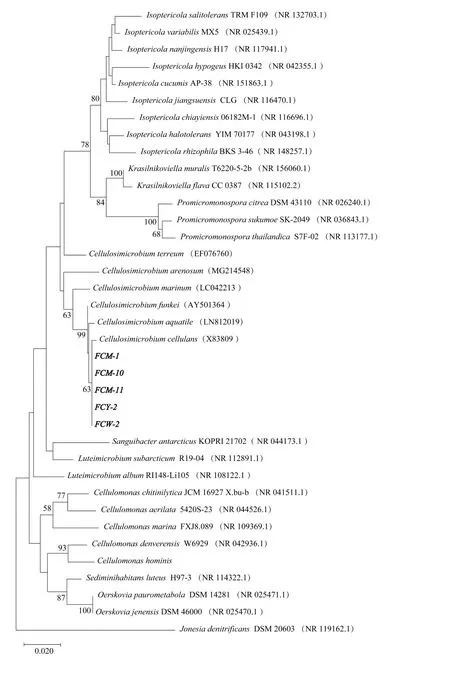
圖4 基于16S rDNA序列同源性纖維素分解菌菌株的系統發育樹
2.7 菌株對玉米秸稈的降解率測定
通過5株菌株及其復合菌劑的纖維素酶活測定,FCM-10+FCY-2菌劑在時間(5天)與酶活(314.39 U/mL)綜合優于其他處理,所以將FCM-10+FCY-2作為優勢菌劑進行玉米秸稈降解實驗,將其單菌劑與未添施菌劑處理設置為對照。培養25天后,菌劑處理秸稈相較未添施菌劑處理秸稈來看,顏色變黑、腐爛,秸稈微微塌陷,三角瓶底部也出現了少量液體,其中復合菌劑處理出現乳白色液體(圖5)。通過對秸稈降解率測定可以看出(圖6),菌劑處理降解率高于未添施菌劑處理,經過25天降解,復合菌劑降解率達53.35%,是對照的1.87倍,是單菌劑處理的1倍多,FCM-10處理略高于FCY-2處理。表明FCM-10+FCY-2復合菌劑對玉米秸稈的降解作用強于單菌劑及未添施菌劑處理,具有實際應用價值。

圖5 25天玉米秸稈的降解外觀形態變化
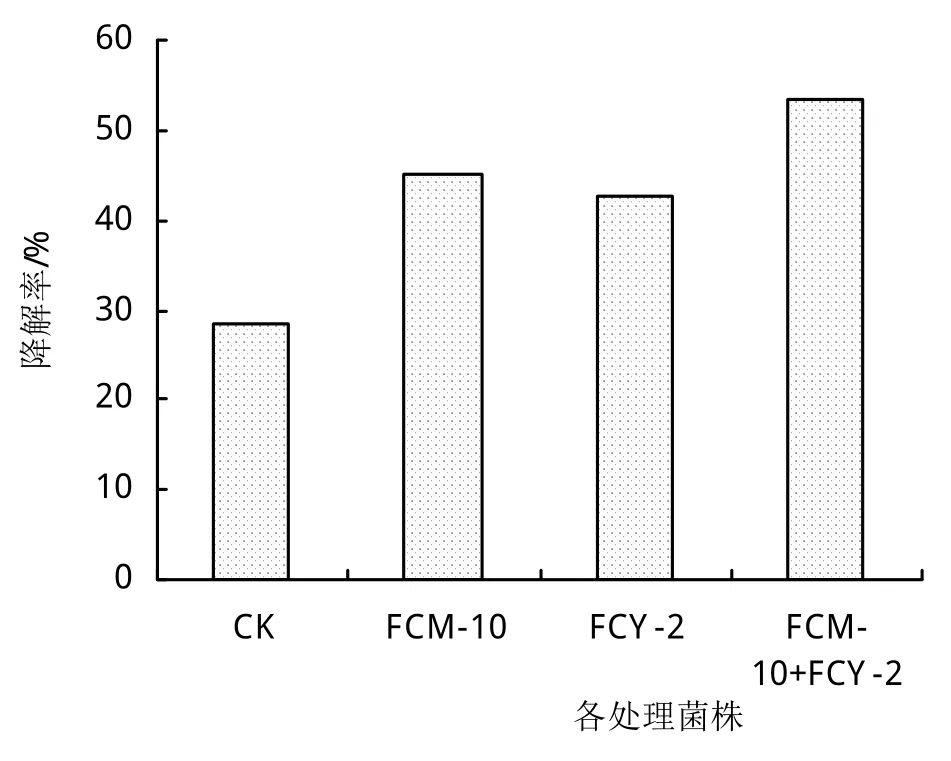
圖6 25天各菌劑玉米秸稈的降解率
3 討論
研究從貴州典型植煙土壤中篩選獲得5株具有高效降解纖維素的微生物菌劑,通過形態學及系統發育分析,初步鑒定為Cellulosimicrobiumcellulans與Cellulosimicrobiumfunkei,目前cellulosimicrobiumsp.對于秸稈生物質資源降解的研究較少,該菌株具有較高的纖維素酶活,菌株間復合其纖維素酶活高于單菌株,并對秸稈表現出較強的降解率,是有效降解農業生產副產品的微生物資源。cellulosimicrobiumsp.作為纖維素與半纖維素分解的微生物,目前僅包括7個有效發表的種(www.bacterio.net/chryseobacterium.html),各菌株可產生多種降解酶,如葡萄糖苷酶、蛋白酶、糖苷水解酶和幾丁質酶,廣泛應用于纖維素和木聚糖的生物降解和酒精發酵[17]。Cellulosimicrobiumcellulans通過凝脂多糖(EPS)中的木聚糖體粘附于纖維素表面,從而有效降解纖維素底物[18]。該菌株于多種生境中分離出,可降解苯并(a)芘(BaP)[19]、高集凝乳凝膠[20]、海洋污染物烴等碳氫化合物[21]等,且具有較高的木糖酶活促進了7-木糖紫杉烷向紫杉醇的轉化[22]。Cellulosimicrobiumfunkei從人類學液中分離得到[23],研究表明該菌株具有較高的Cr(Ⅵ)還原能力,可降低其毒性,進行土壤修復[24]、可降解黃曲霉毒素B1[25],以保護作物生長。Cellulosimicrobiumcellulans和Cellulosimicrobiumfunkei是對于環境友好、資源有效利用的優質微生物資源。
5株來源地不同的纖維素分解菌菌株經鑒定具有較高的同源性,但相同培養條件下菌株間酶活存在差異,說明即使同屬相同的種,研究所篩選得到的菌株間仍存在差異,這與劉霄[17]、王元明等[26]的研究結果相似,進一步區別還需驗證。根據前人研究成果,Cellulosimicrobiumcellulans與Cellulosimicrobium funkei是非常重要的微生物資源,將Cellulosimicrobiumcellulans與Cellulosimicrobium funkei制成菌劑添施于秸稈資源還田對于資源充分利用與修復損壞土壤具有重要意義。
貴州因其特殊的地形地貌使得植煙土地破碎而不連貫,限制了秸稈還田技術與規模的發展,作為烤煙主要輪作作物秸稈——玉米秸稈,將其有效還田對于克服烤煙連作或單一輪作障礙具有較強的現實意義。就地篩選得到的菌株添施秸稈原位還田具有生態適應性的特點,實際生產應用還需進一步的驗證。
4 結論
本研究以貴州典型煙區植煙土壤為高效篩選纖維素分解菌材料,以玉米秸稈粉為唯一碳源,通過初篩、復篩獲得高效纖維素分解菌5株。其中透明圈直徑(D)與菌落直徑(d)比值的大小在2.8~4.2之間,其中以一株湄潭菌株D/d最大,為4.2。通過CMCase活力測定結果顯示,菌株間的復合酶活優于單菌株,在5天時FCM-10+FCY-2 CMCase活性達314.39 U/mL,是其單菌株的1.2倍和1.53倍,表明5株菌雖都屬于Cellulosimicrobium cellulans與Cellulosimicrobium funkei,且具有較高的同源性(100%)但菌株間仍存在差異,可能是由于生產適宜環境(溫度等)不同或不能發酵核糖和糖原等原因[27]。選擇最佳復合菌劑處理FCM-10+FCY-2制成菌劑降解玉米秸稈,25天時秸稈外觀出現變化,與對照相比其顏色變黑、秸稈腐爛,微微塌陷,秸稈降解率達53.35%,是對照的1.87倍,是單菌劑處理的1倍多。結果表明,5株纖維素分解菌具有較好的玉米秸稈降解能力,是適宜于貴州煙區秸稈還田的潛力菌株。由于5株菌株的高度相似于Cellulosimicrobium cellulans和Cellulosimicrobium funkei都達100%,系統發育樹無法精準區別,還需進一步進行鑒定工作;菌株的降解特性、降解機理等多方面內容也還需作進一步的深入研究。

