基于過氧化鈣的類芬頓反應對亞甲基藍的降解
鐘書華,伍梓芃,何 瑜*,宋功武
(1.湖北省生態環境廳鄂州生態環境監測中心,湖北 鄂州 436000; 2.湖北大學化學化工學院,湖北 武漢 430062)
亞甲基藍(Methylene Blue,MB)是一種常見的堿性染料,在醫療、印刷及紡織行業應用廣泛,但其具有毒性,人體吸入后會產生頭痛、惡心等不良反應,而且進入水體中會對環境造成污染。近年來,對水體中亞甲基藍的降解處理一直備受關注。傳統的降解方法主要有電化學法、光催化降解法、吸附法、膜分離法、微生物降解法等,但通常都很難將亞甲基藍降解完全[1-3]。
層狀雙氫氧化物(LDH)是一種含有陰離子的層柱狀結構化合物,其結構中均勻分布著兩種金屬離子,層間的陰離子具有很好的交換性能。在催化降解中,如果LDH中某種金屬離子為活性的過渡金屬離子時,將具有更好的催化性能與選擇性,如含有Fe的LDH能夠發生類Fenton反應,從而使降解完全[4-5]。
在類Fenton反應中,一般從H2O2中直接獲得羥基自由基(·OH),但H2O2并不穩定,很容易發生分解,最終導致利用率不高;且H2O2會污染環境[6]。研究表明,固態的CaO2在水介質中能緩慢釋放H2O2和氧氣,可以避免大量H2O2快速分解,改善水體氧環境[7-14];且在通常情況下CaO2比較穩定,便于儲存。因此,CaO2可作為類Fenton反應中H2O2的持續供源,減少對環境的不利影響。鑒于此,作者采用共沉淀法制備Cu-Zn-Fe型層狀雙氫氧化物(Cu-Zn-Fe-LDH),并與CaO2進行復合,得到基于CaO2的Cu-Zn-Fe-LDH(Cu-Zn-Fe-LDH-CaO2)復合材料,通過XRD、FTIR、TEM對其進行表征;以亞甲基藍為模型污染物考察復合材料的降解性能,對降解條件進行優化。
1 實驗
1.1 試劑與儀器
CuSO4·5H2O、FeSO4·7H2O、NaOH、KH2PO4、30%H2O2,分析純,國藥集團化學試劑有限公司;ZnSO4·7H2O,分析純,天津百世化工;Ca(OH)2,分析純,上海麥克林生化科技;亞甲基藍,天津天新精細化工;98%濃硫酸,開封東大化工。
D8 Advance型 X-射線衍射儀,德國Bruker公司;Nicolet iS10型傅立葉變換紅外光譜儀,賽默飛世爾公司;Lambda35型紫外可見分光光度計,美國PE公司。
1.2 Cu-Zn-Fe-LDH的制備
采用共沉淀法制備LDH,控制Cu、Zn、Fe的物質的量比為1∶7∶2。將CuSO4·5H2O、ZnSO4·7H2O、FeSO4·7H2O溶于水中,劇烈攪拌,調節溶液pH值至7后,在40 ℃水浴中攪拌3 h,陳化3 h后傾去上清液,下層沉淀離心15 min后再洗滌,連續重復3次,即得黃色沉淀Cu-Zn-Fe-LDH。
1.3 CaO2及復合材料的制備
將過量的Ca(OH)2固體溶解于少量水中,形成懸濁液,加入適量的KH2PO4穩定劑,攪拌30 min;加入適量30%H2O2溶液反應15 min,再加入少量Cu-Zn-Fe-LDH懸濁液攪拌5 min至均勻,抽濾,取沉淀在120 ℃下烘2 h,即得淺綠色Cu-Zn-Fe-LDH-CaO2復合材料,并進行XRD、FTIR、TEM表征。
不加Cu-Zn-Fe-LDH懸濁液,同法制備CaO2。由于反應并不完全,CaO2中有Ca(OH)2殘留[15]。
1.4 復合材料催化降解亞甲基藍
配制一定濃度的亞甲基藍溶液,加入一定量Cu-Zn-Fe-LDH-CaO2復合材料、KH2PO4,用H2SO4調節溶液的pH值,每隔一定時間取樣,測定664 nm處吸光度,計算降解率[16-17]。
2 結果與討論
2.1 復合材料的表征
2.1.1 XRD分析(圖1)
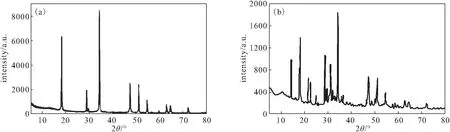
圖1 CaO2(a)及Cu-Zn-Fe-LDH-CaO2復合材料(b)的XRD圖譜Fig.1 XRD patterns of CaO2(a) and Cu-Zn-Fe-LDH-CaO2 composite(b)
由圖1a可知,在2θ為30.3°、35.6°、47.3°、51.6°、53.2°、60.9°處的衍射峰與CaO2的主要衍射峰相吻合。由圖1b可知,Cu-Zn-Fe-LDH-CaO2復合材料中存在CaO2的主要衍射峰,但峰強度有所下降,此外,由于Cu-Zn-Fe-LDH的加入,在2θ為14.5°、21.6°、23.2°、31.3°處產生了新的衍射峰。
2.1.2 FTIR分析(圖2)
由圖2可知,CaO2的主要吸收峰在3 642 cm-1、1 471 cm-1與1 056 cm-1附近,Cu-Zn-Fe-LDH-CaO2復合材料的峰位置(3 603 cm-1、1 423 cm-1、1 110cm-1附近)與CaO2基本一致,此外,由于Cu-Zn-Fe-LDH的加入,在3 404 cm-1處出現了新的吸收峰。
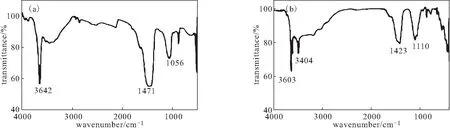
圖2 CaO2(a)及Cu-Zn-Fe-LDH-CaO2復合材料(b)的FTIR圖譜Fig.2 FTIR spectra of CaO2(a) and Cu-Zn-Fe-LDH-CaO2 composite(b)
2.1.3 TEM分析(圖3)

圖3 CaO2(a)及Cu-Zn-Fe-LDH-CaO2復合材料(b)的TEM照片Fig.3 TEM images of CaO2(a) and Cu-Zn-Fe-LDH-CaO2 composite(b)
由圖3可知,CaO2及Cu-Zn-Fe-LDH-CaO2復合材料均有棱角結構,且Cu-Zn-Fe-LDH-CaO2復合材料能看到比較隱藏的六邊形的Cu-Zn-Fe-LDH結構。
2.2 復合材料催化降解亞甲基藍的條件確定
2.2.1 復合材料用量的選擇
配制8 mg·L-1的亞甲基藍溶液,分別加入不同量(10 mg、25 mg、50 mg、75 mg、100 mg)的復合材料及50 mg KH2PO4,用H2SO4調節溶液的pH值,分別在反應前、反應60 min測定吸光度,計算降解率,結果見圖4。
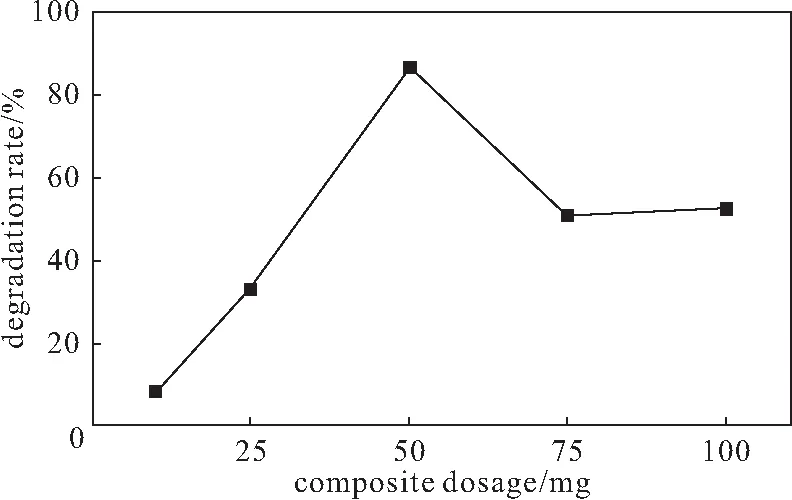
圖4 復合材料用量對降解率的影響Fig.4 Effect of composite dosage on degradation rate

2.2.2 亞甲基藍初始濃度的選擇
分別配制不同濃度(1 mg·L-1、2 mg·L-1、4 mg·L-1、6 mg·L-1、8 mg·L-1、10 mg·L-1)的亞甲基藍溶液,加入50 mg復合材料、50 mg KH2PO4,用H2SO4調節溶液的pH值,分別在反應前、反應60 min測定吸光度,計算降解率,結果見圖5。
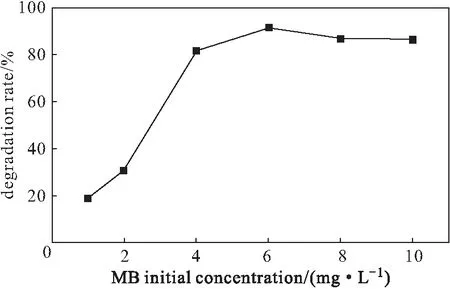
圖5 亞甲基藍初始濃度對降解率的影響Fig.5 Effect of MB initial concentration on degradation rate
由圖5可知,隨著亞甲基藍初始濃度的增加,降解率逐漸升高而后趨于穩定。當亞甲基藍初始濃度為6 mg·L-1時,降解率達到最高。這是因為,在固定條件下,H2O2、H+與Fe2+反應產生的·OH量是一定的,在一定濃度范圍內,反應物分子受到·OH攻擊的幾率會隨著亞甲基藍初始濃度的增加而升高,最終趨于穩定[16]。因此,選擇亞甲基藍初始濃度為6 mg·L-1。
2.2.3 溶液pH值的選擇
配制8 mg·L-1的亞甲基藍溶液(pH值為7.2),加入50 mg復合材料、一定量的KH2PO4,用不同量的酸或堿調節溶液的pH值,劇烈攪拌,分別在反應前、反應30 min測定吸光度,計算降解率,結果見圖6。
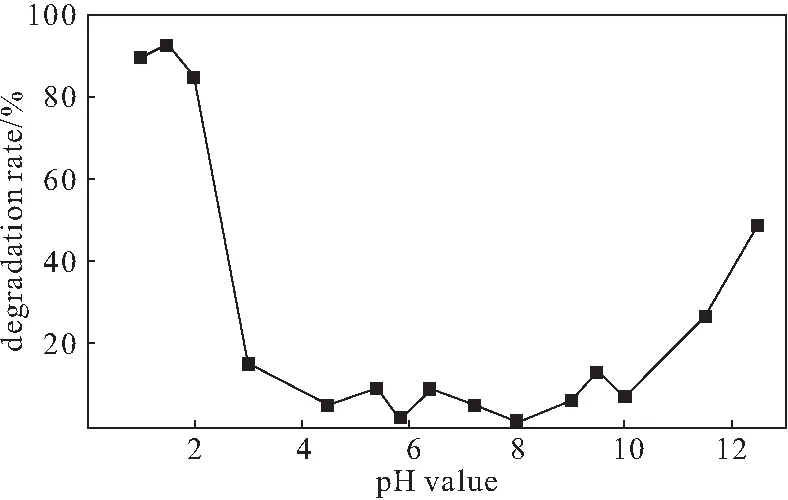
圖6 pH值對降解率的影響Fig.6 Effect of pH value on degradation rate
由圖6可知,類Fenton反應體系在強酸性條件下降解較快。這是由于,復合材料中混有大量的Ca(OH)2,導致很多H+與OH-反應,加上復合材料中LDH含量較少,而生成的CaO2十分蓬松,擁有很多孔,使得LDH吸附,進而在弱酸性條件下降解也很慢;而在強酸性條件下,Ca(OH)2反應分解,CaO2也更容易產生·OH,有利于降解。理論上堿性條件不利于類Fenton反應,但由于LDH特殊的層狀結構產生了吸附效果;在堿性環境下,提供給H2O2的·OH也有利于降解。因此,應控制溶液pH值<3。
2.2.4 KH2PO4用量的選擇
配制8 mg·L-1的亞甲基藍溶液,加入50 mg復合材料,分別加入不同量(0 mg、10 mg、25 mg、50 mg、75 mg、100 mg、150 mg)的KH2PO4,用H2SO4調節溶液的pH值,分別在反應前、反應30 min與60 min測定吸光度,計算降解率,結果見圖7。
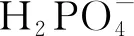
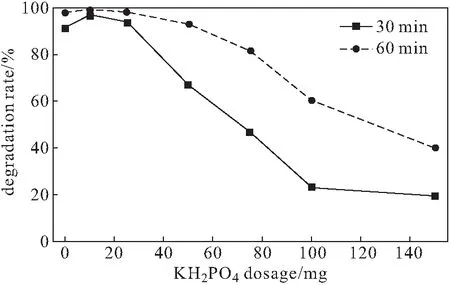
圖7 KH2PO4用量對降解率的影響Fig.7 Effect of KH2PO4 dosage on degradation rate
由于KH2PO4對Fe2+與·OH的捕獲導致Fe2+含量下降,同時Fe2+與CaO2對磷酸鹽也存在降解作用,競爭降低了對亞甲基藍的類Fenton降解,使得降解率下降[6]。因此,選擇KH2PO4用量為10 mg。
2.3 溶解氧測定
采用溶解氧測定儀測定自來水中溶解氧含量。取50 mL沙湖污水樣兩份,測定溶解氧含量;再分別加入100 mg復合材料,靜置一段時間后測定溶解氧含量,結果見表1。

表1 污水中溶解氧含量隨時間的變化/(mg·L-1)
由表1可知,加入復合材料前,污水中溶解氧含量很低;加入復合材料后,污水中溶解氧含量升高,300 min后,兩種污水中的溶解氧含量均接近自來水溶解氧含量(7.85 mg·L-1)。
3 結論
(1)與傳統Fenton反應類似,基于CaO2的類Fenton反應中,以亞甲基藍為模型污染物,復合材料用量、亞甲基藍初始濃度、溶液pH值、KH2PO4用量等對·OH產率均有顯著影響,從而影響亞甲基藍的降解率。在復合材料用量為50 mg、亞甲基藍初始濃度為6 mg·L-1、溶液pH值<3、KH2PO4用量為10 mg時,降解率超過90%。但在實際應用中,要合理控制復合材料用量與KH2PO4用量。
(2)由于CaO2溶解過程產生Ca(OH)2,且復合材料本身也含有Ca(OH)2,反應過程會使pH值升高,從而抑制類Fenton反應和H2O2的釋放。在實際應用中,可控制氧化劑的加入;同時,可通過穩定反應體系的pH值,調節H2O2的釋放速度從而達到更好的降解效果。
(3)根據溶解氧的測定結果可知,復合材料的制氧效果較好,300 min后,污水的溶解氧含量接近自來水溶解氧含量(7.85 mg·L-1)。

