植物CRISPR/Cas技術研究進展及其在林業科學研究中的應用
胡凱強, 廖家凱, 席飛虎, 高鵬飛, 陳 凱, 魏文桃, 丁家治, 苗 苗, 顧連峰
(1.福建農林大學林學院;2.福建農林大學生命科學學院,福建 福州 350002)
林木物種世代周期長,缺乏便捷有效的遺傳轉化體系,這對優良種質資源的培育極其不利.傳統的林木基因工程受到基因組雜合度高、倍性復雜[1]等條件的約束,無法對基因組進行精準修飾,導致林木物種的遺傳多樣性難以得到有效利用.隨著生物大數據的快速發展,繼早期的歸巢核酸內切酶(meganucleases)、鋅指核酸內切酶(zinc finger endonuclease, ZFN)、類轉錄激活因子效應物(transcription activator-like effector nucleases, TALENs)以及由鈰—乙二胺四乙酸復合物執行切割功能的化學方法[2]之后產生的CRISPR/Cas系統可在基因組中引入定點突變,其組裝復雜性、編輯效率等問題得到明顯改善,為林木基因功能驗證與解析、突變體創制、快速育種等提供參考.
1 CRISPR/Cas系統在植物中的研究現狀
1.1 CRISPR/Cas系統的研究歷程
科學家最早在負責大腸桿菌(Escherichiacoli)堿性磷酸酶的同工酶轉換的iap基因區附近發現了一種“重復—間隔—重復”的基因序列[3].2000年Mojica et al[4]發現多種原核生物均具有這類序列,其間隔序列唯一且長度固定,重復序列通常為包含24~40 bp的短部分回文序列.隨后這種特異性片段被命名為成簇規律性間隔短回文重復(clustered regularly interspaced palindromic repeats, CRISPR),兩側的同源基因被命名為CRISPR相關基因Cas[5].Horvath et al[6]發現當病毒入侵時,細菌會整合新間隔序列并對噬菌體產生抗性.研究[7]發現“重復—間隔—重復”中的重復序列來源于細菌和古生菌自身,間隔序列來自入侵的噬菌體病毒等.CRISPR/Cas系統的發展歷程如圖1所示.2013年Yang et al[8]首先在人類細胞中建立基因編輯工具,實現靶基因的多重編輯,CRISPR/Cas系統自此誕生.同年,在擬南芥(Arabidopsisthaliana)、水稻(OryzasativaL.)等植物中利用CRISPR/Cas9系統成功進行基因靶向實驗[9-11],這是CRISPR/Cas系統在植物研究中的首次報道.2014年由CaMV 35S啟動子驅動的Cas9系統靶向甜橙(CitrussinensisL.)CsPDS基因,葉片通過柑橘黃單胞柑橘亞種[12](Xanthomonascitrisubsp.citri, Xcc)促使農桿菌滲透,該系統在林木物種中首次得到應用[13].雖然葉片出現白化斑點,但由于它是瞬時遺傳轉化,并沒有獲得穩定遺傳的編輯后代.隨著研究的深入,該技術逐漸在調控植物內源基因表達[14]、性狀改良[15]以及抗病毒研究[16]等領域得到廣泛應用.
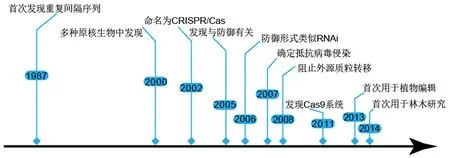
圖1 CRISPR/Cas技術研究的關鍵事件Fig.1 Key events for CRISPR/Cas technology
1.2 CRISPR/Cas系統的缺點及對策
1.2.1 序列限制 Cas蛋白會識別不同的原間隔序列臨近基序(protospacer adjacent motif, PAM),但是PAM序列在基因組上的分布頻率有限,在一些目的基因上無法尋找到合適的位點,這嚴重制約了全基因組范圍內的編輯.開發識別不同PAM序列的新Cas蛋白則可以有效降低PAM序列的依賴性.通過特異性識別NAG、NAGG和NAAG等PAM系統有效擴展了CRISPR/Cas靶向基因組的范圍[17].2019年CRISPR/Cpf1(CRISPR/Cas12a)系統首次在木本植物葡萄柚(C.paradisi)中成功編輯CsLOB1等位基因,解決了Cas9系統因受到單核苷酸序列多態性限制,其單個sgRNA難以修飾兩個等位基因的難題[18].
1.2.2 脫靶、編輯效率低 脫靶是指Cas蛋白對目標靶基因以外的其他序列進行切割,從而產生不必要的突變.Yang et al發現SpCas9-NG系統不僅會靶向水稻基因組,而且會靶向sgRNA本身,這極大地增加了脫靶風險[19].科研人員針對這一問題已搭建多種生物信息學平臺,以設計高特異性gRNA元件.Xie et al開發的CRISPR-PLANT可為8種植物基因組預測低脫靶位點的sgRNA[20].基因編輯工具包CRISPR-GE不僅能用于設計目標sgRNA,還可以用于預測脫靶位點以及后續的突變分析[21].通過開發突變體Cas9-HF1產生較弱的Cas9-DNA關聯度來確保核酸酶僅在完全匹配的DNA位點進行切割[22].
該技術還存在編輯效率低等問題,這與Cas9的密碼子優化以及靶點處的GC含量有很大關系[23,24].同種或相近物種密碼子優化和70%左右GC含量的靶位點有助于提高打靶效率.除此之外,溫度、光照等環境因素也會影響編輯效率,因此該技術目前基本上局限在實驗室內而無法得到大規模田間應用.科學家們如今已經通過開發溫度敏感型CRISPR/Cas12a系統[25]等來提高植物基因編輯效率.
1.3 CRISPR/Cas技術在植物研究中的新方向
1.3.1 單堿基編輯技術 單堿基編輯技術能夠實現對單一堿基的編輯,與傳統的CRISPR/Cas技術相比具有精準且不會產生隨機突變等優點.最初的單堿基編輯系統是可以實現C·G到T·A轉換的胞嘧啶編輯器(CBEs).隨后Liu et al[26]開發了腺嘌呤堿基編輯器(ABEs),介導基因組DNA中A到G的轉化.Qin et al[27]在棉花(GossypiumhirsutumL.)中實現了由A·T到G·C的精確編輯,由GhBE3產生的堿基編輯可從T0代遺傳到T1代.Wen et al[28]在玉米(ZeamaysLinn.)中建立優化的基于靶向差異sgRNAs的代理報告系統(discriminated sgRNAs based surrogate system, DisSUGs),以實現單堿基編輯細胞的高效富集,提高了突變細胞的篩選效率.單堿基編輯技術的應用使植物的遺傳改良更加精確與安全.
1.3.2 RNA堿基編輯 RNA編輯是一種轉錄后水平的基因修飾,依賴PPR、MORF等蛋白家族發揮作用,可以有效提高編輯的精確性,增加基因產物的多樣性.Zhang et al[29]首先證明RNA在哺乳動物中可以被編輯,并使用失活的Cas13蛋白(dCas13)建立了一種沒有嚴格序列限制、可以編輯包含致病性突變的全長轉錄本的系統.Jesser et al[30]利用CRISPR/Cas13a能夠靶向噬菌體基因組的特性在煙草中實現對蕪菁花葉病毒(turnip mosaic virus,TuMV)和GFP融合轉錄本的干擾,為植物的抗病毒研究提供了一種新的技術手段.植物中的RNA編輯多存在于自身的細胞器內[31],目前人工開發的編輯系統非常少,應用前景廣闊.
1.3.3 系統優化 傳統的CRISPR/Cas系統使用固定的幾種啟動子驅動Cas蛋白和sgRNA.常用的玉米泛素Ubi等啟動子太長會導致單一載體只能連接較少的sgRNA,否則會導致載體過大,難以轉化和降低編輯效率.基于此,科研人員在OsU3/U6的基礎上篩選優化出4個更加精簡的啟動子(mOsU3、mOsU6a、mOsU6b和mOsU6c).使用這些啟動子能夠提高單一載體sgRNA表達盒的組裝數量,進而提高多靶位點編輯的能力[32].此外,Zhang et al[33]在柑橘(CitrusreticulataBlanco.)中使用YAO基因的啟動子,借助CRISPR/Cas9系統進行了快速高效的基因編輯,這類啟動子在植物花粉中高表達,有助于將編輯性狀遺傳給后代.這些新元件為CRISPR/Cas技術的深入研究以及植物的遺傳改良等提供了便利.
2 CRISPR/Cas系統的遞送與編輯鑒定方式
2.1 CRISPR/Cas系統在植物中的遞送方式
將CRISPR/Cas系統遞送進植物細胞內是該系統發揮作用的前提.目前植物領域應用最多的主要有傳統的轉基因與非轉基因遞送方法,納米材料的應用則提供了更加便捷高效的遞送方法.
2.1.1 轉基因遞送 轉基因遞送方法主要是農桿菌介導的質粒轉化,這是最為常見且可以獲得穩定表達后代的一種方式.Zhu et al[34]通過農桿菌介導轉化山橘(Fortunellahindsii)愈傷組織,靶向編輯其F.hindsii基因.Lin et al[35]通過PEG介導轉化綠竹(Bambusaoldhamii)、粟(Setariaitalica)、玉米等材料的原生質體進行基因編輯.Andersson et al[36]通過對分離的馬鈴薯原生質體進行瞬時轉化和再生,對淀粉合酶相關基因進行功能完全性敲除.此外,還可通過基因槍等粒子轟擊的方法將該系統導入到植物體內,但是昂貴的費用限制了其應用.
2.1.2 非轉基因遞送 轉基因法導致外源基因的隨機插入,因此具有潛在的生態安全性隱患.而體外組裝的核糖核蛋白復合體(RNPs)可以在遞送進細胞后立即切割靶標,無需轉錄和翻譯,迅速降解,從而避免轉基因植株的產生,提高生物安全性.Woo et al[37]將體外預組裝的RNPs成功遞送到擬南芥、萵苣(Lactucasaliva)等植物中,并在再生植物中達到46%的突變效率.CRISPR/Cas9相關的RNP也已經成功遞送到葡萄(Vitisvinifera)、蘋果(Maluspumila)等林木物種原生質體當中,實現了無轉基因編輯[38].此外,農桿菌被用來介導質粒轉化,在煙草(Nicotianatabacum)中進行瞬時表達[39],在再生白化植株中用特異性PCR檢測到5株植株不含T-DNA.這為CRISPR/Cas系統的非轉基因遞送提供了一種新方法,尤其適合童期較長、多靠營養繁殖的林木物種.
2.1.3 新穎的遞送方式 納米材料為CRISPR/Cas的遞送開辟了另一條路徑.Doyle et al[40]通過葉面噴施含有CRISPR/Cas9質粒包被的納米顆粒,實現了SPO11基因的編輯.該技術簡單、高效、成本低廉,使非模式植物和轉化困難植物的基因組編輯成為可能.發育調控因子(DRs)可促進植物在葉腋處的再生,利用該原理將分別含有DRs和sgRNA的表達載體共轉化穩定表達Cas9的煙草,獲得了白化芽并且成功遺傳給后代[41].Daniel et al[42]提前生成過表達Cas9的本氏煙,然后將能夠表達sgRNA的RNA病毒轉化到提前生成的植株上,利用病毒可以遷移到生殖器官的特點在后代中創造有效突變.這兩種方法省時高效,可以消除組織培養的冗長過程和遺傳轉化的壁壘.
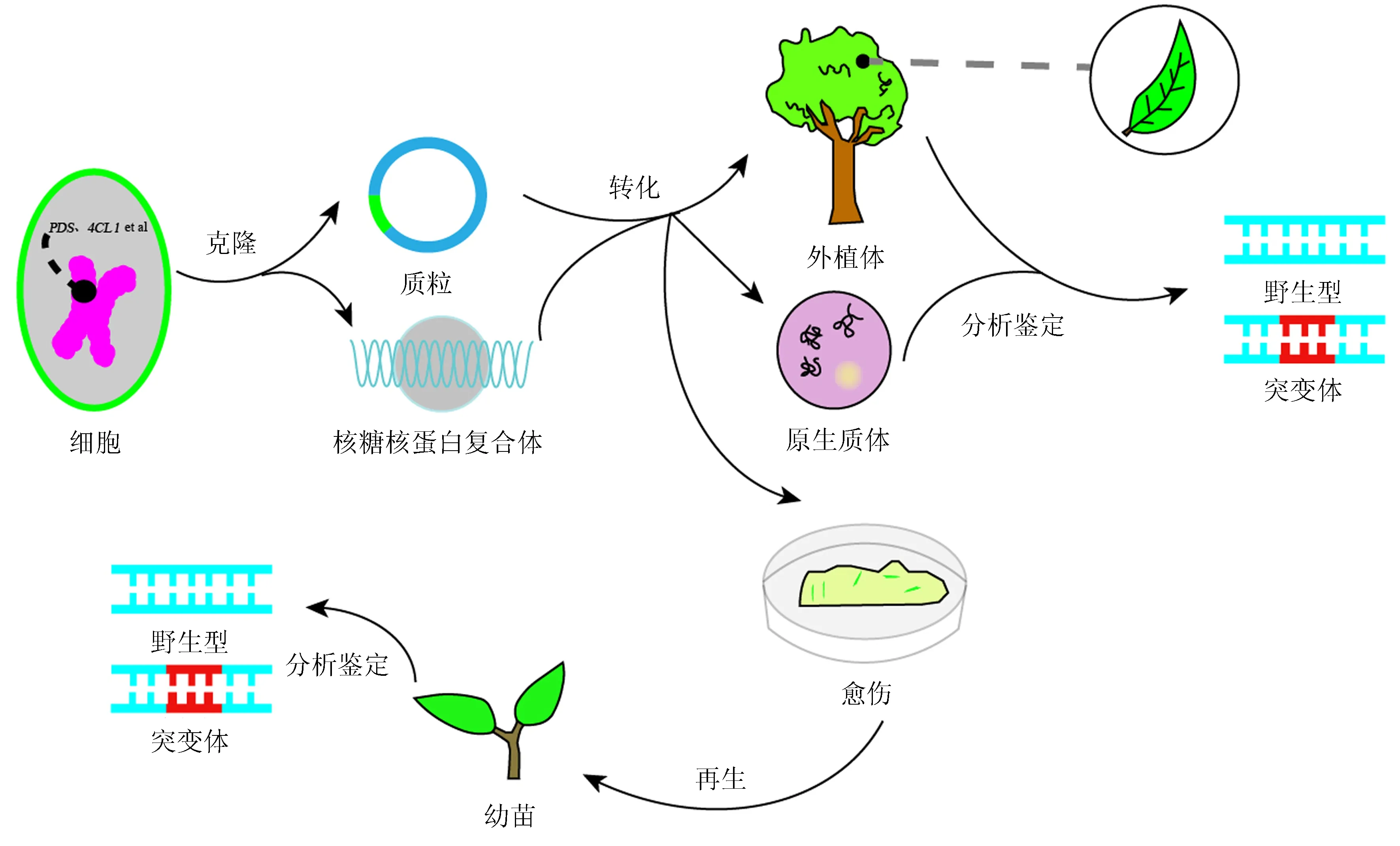
圖2 CRISPR/Cas試驗流程Fig.2 The flowchart of CRISPR/Cas experiment
2.2 CRISPR/Cas系統在植物中的編輯鑒定
CRISPR/Cas系統的編輯中NHEJ途徑具有隨機性特點,容易產生非預期目標突變.同時樣本當中還混合著大量非編輯群體需要進行篩選.對多種木本植物的突變類型進行分析,結果表明插入多局限在1~2 bp,其中1 bp的插入是最常見的,且缺失范圍大[43].因此,對CRISPR/Cas系統的編輯情況進行鑒定顯得尤為重要.目前可應用于植物的鑒定方法主要有以下幾種.
2.2.1 非測序方法 目前常用的突變鑒定方法有T7EI(T7 endonucleaseI)、Surveyor核酸酶分析、PCR-RE(PCR/restriction enzyme)、HRM(high-resolution melting assay)和ACT-PCR法等.T7EI的原理與Surveyor核酸酶分析法相似,都是利用特異性核酸酶切割異源雙鏈錯配DNA分子.Arai et al[44]在煙曲霉菌(Aspergillusfumigatus)中用Surveyor酶鑒定出cyp51A基因的單點突變株系,該方法在植物基因編輯研究中尚未見報道.PCR-RE法的原理是將目標DNA進行酶切,突變的靶序列會被富集,凝膠電泳后出現殘留條帶[45].Fengrui et al[46]對葡萄進行T7EI和PCR/RE檢測,發現當sgRNA中GC含量為65%時,CRISPR/Cas9系統會產生最高的編輯效率.HRM法是通過將突變片段的構象和熔解曲線與野生型相比,將發生改變并且在PAGE膠上的遷移率發生變化的鑒定為突變體[47].Denbow et al用HRM法檢測到了擬南芥單堿基對的插入和缺失[48].ACT-PCR利用在臨界溫度下退火的原理鑒定編輯樣本,特異性引物包含切割位點,在突變體中無法進行有效擴增.Wang et al[49]用該方法在水稻中快速鑒定出了單突變體和多突變體.此外,還可用純化的核糖核蛋白復合體對目標PCR產物進行切割(PCR/RNP).Gao et al[50]用PCR/RNP方法和Sanger測序成功地對六倍體小麥(TriticumaestivumL.)和水稻的突變結果進行基因型分型.
T7EI和Surveyor核酸酶分析法能夠快速檢測突變事件的發生,但是這兩種方法無法區分野生型和純合突變,也不能區分雙等位基因突變和雜合突變體[51].PCR-RE法操作簡便,檢測靈敏度較高,但是受到限制性酶切位點的限制.ACT-PCR僅需一個PCR步驟便可進行凝膠電泳,確定編輯情況,可用于準確測定培養細胞的突變頻率.HRM法既可以對已知的突變類型進行分析,又可以對未知的突變進行篩選,但是只能分析純度單一的小片段DNA,無法對長片段和雜合片段進行分析鑒定.相對而言PCR/RNP法更加靈敏,無需限制酶切位點,比PCR/RE方法更適用,可以區分野生型和純合突變、雙等位基因突變與雜合突變,但是RNP的制備也較復雜.
2.2.2 測序方法 測序法包括Sanger測序和高通量測序兩種.Sanger測序能夠鑒定一些純合突變,提供突變類型的詳細信息,但是對多倍體基因組突變以及雜合突變的檢測能力較低.Giorio et al[52]在番茄(Solanumlycopersicum)中使用Sanger測序技術檢測到的編輯效率為84%,但未檢測到嵌合體.Ma et al[53]考慮到雜合突變類型的測序會出現雙峰現象,開發簡并序列解碼(degenerate sequencedecoding, DSD)方法,能夠快速解碼測序圖中的雙峰信息,但是這種方法只適用于小規模的解碼.高通量二代測序(nextgenerationsequencing, NGS)技術則可以對一些嵌合突變或者大規模的突變樣本進行鑒定分析[54],尤其適合基因組倍性復雜、遺傳雜合度高的林木物種.基于NGS的Hi-TOM平臺可對水稻中CRISPR/Cas9誘導的突變進行高通量分析,從而檢測多個靶位點的突變,尤其適合對復雜的嵌合突變進行鑒定[55].Yan et al[56]通過改進MassARRAY和靶向捕獲測序技術在基因組龐大復雜的玉米中實現高通量和低成本的靶標突變鑒定.高通量測序的方法雖然可以同時進行大規模的測序和分析,但費用高,耗時長[57].CRISPResso等工具的開發則在逐步縮短時間,降低成本,解決高通量測序過程中帶來的難題[58].
2.2.3 熒光檢測方法 熒光標簽的常規應用主要是作為報告基因融合到載體T-DNA插入區來檢測處理的后代是否發生CRISPR/Cas元件的插入,便于進一步篩選編輯后代[59].Yi et al[60]將GFP融合到CRISPR轉化載體上,了解轉化的香蕉(MusananaLour.)再生苗是否發生CRISPR/Cas元件的整合.這種方法雖然不能直接檢測到編輯事件的發生,但有助于進一步篩選突變植株.Ye et al[61]在六倍體麻竹(DendrocalamuslatiflorusMunro)中將含有靶向mGFP突變位點的sgRNA質粒與含有mGFP的質粒共轉化原生質體,在育孵72 h后成功觀測到了綠色熒光,證明mGFP的突變位點復原,CRISPR/Cas系統可靶向編輯外源基因.該方法使得編輯事件可視化,適合原生質體轉化效率較高的物種.Leblanc et al[62]通過突變連接在內源基因后的GFP來測定突變效率.此方法通過觀察報告基因的表達量同樣可以直觀地進行突變鑒定,但是需要有穩定過表達的植株;對于缺乏有效的遺傳轉化體系和再生周期較長的林木物種來說不太適用.
3 CRISPR/Cas系統在林木中的應用
在林木中利用CRISPR/Cas系統通過農桿菌轉化法獲得穩定的編輯后代,目前該系統只應用在楊樹(PopulusL.)[63]、山豆麻屬植物(Parasponiaandersonii)[64]、麻瘋樹(Jatrophacurcas)、橡膠樹(Heveabrasiliensis)以及蘋果[65]、甜橙[13]等少數幾個林木物種.該技術在林木中的研究應用包含以下幾個方面.
3.1 技術體系的探索與建立
許多林木樹種在CRISPR領域的研究尚停留在技術體系摸索階段.Muhammad et al[66]從Cas蛋白的選擇、sgRNA的設計、突變體驗證、在棗椰樹(PhoenixdactyliferaL.)中存在的局限性等方面論述了對椰棗樹進行多重基因編輯的可行性,以期為使用該技術培育抵抗脅迫的棗椰樹提供理論指導.鵝掌楸(Liriodendronchinensis)是我國特有的珍稀物種,目前其相關的CRISPR載體構建工作已經展開[67].唐雨薇等[68]針對茶樹(CamelliasinensisL.)的咖啡堿合成酶編碼基因(TCS)構建了CRISPR雙靶點表達載體,通過優化茶樹的遺傳轉化和組培再生體系,成功將載體導入到茶樹體細胞胚中并獲得插入突變[69].2015年,喬治亞大學的研究人員在毛白楊(Populustomentosa)中使用Cas9成功敲除木質素合成相關酶基因,結果表明該系統在楊樹中具有較高的效率和序列特異性[70].這是CRISPR/Cas系統在木本植物中得到編輯后代的首次成功應用,自此打開了林木基因編輯的大門.
木薯(ManihotesculentaCrantz)常規的育種方法受到生命周期長、雜合度高和近親衰退的限制[71].Odipio et al[72]開發CRISPR/Cas9技術靶向木薯MePDS基因外顯子,將農桿菌介導的表達載體轉化木薯胚性愈傷組織,AtU6和35S被用來構建該表達載體;編輯后代出現白化和矮化表型,并且白化植株存活不會超過3個體外繁殖周期.篩選分析發現,堿基替換比插入和缺失頻率高,在T0代中純合子突變達到了21.1%,雜合子突變達到了89.5%[72],在6~8周便可以檢測突變事件的發生,可為再生周期長的樹種的編輯結果提供快速的評估和優化.2018年,Lin et al[35]使用CRISPR/Cas9載體靶向綠竹的PDS基因,并進行原生質體轉化,48 h后發現其轉化效率僅為6.6%,這些突變均為1~13 bp的缺失或1 bp的替換;用限制性內切酶消化擴增子后檢測富集的突變達到71%.該系統分別用OsU3、OsU6和35S啟動子驅動.雖然沒有獲得再生植株,但是在原生質體中成功地對內源基因進行編輯,為林木相關基因功能鑒定提供了一種便捷的手段.這些初級階段的工作為后續使用CRISPR/Cas系統培育具有優良生產特性的新品系奠定了基礎.
3.2 生長發育相關基因的功能解析
Muhr et al[73]利用CRISPR/Cas9系統生成該團隊先前鑒定的楊樹候選基因BRANCHED1-1和BRANCHED2-1突變體,結果顯示BRANCHED1-1突變體的芽伸長;BRANCHED2-1突變體具有極端的芽生長表型,并且在每個結節處都有兩個異位葉,這對以后楊樹芽伸長生長甚至是株型調控具有重要的參考意義.Christin et al敲除銀灰楊(P.tremula×alba)的UGT71L1基因后,其毛狀根中的水楊酸含量明顯下降,表明該基因是楊樹水楊酸合成途徑中的關鍵基因[74].但是另一個基因UGT78M1并未敲除成功,表明林木sgRNA的設計要求更為嚴苛、精確.山豆麻屬植物Parasponiaandersonii是除豆科植物外唯一可以進行固氮的木本植物.Zeijl et al對該植物與固氮有關的PanHK4、PanEIN2等候選基因進行了定點誘變.研究人員用CRISPR/Cas9系統構建二元轉化表達載體,使用AtU6p驅動小核RNA,并用35S驅動擬南芥密碼子優化的Cas9.使用農桿菌侵染外植體,然后將外植體與再生的愈傷分開,激發芽的形成;新生芽可在4~6周內進行無性繁殖,3個月內生成T1代小苗.基因分型顯示,超過85%的轉化子含Cas9并且有50%以上的發生突變.進一步試驗分析表明,穩定的根癌農桿菌介導的轉化與CRISPR/Cas9基因組編輯相結合可以有效地用于該物種的反向遺傳分析[64].Ye et al通過農桿菌侵染愈傷組織的方式編輯麻竹,突變掉了一個響應赤霉素信號的基因GRG1,與野生型相比再生植株的節間長度明顯增長,株高增大[61],這對于研究禾本科竹子的快速伸長和生長具有重要意義.
用材樹種的生長發育關鍵在于木質部的生長發育.對桉樹(Eucalyptusspp.)與木材生長的相關基因CCR1和IAA9A用毛狀根轉化的方式進行編輯,結果表明幾乎所有的毛狀根都被編輯,但等位基因的編輯效率隨目標基因的不同有很大差異[75].研究發現,SNP位點越靠近PAM,越有可能造成編輯無效.這對具有高度雜合基因組的林木物種來說,其sgRNA的設計必須更加精確、特異,必須考慮到頻繁出現的SNP才能實現有效的基因組編輯[70].對基因組中含有大量SNP的物種來說,其突變鑒定必須更加小心謹慎,以防受到干擾.研究同時還發現CRISPR/Cas系統在楊樹中會高效生成高特異性的雙等位基因突變.Luo et al[76]利用CRISPR/Cas9系統生成了毛白楊的PtoDWF4突變體,經分析發現,PtoDWF4突變體中次級細胞壁的生物合成降低,細胞層數和木質部面積都大幅度降低.該研究解析了楊樹木質部發育的關鍵基因,為以后培育高產量木材的楊樹品種打下了基礎.
3.3 抗逆相關基因解析
Luo et al通過編輯ProPtrWRKY18和ProPtrWRKY35證實毛白楊中的這兩個基因參與對生物脅迫的響應,突變體對真菌的抗性明顯下降[77].速生楊樹容易受到干旱等脅迫[78],Luo et al在2019年還敲除了毛果楊的PtrADA2b等基因,揭示了組蛋白H3K9ac參與干旱脅迫響應的關鍵機制[79].2017年,劉慧慧等[80]對美國白蛾(Hyphantriacunea)翅形成相關基因Wnt-1進行編輯,結果顯示該基因隨著胚胎發育其表達量逐漸下降,這對于解析其基因功能、降低美國白蛾的遷徙能力具有重要意義.2019年Li et al[81]對美國白蛾生殖相關基因用CRISPR/Cas9技術進行定點編輯,突變體后代表現出特異性不育.該技術雖然沒有直接應用于林木自身,但對林木蟲害防治具有重要的生物學意義.
柑橘是最早應用CRISPR/Cas技術的林木物種之一,其遺傳改良受到物種生長緩慢、多胚和單性結實的限制[82].2019年,Jia et al[18]利用CRISPR/cpf1系統靶向了柑橘潰瘍病易感基因CsLOB1并生成突變再生植株.至此,使用CRISPR/Cas技術對柑橘進行遺傳改良又向前邁進了一步.上述研究通過對林木抗逆基因或與之相關的病蟲害基因的解析為林業生產中防治大袋蛾(Claniavartegata)、松材線蟲(Bursaphelenchusxylophilus)等林木蟲害[83],培育抗逆新種提供了新思路.
3.4 非轉基因育種的探究
因涉及到轉基因安全問題,非轉基因技術手段在水果類植物中應用較多.科學家針對葡萄易感基因MLO-7和蘋果的DIPM-1、DIPM-2、DIPM-4基因進行設計,將純化的CRISPR/Cas9核糖核蛋白直接遞送進兩種植物的原生質體進行定向基因組編輯.靶向深度測序以及生物學重復統計分析發現,葡萄的突變率為0.1%,而蘋果的突變率是0.5%~6.9%.雖然突變頻率較低,但該方法不會產生轉基因殘留,這為培育無外源DNA污染的新品種鋪平了道路[38].
除水果作物之外,橡膠樹異花授粉、童期長、缺素等容易導致生長緩慢[84],傳統的育種方法難以滿足生產橡膠原材料的需求.Hua et al針對橡膠樹花期相關基因FT和TFL1設計sgRNA,然后通過將RNP轉化原生質體的方法成功建立了橡膠樹CRISPR/Cas9系統,為培育非轉基因、高產橡膠新品系提供參考[85].
3.5 林木生殖相關基因研究
麻瘋樹種子提煉的生物油可以替代化石燃料,被認為是一種潛在的生物能源.但是現階段麻瘋樹的種子產量很低,難以進行規模化生產.Xu et al報道外源細胞分裂素可以提高雌雄花的比例進而提高種子產量[86].為了探究細胞分裂素對麻瘋樹成花機制的調控作用,Xu et al利用CRISPR/Cas9系統突變該物種中的一個細胞分裂素合成相關基因JcCYP735A;突變體生長遲緩,其內源反式/順式玉米素與核苷濃度顯著降低,細胞分裂素含量下降.這些結果將有助于細胞分裂素代謝基因功能的進一步研究,提高麻瘋樹種子的產量[87].
Charrier et al[88]研究了梨(PyruscommunisL.)的PcTFL1.1基因,編輯體多為嵌合突變類型且呈現出早花表型.對該基因的研究有助于培育提前開花結實的新品種和加速梨樹的快速生殖繁育.Elorriaga et al[89]對楊樹的花分生組織同源基因LEAFY和兩個花器官同源基因AGAMOUS進行編輯,沒有發現脫靶事件,轉化子達到了77.5%的突變效率.楊樹多為無性生殖,其遺傳力衰退嚴重,該研究對于研究楊樹的開花結實和實生生殖意義重大.
CRISPR/Cas系統在木本模式植物楊屬中的應用見表1[90-103].
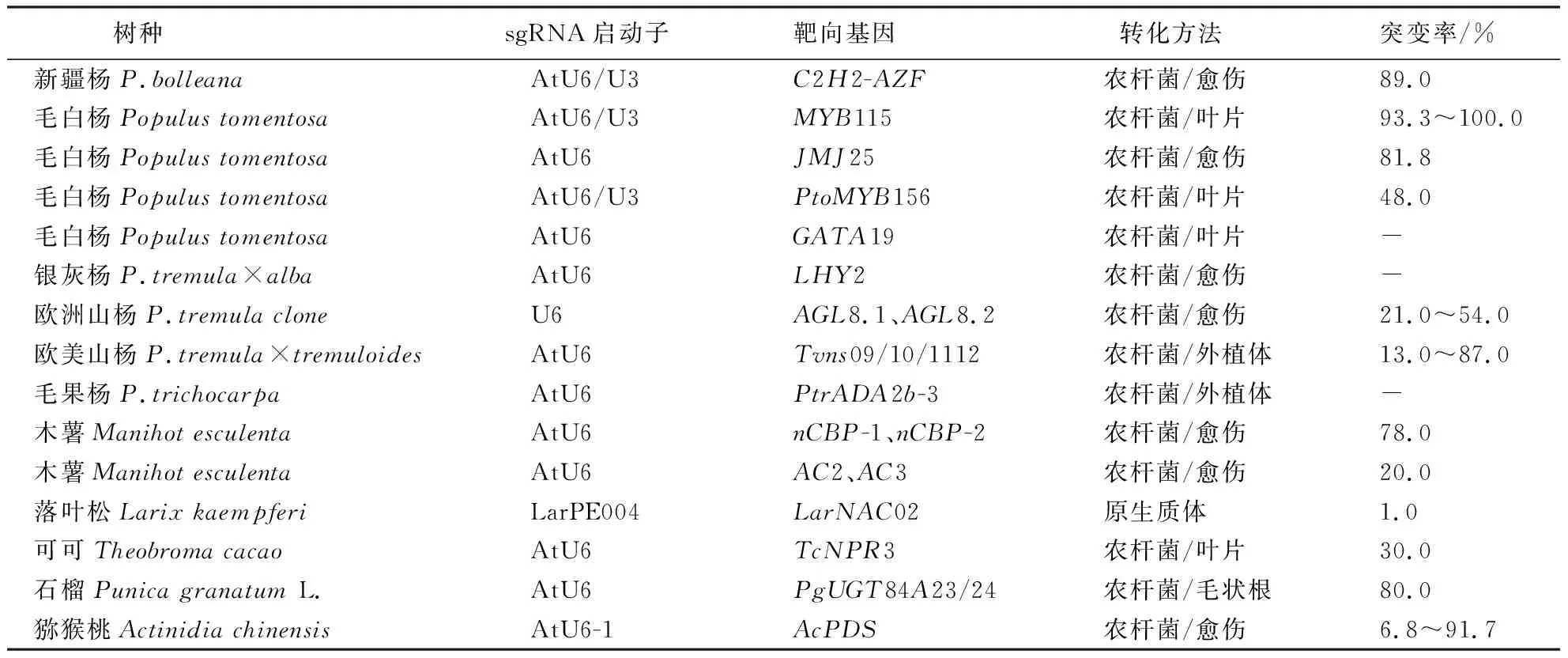
表1 CRISPR/Cas系統在楊樹等林木物種中的研究與應用 Table 1 Research and application of CRISPR/Cas system in poplar and other forest species
4 展望
針對CRISPR/Cas系統的不足,科學家如今已經開發出許多CRISPR/Cas新技術.Benjamin et al設計的Cas9突變體SpRY可以靶向幾乎所有的PAM序列,且在人類細胞中獲得了以前無法獲得的與疾病相關的遺傳變異[104].Gao et al在水稻和小麥中建立的引導編輯系統(plant prime editing, PPE)能夠實現12種類型的精準編輯,為植物的遺傳育種提供豐富的突變類型,生成更多可供選擇的優良性狀[105].HDR途徑、單堿基編輯器、RNA編輯和這些更加高效精準的CRISPR/Cas新技術目前只在人類醫學、動物和農作物當中得到應用,在木本植物研究中應用較少或未有相關報道.這些技術將有利于林木基因序列多態性的高效開發與利用.
雖然麻竹、橡膠樹等物種的原生質體實現了基因編輯,但大多數林木物種的原生質體制備、高效轉化以及再生仍然是一個技術難題.而且RNP法也多依賴于原生質體的高效轉化與再生.因此,開發高效的原生質體轉化和再生體系對林木基因編輯新品系的開發具有重要的助推作用.同時,CRISPR/Cas系統在林業上的研究多集中在經濟水果中,局限于廣譜性基因的研究,對于用材和生態保護類物種的研究較少.目前僅對裸子植物中的落葉松進行相關研究[100],林木裸子物種未見相關研究報道.這與木本植物基因組測序工作相對滯后、靶位點設計分析平臺收錄的林木物種基因組數據不夠完善、多數林業品種存在遺傳轉化壁壘等有關.因此建立健全開放的網絡數據庫,構建高通量突變體文庫,加快林業良種的基因組測序,收錄更多林業生產上常見品種的基因組信息,探索建立穩定高效、耗時短、成本低廉的遺傳轉化體系等,將會極大拓展CRISPR/Cas系統在林業科學尤其是木本良種選育中的應用范圍.
在林業科學研究當中,CRISPR/Cas系統多應用于林木物種自身的基因編輯,而在與其相關的生物脅迫上的應用十分有限.當然,這涉及到昆蟲學、微生物學和樹木病理學等其他學科的發展.只有多學科協同發展,才能使CRISPR/Cas技術更好地服務于木本植物病蟲害研究,促進林業科學發展.此外,轉基因遞送方式會帶來外源基因的插入與表達,木本植物的世代周期一般很長,很難通過后代群體分離而剔除.這無論是對植物本身還是對生物環境都會帶來不可預估的影響.在生物安全備受關注的今天,除RNP法外,更多無外源DNA污染的遺傳轉化方法的開發已是大勢所趨.CRISPR/Cas技術的安全發展需要國家及時出臺相關法律法規,對基因編輯植物進行監管.隨著技術的進步,CRISPR/Cas系統必將更加安全完善,使植物遺傳改良向著有利于人類社會的方向發展.

