蓖麻種子萌發和幼苗生長對重金屬Zn2+的脅迫響應※
●尹明達 羅 蕊 包春光 孟祥越 孫 雪 王凡浩 賈崇寧 李正彩 張圓圓 黃鳳蘭,3,4,5,6,7※※
(1.內蒙古民族大學生命科學與食品學院 內蒙古 通遼 028000;2.通遼市農畜產品質量安全中心 內蒙古 通遼 028000;3.蓖麻育種國家民委重點實驗室 內蒙古 通遼 028000;4.內蒙古自治區高校蓖麻產業工程技術研究中心 內蒙古 通遼 028000;5.內蒙古自治區蓖麻育種重點實驗室 內蒙古 通遼 028000;6.內蒙古自治區蓖麻產業協同創新中心 內蒙古 通遼 028000;7.蓖麻產業技術創新內蒙古自治區工程研究中心 內蒙古 通遼 028000)
蓖麻(Ricinus communisL.)屬雙子葉植物綱、大戟目、大戟科、蓖麻屬草本植物[1],是重要的油料作物,在生態修復、醫藥前體開發、生物防治等領域具有很高的開發利用價值[2]。蓖麻耐旱、耐瘠薄,適應性強,不與糧棉爭地,地邊拐角均可栽植,因此我國的蓖麻資源十分豐富且分布廣泛[3]。
鋅是所有生物體必需的元素,它密切參與植物體內的各種生命代謝活動[4]。對于植物來說,鋅有利于植物生長素的形成,還有增強抗逆性的作用。植物缺鋅會導致植株短小、葉片的擴展與伸長受到限制、節間短[5],但并不是說鋅的濃度越高植物生長就越好。對植物幼苗來說,吸取過量的鋅會明顯降低葉綠素含量,且會嚴重影響植物根和葉片的生長。現階段,鋅礦的開采、鍍鋅、儀器儀表及機械制造等工業活動,各種化工廠排放的工業廢水中都含有大量的Zn2+,燃煤的煙塵中的鋅含量也常超標,會對土壤、水源和大氣造成嚴重污染[6]。鋅污染會破壞土壤的結構與功能;還會影響土壤的理化性狀,嚴重時還會威脅土壤的自然生產力[7]。被鋅污染的土壤中微生物的種類和數量顯著降低,土壤酶的活性被破壞[8]。鋅對水的污染更加嚴重,因為鋅對水生動物的毒性更大,如用含鋅污水澆灌作物,會造成污染范圍擴大。
蓖麻對各種重金屬離子有著很高的耐受性,而鋅是蓖麻生長必不可少的微量元素,濃度過高的Zn2+又會對蓖麻產生脅迫影響。研究蓖麻對Zn2+的耐受程度及其耐受原因,對治理鋅污染土壤具有重大意義,且為后續深入開展蓖麻抗逆性研究奠定了基礎。本研究以‘2129’品系蓖麻為材料,對該種蓖麻種子及幼苗測定各項生理指標,從而研究蓖麻種子萌發和幼苗生長對Zn2+的耐受程度。
1 材料與方法
1.1 材料
1.1.1 植物材料‘2129’品系的蓖麻種子,由內蒙古自治區蓖麻育種重點實驗室提供。
1.1.2 設備與器具設備:各種型號移液器、分析電子天平EP214Dcd、高速大容量低溫離心機(multifuge X3)、小型高速低溫離心機(eppendorf Centrifuge 5424 R)、 酶 標 儀(infinite M200 pro)、HVE-50 型高溫高壓滅菌鍋、超低溫冷凍冰箱(Thermo Scientific Forma 702)。
器 具:1.5mL、4mL、15mL 離 心 管,30mL玻璃試管,50mL、100mL、500 mL、1 000mL 容量瓶,100mL、1 000mL 燒杯,玻璃棒,石英管,1 300mL 圓形塑料培養盒,直徑100mm 陶瓷研缽及缽杵。
1.1.3 試劑七水合硫酸鋅(Z nSO4·7H2O)、液氮、愈創木酚、30% H2O2、20% TCA、0.5%TBA、PBS(pH7.8,50mm)、0.1mol/L H2O2、2mm NADPH、10mm GSSG。
1.1.4 其他干凈的蛭石、干凈無污染的黃土。
1.2 試驗設計
準備飽滿健康的蓖麻種子若干,蛭石若干,黃土若干,1 300mL 圓形塑料培養盒17 個,濾紙。將圓形塑料培養盒進行121℃、20min 高壓滅菌,取出后在每個盒蓋中間部位打若干直徑為15mm 的孔洞并將濾紙粘在上面,將孔洞全部遮住。選出1 700 粒蓖麻種子,平均分成17 份。在培養盒中加入大約150g 蛭石,將17 份種子分別均勻地撒在17 個培養盒的蛭石上,再用大約150 g 蛭石將其覆蓋。用無水硫酸鋅配制不同濃度的ZnSO4溶液,分別為120mg/L、240mg/L、360mg/L、480mg/L、600mg/L、720mg/L、840mg/L、960mg/L、1 080mg/L、1 200mg/L、1 320mg/L、1 560mg/L、1 800mg/L、2 040mg/L、2 280mg/L,每種濃度的溶液800mL。向15 個培養盒中澆入不同濃度硫酸鋅溶液,并做好標記,剩余兩個培養盒中各加入800mL 清水,作為種子對照和栽種幼苗預備。將17 個培養盒放在25℃有光照的溫室中培養72 h。后用清水篩洗出來,并按不同處理分開擺放在干凈的桌面上。
在最后一個清水培養的培養盒中取根長、大小一致的40 粒蓖麻萌發種子,播種至裝有大約1.5kg/盆黃土的花盆中,使用清水與濃度120mg/L至2 280mg/L 的ZnSO4溶液分別對幼苗進行培養。
1.3 測試方法
1.3.1 種子形態學觀察對上述經過清水與濃度120mg/L 至2 280mg/L 的ZnSO4溶液培養過的蓖麻種子進行觀察,并拍照保存。
1.3.2 種子發芽率統計取上述清水與濃度120mg/L 至2 280mg/L 的ZnSO4溶液培養過的蓖麻種子,統計每份種子的萌發數量與未萌發數量,記錄數據并計算不同濃度處理后的種子發芽率。
1.3.3 種子生理指標測定膜脂受損程度以及植物的抗逆性通過檢測MDA 含量來測定[9]。蓖麻種子中MDA 含量的測定原理參照張清航[10]論文中的原理。公式:
注:V1為提取液總體積(4mL);V2為測定用的酶液體積(1mL);W為樣品鮮重(0.4 g)。
CAT 活性的測定。過氧化氫酶主要用于催化過 氧化氫進行反應[11-12]。對CAT 活性的測定及其原理參照Gill S S、Quan L J 與楊節[13-15]的論文。以每分鐘 OD 值變化(減小)0.1為1個酶活性單位(U)。公式:
注:ΔA240為反應時間內吸光度的變化;W為樣品鮮重(0.4g);t為反應時間(3min);V1為提取酶液總體積(4mL);V2為測定時取用酶液體積(0.2mL)。
GR 的測定。對谷胱甘肽還原酶活性的測定參照劉振玉[16]論文中所述的GR 的特性來進行測定與計算。按每克樣本每分鐘催化1μmol NADPH氧化為1 個酶活單位(U)。公式:
注:ΔA340為實驗組在反應時間內吸光度的變化;ΔA空白為空白組在反應時間內吸光度的變化;ε 為NADPH 摩爾消光系數6.22×103L·mol-1·cm-1;d為比色皿內徑(5.85mm);W為樣品鮮重(0.4g);t為反應時間(2min);V1為提取酶液總體積(4mL);V3為反應體系總體積(2.25mL);V2為測定時取用酶液體積(0.3mL)。
P OD 的測定。POD 活性的測定原理參照GARCíA-PONCE á L[17]等人的論文。以每分鐘OD值變化(升高)0.01 為1 個酶活性單位(U)。公式:
注:ΔA470為反應時間內吸光度的變化;W為樣品鮮重(0.4g);t為反應時間(3min);V1為提取酶液總體積(4 mL);V2為測定時取用酶液體積(0.02mL)。
1.3.4 幼苗形態學觀察分別取培養7d、15d、21d 的蓖麻幼苗的根與葉片,用清水洗凈并進行拍照對比觀察,清洗時注意不要損壞根莖與葉片。
1.3.5 幼苗生理指標測定葉片的生理指標測定方法參 照1.2.1 中對 種 子MDA、CAT、GR、POD 四個指標的測定,測定材料為四葉期處理后的新鮮葉片。
2 結果與分析
2.1 種子萌發對Zn2+的脅迫響應
對用清水與不同濃度ZnSO4溶液處理3d 后的種子進行觀察,蓖麻種子發芽率統計結果見表1。由表1 可以看出,用不同濃度Zn2+處理的蓖麻種子的萌發程度與清水組相比差異顯著,但未表現出明顯規律,在Zn2+濃度達到960 mg/L 時,發芽率達到最高且顯著性差異最大。
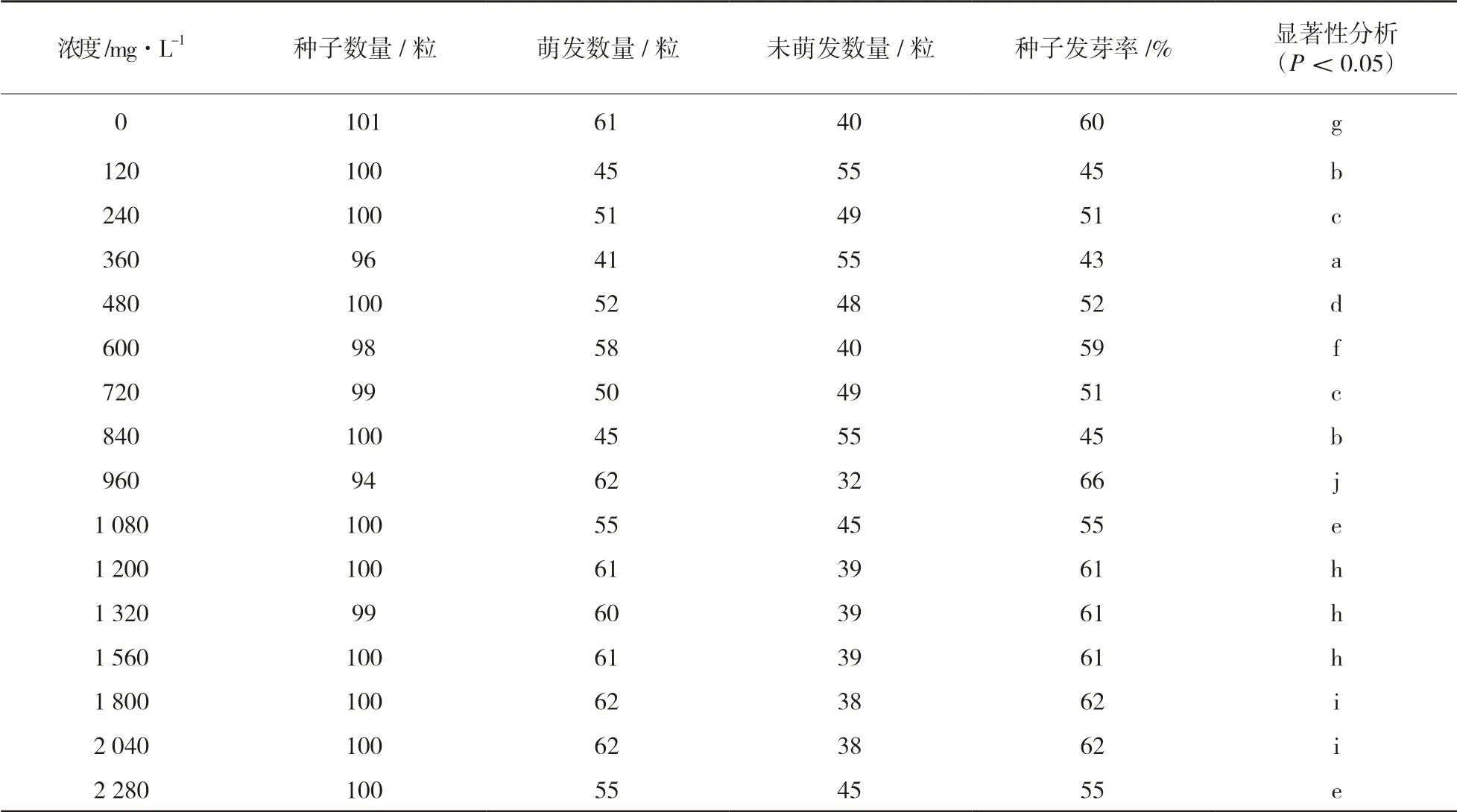
表1 蓖麻種子發芽率統計結果
對種子進行不同濃度的Zn2+處理與培養,3d后,蓖麻種子根長統計結果見表2,蓖麻種子根粗統計結果見表3。
由表2 可以看出,與清水組相比,當Zn2+濃度在480mg/L 以下時,種子根長逐漸增長;在Zn2+濃度超過480mg/L 后差異顯著,但未表現出明顯規律;在Zn2+濃度達到960mg/L 時,蓖麻種子的根長達到最高值41.32mm。由表3 可以看出,根粗則僅在部分濃度處理時差異顯著且未出現明顯規律,但在Zn2+濃度大于1 320mg/L 后,根粗數值全部低于正常數值,但沒有出現蓖麻種子死亡,證明蓖麻對鋅具有很高的耐性。此結果與呂冬梅[18]的研究Zn2+結果相吻合。
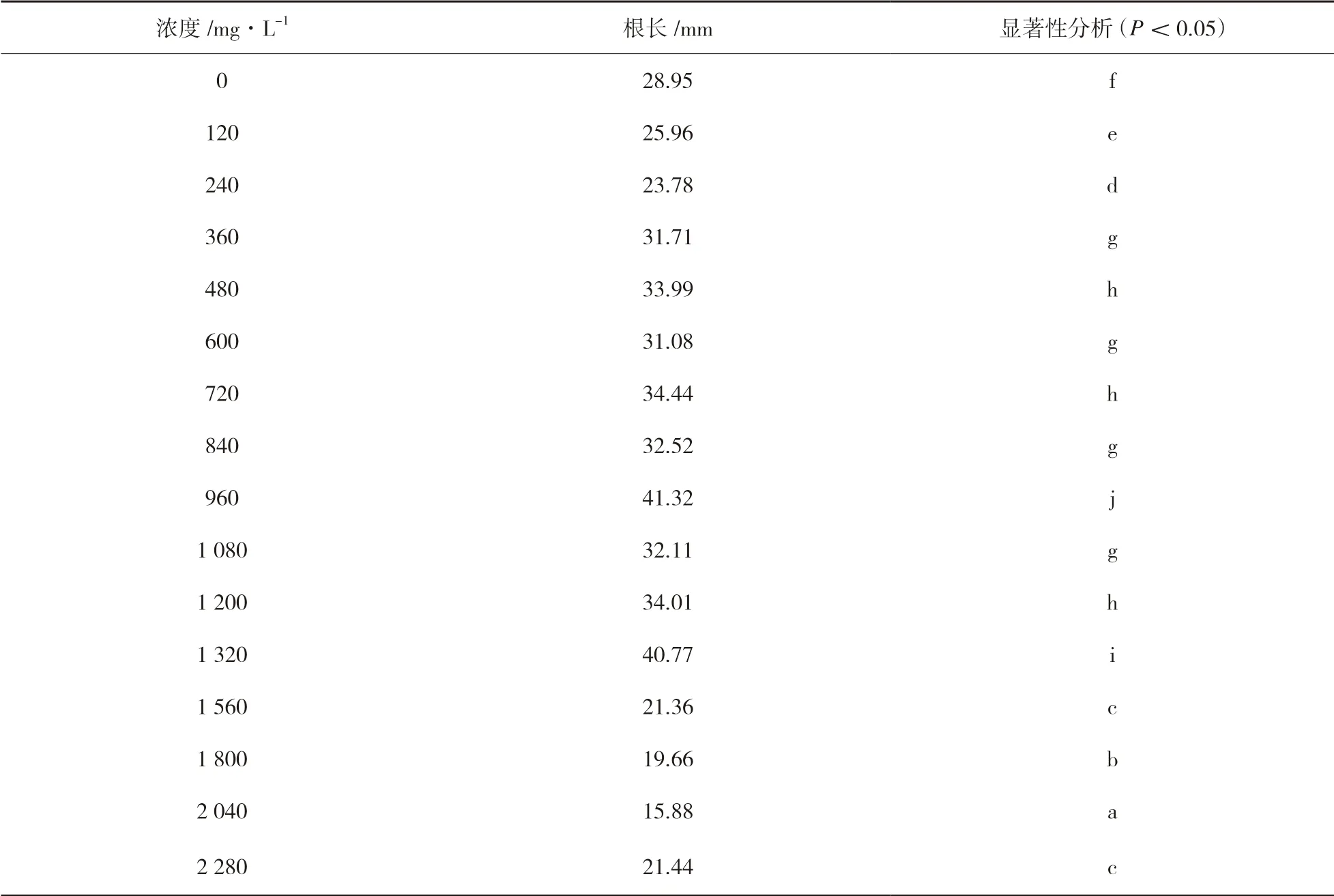
表2 蓖麻種子根長統計結果
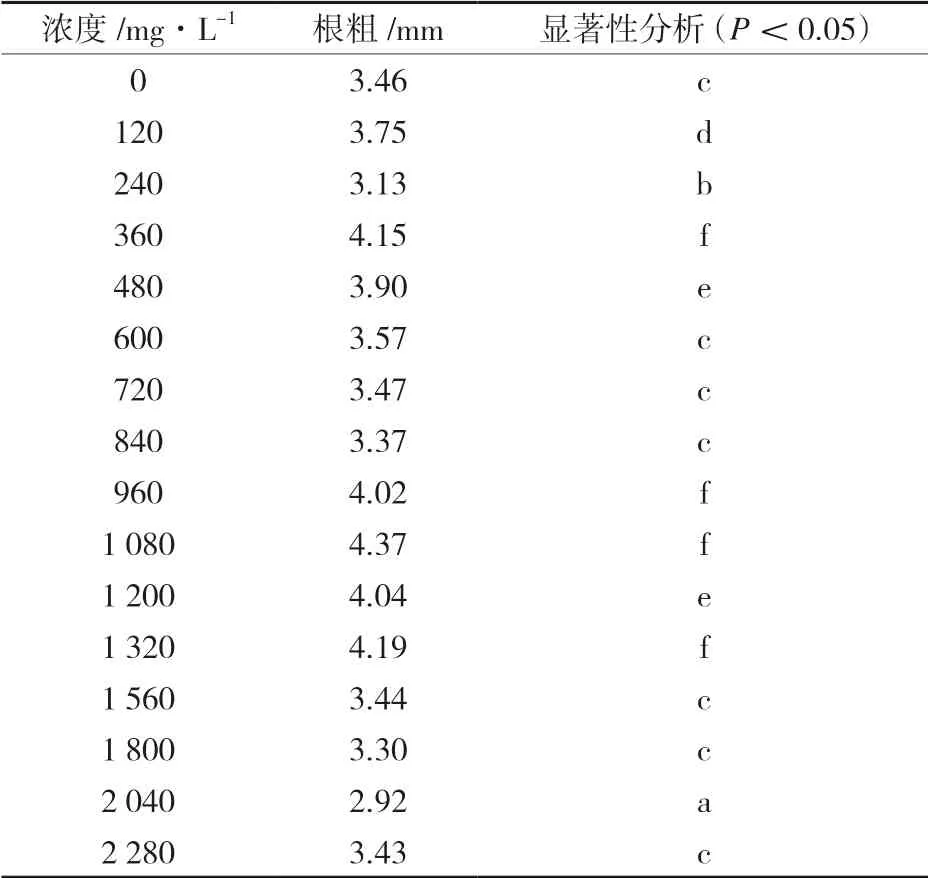
表3 蓖麻種子根粗統計結果
分別用480mg/L、720mg/L、960g/L、1 200mg/L、1 560mg/L、2 040mg/L 的ZnSO4溶液對蓖麻種子進行培養,如圖1~7,圖中A 為處理后萌發的種子,B 為處理后未萌發的種子。
從圖1~4 可以看出,與清水組相比,Zn2+濃度達到720mg/L 時,蓖麻種子表面開始出現黃色斑塊;Z n2+濃度達到960mg/L 時斑塊明顯減少;Zn2+濃度在1 080 ~1 320 mg/L 之間時,部分種子主根明顯增長,但側生根數量減少且黃色斑塊少量增加;Zn2+濃度大于1 320mg/L 時,種子表面黃色斑塊增加,主根長度減小,幾乎無側生根。
由表1 可以看出,用不同濃度Zn2+處理的蓖麻種子與清水組相比差異顯著,但未表現出明顯規律,且在Zn2+濃度達到960 mg/L 時,顯著性差異最大。同時,在處理濃度大于960mg/L后,部分數值大大低于正常數值,因此,本實驗選用960mg/L 濃度處理的種子進行生理指標測定。
按照1.3 中所述方法對培養后的種子進行生理指標測定,種子中MDA 含量、CAT 活性、GR活性和POD 活性的測定結果,見圖8。
由圖8 可以看出,與清水培養后的種子相比,不同Zn2+濃度處理的種子MDA 含量、CAT和POD 活性都低于對照,GR 活性則遠遠高于對照。
2.2 幼苗生長對Zn2+的脅迫響應
根據各處理下蓖麻種子萌發情況,選用Zn2+濃度為960mg/L 的ZnSO4溶液對蓖麻幼苗進行培養,分別在7d、15d、21d 時對幼苗的整體、葉片及根部進行觀察并分析。結果見圖9、圖10、圖11。圖A 為處理后的幼苗植株形態,圖B 為處理后的幼苗葉片形態,圖C 為處理后的幼苗根形態;CT 為實驗組,CK 為對照。
可以發現,幼苗植株在培養7d 時與對照相差不大,隨著時間增加,植株越來越小;幼苗根長在培養7d 時比對照長約1/3,到15d 時根長嚴重縮短,到21d 時,側生根明顯減少且主根呈現不健康的棕紅色;幼苗葉片在培養7d 時與對照無明顯差異,到15d 時葉片開始褪綠并出現黃色斑點,到21d 時,葉片嚴重褪綠,葉面大幅度縮小且黃色斑塊增多。但即使在該濃度下處理21d,幼苗仍未出現死亡,證明蓖麻對Zn2+具有很強的耐性。
根據1.3中所述方法對培養7d、15d、21d 后的幼苗分別進行生理指標測定,幼苗MDA 含量、CAT活性、GR 活性、POD 活性的測定結果,見圖12。
由圖12 可以看出,用Zn2+濃度為960mg/L的ZnSO4溶液處理的幼苗MDA 的含量與POD 活性低于對照很多,而CAT 與GR 活性則高出對照很多,其中用Zn2+濃度為960mg/L 的ZnSO4溶液處理的幼苗的POD 活性與對照相差最多。且在整個實驗過程中,沒有出現幼苗死亡現象,證明蓖麻對Zn2+的耐受程度極高。
3 討論
隨著鋅污染日益增加,大量含鋅污染物以塵、煙等形式排放到環境中,并最終通過土壤、水源、植物吸收和積累對人類健康造成威脅[19]。高效的處理鋅污染逐漸成為目前急需解決的問題。植物對重金屬的耐受程度與重金屬在其體內的積累、轉運等因素密切相關[20]。重金屬脅迫不但會影響植物中葉綠素的合成,還會影響植物體內的正常代謝,最終導致植物體中各物質含量的改變[18]。相關分析表明,Zn2+在植物體內積累超出閾值,會對植物造成毒害,抑制植物生長發育,嚴重可能造成植物死亡[21]。蓖麻根系發達,抗逆性較強,對Zn2+有很大的耐受性,可以通過吸收和代謝實現對土壤中鋅的吸附、凈化、固定[22]。Rosselli[23]等的研究表明,植物中Zn2+的轉運能力較好,大部分向地上部分運輸。抑制生長和減少植株生物量是植物對Zn2+脅迫的普遍響應[24,25]。本實驗表明,蓖麻吸收小于960mg/L 濃度的Zn2+會促進其生長,而吸收超過960mg/L 濃度的Zn2+則會對蓖麻產生毒害,抑制其生長,這與Rosselli的研究結果一致。與蓖麻相比,臭椿僅能適應在Zn2+濃度不超1 000mg/L 的土壤中生存,法桐對Zn2+的耐受性更弱,不適合種在鋅污染土壤中[26]。而本實驗中所用最高濃度Zn2+(2 280mg/L)處理的蓖麻仍未出現死亡現象,證明相比于其他植物,蓖麻對Zn2+耐受性更強。
4 結論
在種子萌發階段,隨著Zn2+濃度升高,蓖麻種子的發芽率雖然差異顯著,但無明顯趨勢,在Zn2+濃度達到960mg/L 時達到最大發芽率且顯著性差異最大;根長與根粗顯示出先增后降,再增再降的趨勢;在生長過程中即使Zn2+濃度達到2 280mg/L,種子仍未出現死亡現象,證明蓖麻對鋅有很高的耐受程度;在Zn2+濃度達到960mg/L 時,蓖麻種子中吸收了過量鋅,影響了其生長。在幼苗生長階段,用Zn2+濃度為960mg/L 的ZnSO4溶液處理幼苗,隨著處理時間的增加,幼苗植株越來越矮小,根長縮短,葉片越來越小且褪綠越來越嚴重;生理指標與對照相比證明在Zn2+濃度為960mg/L 的ZnSO4溶液培養下,蓖麻幼苗吸收的Zn2+逐漸增多,最終超過閾值,對蓖麻苗產生了嚴重傷害,影響其生長。但在整個實驗過程中,處理后的種子和幼苗均未出現死亡現象,證明蓖麻對Zn2+有極高的耐受性。

