搏動灌注對體外循環期間血流剪切力及血管內皮糖萼功能的影響
李冠華, 曾劍鋒,李佳妮, 彭成江, 周成斌
隨著體外循環(extracorporeal circulation, ECC)技術的成熟,心血管外科得以迅猛發展,傳統的ECC 灌注模式是“平流灌注”,在主動脈阻斷后血壓波形近一直線,微循環缺乏有效灌注,使血管內皮功能受損,最終激活全身系統炎癥反應[1]。 隨著ECC技術的進步,“搏動灌注”逐漸得以應用,Shepard 等指出,搏動灌注的能量等值壓力高于平均動脈壓,其剩余血流動力學能量產生的舒張期額外勢能使微循環灌注壓大于毛細血管閉合壓,從而實現微循環有效灌注[2]。 研究表明,搏動灌注減輕主動脈弓和頸動脈竇壓力感受器發放神經沖動,保護ECC 期間器官功能,并緩解全身系統炎癥反應[3]。 本課題組既往研究亦證實,低頻搏動灌注可顯著減少氧化應激及血管內皮炎癥反應,增加一氧化氮合成,減少血管內皮素-1 的釋放[4]。
血流剪切力(flow shear stress,FSS)是血流經過血管腔時所產生的一個沿血流方向的摩擦力,在ECC 期間,血流方式的改變可導致FSS 發生變化,進而影響血管內皮功能[5]。 血管內皮糖萼(vascular endothelial glycocalyx,VEG)是一種富含多糖的絨毛狀結構,覆蓋于內皮細胞管腔膜側,最新研究發現,FSS 的改變可導致VEG 的某些成分脫落,如硫酸乙酰肝素(heparan sulfate,HS)和多配體蛋白聚糖-1(syndecan-1),兩者與VEG 功能密切相關[6]。 Dek?ker 及He 等發現,ECC 期間syndecan-l 和HS 的水平顯著增加[7-8],筆者推測,搏動灌注所引起FSS 的改變可能引起外周血中syndecan-l 和HS 的含量發生變化。 本研究通過對比搏動灌注與平流灌注在ECC 期間FSS 的影響,以及syndecan-l、HS 及趨化因子C-C 型配體2[chemokine(C-C motif) ligand,CCL2]的變化,深入探討搏動灌注對FSS 及VEG 功能的影響。
1 資料與方法
1.1 研究對象 本研究得到醫院醫學倫理委員會批準[2020 倫申第(66)號],所有患者均簽署研究知情同意書。 挑選2019 年1 月至2019 年8 月在廣東省人民醫院ECC 下瓣膜置換手術患者40 名,隨機數字表法分為搏動灌注組及平流灌注組,每組患者20 名。 納入標準為:年齡18 ~70 歲;心功能紐約心臟協會分級Ⅱ~Ⅲ級;左室射血分數(left ventricu?lar ejection fraction,LVEF)>45%;左心室舒張末直徑<65 mm。 排除標準為:二次手術患者、合并感染、凝血障礙、合并房顫、頸動脈狹窄程度>40%或有頸動脈斑塊、術前肝腎功能不全。
1.2 手術及ECC 方法 患者氣管插管全身麻醉成功后,采用傳統胸骨正中切口,使用肝素使ECC 期間活化凝血時間維持在480 s 以上。 使用德國St?ckert S5 人工心肺機行搏動灌注或傳統平流灌注,參照本研究組既往研究[4],搏動灌注參數設置為:搏動頻率30 次/min、脈寬30%、基礎流量30%。手術中ECC 流量為50 ~100 ml/kg,中低溫30 ~32℃,主動脈阻斷后灌注4 ∶1 含血心臟停搏液,術中維持平均動脈壓50 ~70 mmHg,ECC 期間使用α穩態處理酸堿平衡,如出現低血壓則使用去氧腎上腺素維持目標血壓,ECC 結束后魚精蛋白中和肝素。
1.3 評估ECC 下FSS
1.3.1 血液黏滯度的測定 分別在麻醉前靜息狀態、ECC 開始、主動脈開放前、ECC 結束后四個時間點記錄、測定相應數據,均為上述時間點1 min 以內瞬時狀態的測定值。 取患者動脈血2 ml,用SA-500血液流變儀(賽科希德公司)測定血液黏滯度(η)。
1.3.2 頸動脈血流速度及舒張末期半徑測定 根據上述時間點,選定左側頸動脈竇前約1 cm 處,連接彩超線陣高頻探頭,頻率5 MHz 測定頸動脈血流速度(V)。 同時在心電圖R 波觸發點測定頸動脈舒張末期半徑(R)。 最終測量值為3 個連續心動周期測量數值的均值。
1.3.3 FSS 測定 根據Womersley 理論的血流動力學模型測定血管壁峰值剪切力(peak wall shear stress,PWSS)[9]。 具體測定公式如下:
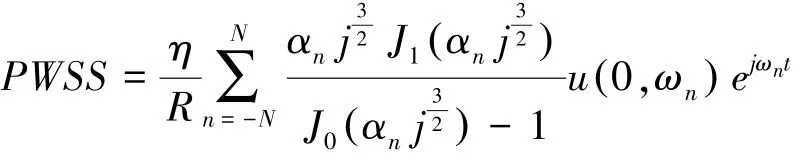
此公式中η 為血液黏滯度(mPa·s);R 為血管半徑(cm);n 為諧波數(次/min);N 為諧波數的最大值;u(0,ωn) 為軸向血流速度的n 階諧波分量;;J0和J1是第一類零階和一階Bessel 函數;為Womersley 值;ρ流體密度(g/cm3);ωn =2nπf為圓頻率(r/s);f為基頻(Hz)。
1.4 VEG 及炎癥標志物的檢測 在上述4 個時間點取已肝素化的患者動脈血,4 000 r/min 離心15 min,根據試劑盒使用操作說明,采用酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)測定VEG 標志物:syndecan-l 及HS。 在手術前及ECC結束后取患者靜脈血,采用ELISA 法測定血管炎癥標志物CCL2。
1.5 統計學分析 計量資料中的連續變量和非連續變量分別使用均數±標準差(±s)、中位數和四分位數間距[Q(Q1,Q3)]表示;計數資料使用數值(百分比)表示。 符合正態分布的、不同時間點及組別的數據使用多重比較重復測量方差分析比較;不符合正態分布的則使用Wilcoxon 檢驗;使用Spearman秩相關分析;所有統計學處理均使用SPSS 18.0 軟件,P<0.05 時表示差異具有統計學意義。
2 結 果
2.1 臨床結果 40 例患者隨機分為平流及搏動灌注組,兩組患者術前基線資料:年齡、性別、體重、既往史、肝腎功能指標、手術類型(單瓣/雙瓣置換)、心功能指標的比較無統計學差異;術中主動脈阻斷時間、ECC 時間的對比均無統計學差異;兩組患者術后ICU 停留時間、住院時間的對比差異均無統計學意義,見表1。
2.2 FSS 基于血管彩超的血管半徑、血流速度等測定值,根據Womersley 模型測定兩組患者的PWSS,結果發現,在ECC 期間,兩組患者的PWSS均進行性下降,與平流灌注相比,搏動灌注患者下降幅度較小,在主動脈開放前、停機后兩個時間點,搏動組患者的PWSS 均較平流組顯著高(P<0.05),差異具有統計學意義,見圖1。
2.3 VEG 及炎癥標志物 Syndecan-1 和HS 是VEG的標志物,其濃度的上升與VEG 的損傷密切相關。與手術前靜息狀態下相比,ECC 期間兩組患者的syndecan-1 和HS 濃度均升高;與平流組相比,搏動組患者停機后的syndecan-1 測量值顯著低(P<0.05),差異具有統計學意義(見圖2A);搏動灌注組患者主動脈開放前、停機后HS 測量值同樣具有顯著性差異(P<0.01 及P<0.05,見圖2B)。
CCL2 是血管炎癥反應標志物,ECC 期間,兩組患者靜脈血的CCL2 濃度較術前顯著升高(P<0.05),在停機后,實施搏動灌注的患者血清CCL2水平顯著降低(P<0.05),差異具有統計學意義(見圖2C)。
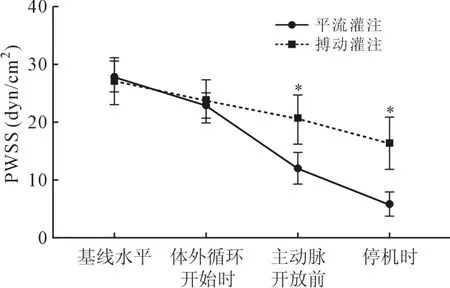
圖1 兩組在ECC 期間PWSS 的變化
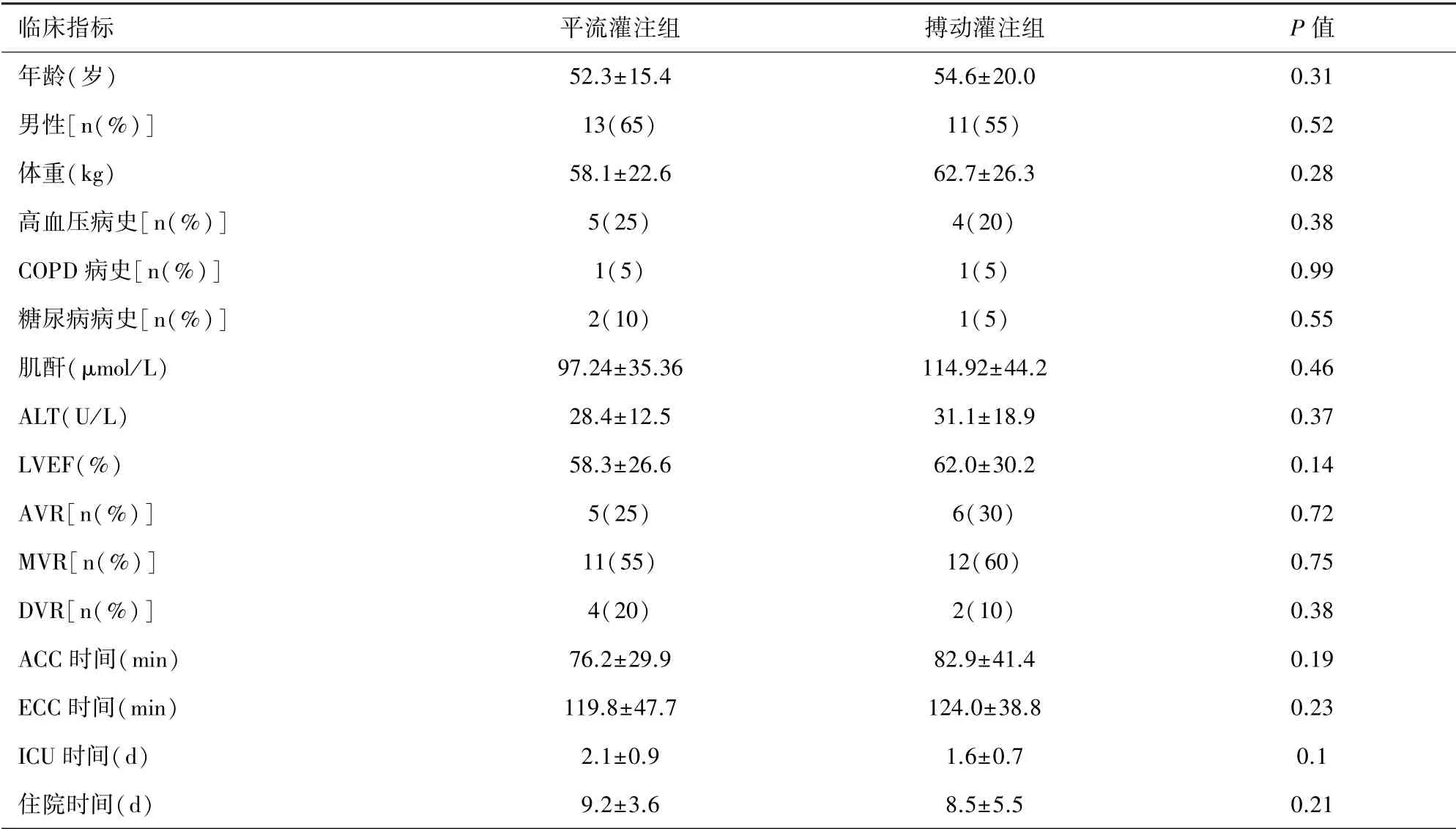
表1 基線資料、術中及術后臨床資料的比較(n=20)
2.4 FSS 與VGA 標志物濃度的相關性 結果發現,PWSS 與syndecan-1 呈負相關(r =-0.81,P<0.01),與HS 也呈負相關(r=-0.79,P<0.01),差異均具有統計學意義,以此說明,實施搏動灌注以維持相對較高的FSS,對減少VEG 的損傷具有積極意義。
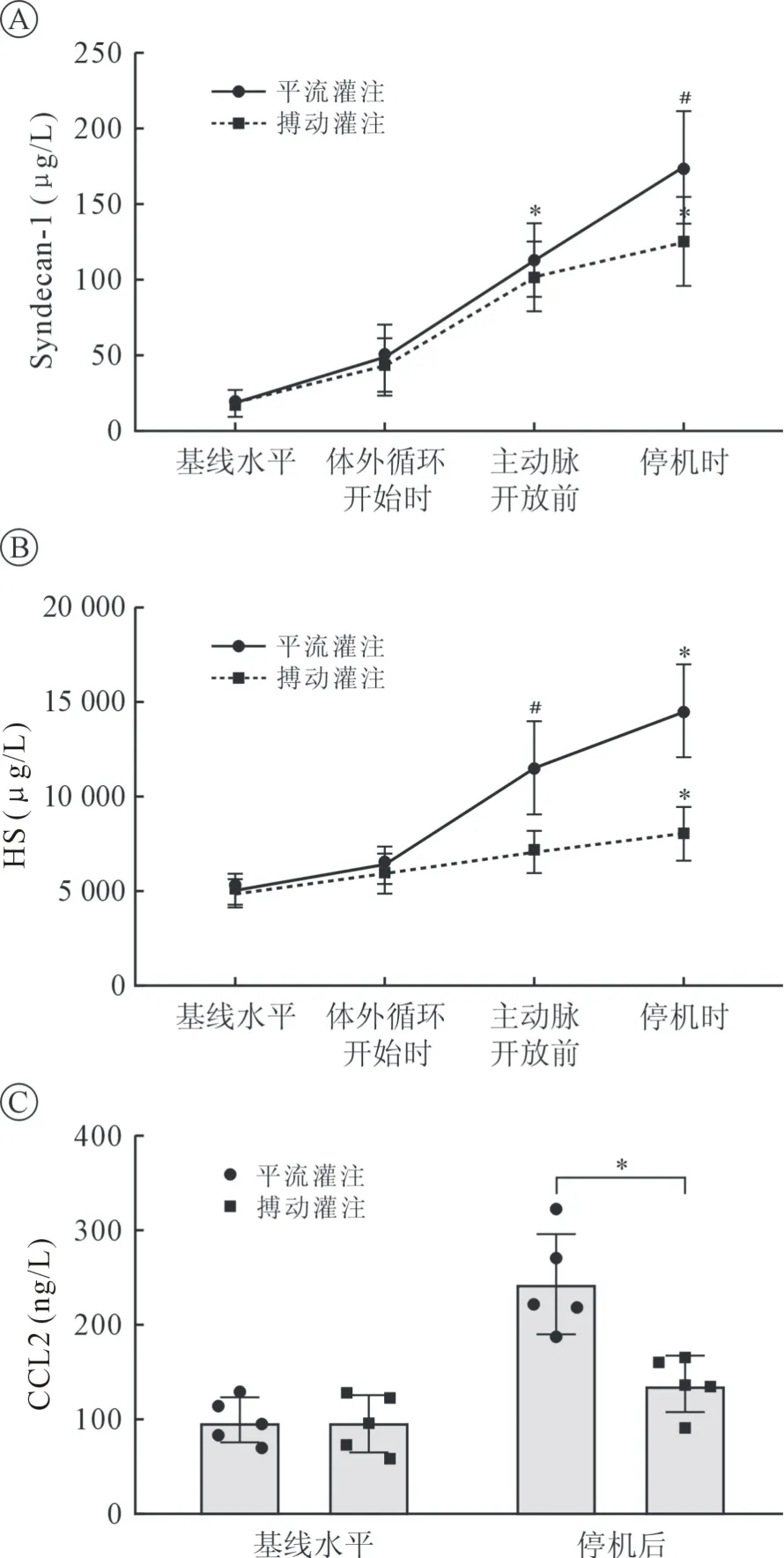
圖2 兩組在ECC 期間syndecan-1、HS及CCL2 的變化
3 討 論
眾多研究已證實,ECC 期間實施搏動灌注具有積極意義,本研究從FSS 及VEG 的角度剖析搏動灌注保護效應的機制。 本研究結果證實,在ECC 期間搏動灌注顯著減少患者PWSS 的衰減幅度;VEG 的損傷程度較輕,VEG 標志物syndecan-1 及HS 的水平較低,血管內皮炎癥標志物CCL2 的表達水平亦較低;此外,PWSS 與syndecan-1 及HS 的水平呈負相關。
搏動灌注的能量等值壓力高于平均動脈壓,由于剩余血流動力學能量產生的額外勢能使舒張期微循環的灌注壓大于毛細血管閉合壓,從而改善組織灌注[2],本課題組既往研究中也證實了上述觀點[4]。FSS 是血流經過血管內皮時產生的摩擦力,在實施傳統ECC 時,非生理性平流灌注的峰值血流速度及PWSS 較低,FSS 可直接作用于VEG 上,對VEG 的合成及分布有重要影響,PWSS 的降低可抑制VEG中蛋白多糖的合成,從而促進VEG 損傷[10]。 本研究發現搏動灌注顯著減少PWSS 的衰減幅度,在恢復自主血流的并行循環期間,兩組PWSS 差異仍具有顯著性,提示搏動灌注對PWSS 的影響可能具有延長效應。
毫無疑問,搏動灌注較平流灌注具有顯著的血流動力學優勢,然而也有少量學者認為,搏動灌注并不能改善患者預后,對術后并發癥發生率、住院死亡率等指標無影響[11]。 筆者認為出現這種差異的原因是多方面的。 首先,研究對象缺乏同質性,對年輕、器官功能良好、常規簡單手術的患者,搏動灌注與否對預后影響可能不大。 本研究及課題組既往研究中,納入的患者均為簡單先天性心臟病及心功能良好的簡單瓣膜疾病,盡管搏動灌注在血流動力學上別具優勢,然而臨床結局無異。 其次,部分研究質量偏低,未從能量學角度來分析搏動灌注,造成偏倚。 此外,搏動灌注保護效應的具體機制尚不明確,研究相對匱乏,是制約搏動灌注進一步臨床推廣的“卡脖子”問題。
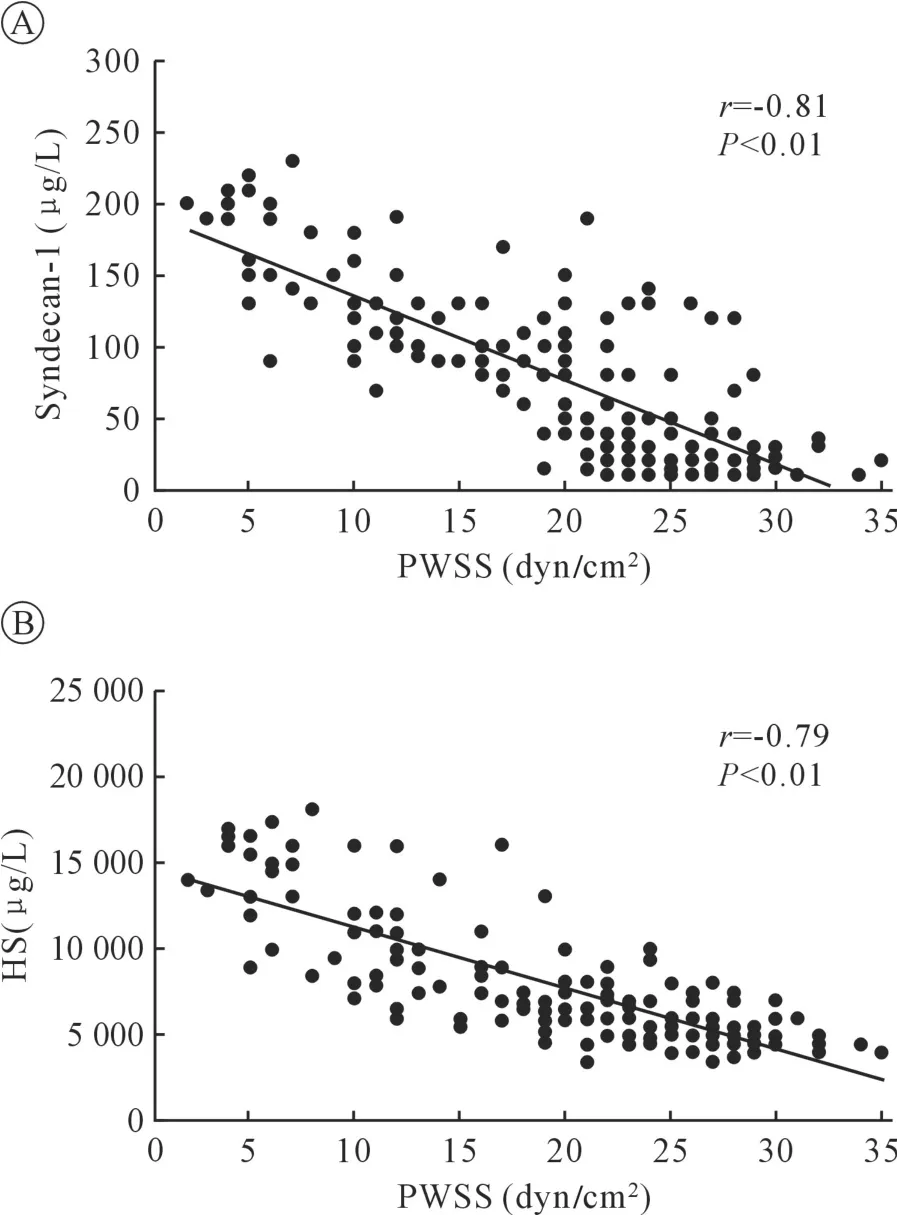
圖3 PWSS 與syndecan-1 及HS 的相關性分析
VEG 是血液與血管內皮之間一層約100 ~750 nm 厚度的蛋白多糖結構,由蛋白聚糖的核心蛋白連接帶負電荷的糖胺聚糖側鏈形成,某些核心蛋白結合在糖基磷脂酰肌醇錨或其他細胞骨架跨膜結構域上,如syndecan 家族,而糖胺聚糖側鏈主要由HS、硫酸軟骨素、透明質酸等組成,其中HS 成分占50%~90%。 因此當VEG 損傷、應激及重分布時,均可引起syndecan-1 及HS 的釋放[12]。 VEG 在內皮細胞表面形成一層負電荷屏障,對維持血管內皮的正常結構與功能至關重要,同時,VEG 是一種力學感受器,可將FSS 的力學信號轉變為細胞內化學信號,在FSS的作用下維持著降解與合成的動態平衡[12]。 本研究結果證實,PWSS 與syndecan-1 及HS 的水平呈負相關,表明搏動灌注緩解ECC 期間PWSS 的衰減,有利于維持VEG 的結構及功能。
研究表明,ECC 可導致VEG 急性損傷,其病因包括:血流方式、手術應激、植入物的影響、低溫、缺血再灌注損傷、全身炎癥反應等。 Sangalli 等[13]發現,ECC 期間非生理性平流的FSS 明顯低于搏動流,與搏動血流相比,持續性機械平流對內皮細胞功能的損傷顯著較高,與本研究結果大致相同。 此外,VEG 還在血管炎癥的病理生理過程扮演著重要角色,當炎癥激活時,腫瘤壞死因子等可引起VEG 脫落,激活肥大細胞釋放組胺從而進一步降解VEG,破壞血管內皮屏障,引起CCL2 等趨化因子激活,進一步加重炎癥反應[14]。 本課題組既往研究曾證實,搏動灌注顯著減少氧化應激及血管內皮炎癥反應[4];而為進一步探索搏動灌注保護效應的分子機制,通過生物信息學分析發現搏動流可下調多個炎癥相關基因的表達,如CCL2、CX3CR1、CD163 及TLR7 等,以CCL2 下調最為明顯[15]。 本研究發現,實施搏動灌注可使血管內皮炎癥標志物CCL2 的表達水平顯著降低,由此推斷搏動灌注通過維護VEG 功能,從而緩解血管炎癥反應。
綜上所述,本研究結果證實,搏動灌注減少ECC期間FSS 的衰減,對于VEG 功能的保護及緩解血管內皮炎癥反應具有積極意義。 本研究從FSS 的角度進一步揭示搏動灌注保護效應的具體機制,為搏動灌注的進一步臨床應用提供確切的科學依據。

