沉默calnexin對舌鱗狀細胞癌細胞增殖、侵襲和遷移的影響
鐘齊健, 金婷婷, 彭毓, 陳偉雄, 李勁松
1.中國科學院大學深圳醫院(光明)口腔科,廣東 深圳(518106); 2.廣州中醫藥大學附屬深圳市龍崗中心醫院口腔科,廣東 深圳(518116); 3.中山大學孫逸仙紀念醫院口腔頜面外科,廣東 廣州(510120)
舌鱗狀細胞癌是最常見的口腔癌。盡管近年來影像診斷、外科治療、放射治療和化學治療等方面取得了長足進步,但舌鱗狀細胞癌患者的5 年生存率僅略有提高[1-2]。舌鱗狀細胞癌的具體發病機制尚未完全闡明,因此揭示舌鱗狀細胞癌發生發展的具體機制并提供相應的治療策略十分重要。內質網是一種重要的細胞器,在蛋白質折疊和質量控制中起著至關重要的作用[3]。內質網應激(endoplasmic reticulum stress,ERS)是由內質網中未折疊或錯誤折疊蛋白質的不斷積累所引起的,而未折疊蛋白反應(unfolded protein response,UPR)則可以減少轉位到內質網內腔的蛋白質數量,增加內質網的轉位和增強內質網的蛋白質折疊能力以保護細胞免受過于強烈的ERS 反應[4]。ERS 可以引起多種應激蛋白的表達上調,如葡萄糖調節蛋白78(glucose-regulated protein 78,GRP78)和葡萄糖調節蛋白94(glucose-regulated protein 94,GRP94)、鈣結合伴侶凝集素calnexin 和Calreticulin以及底物特異性伴侶蛋白等[5]。ERS 蛋白在許多腫瘤類型中都有上調,包括結直腸癌[6]、乳腺癌[7]、肺癌[8]、肝癌[9]和前列腺癌[10]等。目前公認的ERS信號通路包括蛋白激酶R 樣內質網激酶(protein kinase R -like endoplasmic reticulum kinase,PERK)-真核翻譯起始因子2a(eukaryotic translation initia-tion factor 2a,eIF2a)-轉錄激活子4(activating tran-scription factor 4,ATF4)- C/EBP 同源蛋白(C/EBP homoiogousprotein,CHOP)、肌醇酶1(inositol-requir-ing enzyme 1,IRE1)-CHOP、轉錄激活子6(activat-ing transcription factor 6,ATF6)-CHOP 這3 條[11]。在口腔癌中,有文獻報道其中一個ERS 相關蛋白calnexin 表達上調[12]。在大規模組織標本篩選發現舌鱗狀細胞癌中calnexin 較癌旁組織高表達,而近期發現calnexin 可控制線粒體的位置和呼吸鏈反應[13]。結合本課題組前期在線粒體動力學的研究基礎[14],筆者通過干預ERS 蛋白calnexin 的表達以檢測舌鱗狀細胞癌細胞的生物學功能變化,包括細胞增殖、侵襲和遷移,以揭示calnexin 蛋白在舌鱗狀細胞癌發生發展中的作用。
1 材料和方法
1.1 主要試劑和設備
舌鱗狀細胞癌細胞系SCC-9 和SCC-25 購自美國模式培養物集存庫(American type culture collec-tion,ATCC);DMEM-F12(Gibco,美國);胎牛血清(BI,以色列);calnexin 干擾序列和對照序列(蘇州吉瑪基因股份有限公司,中國);RNA 提取試劑Trizol(Life Technologies,美國);Lipofectamine 3 000(Invitrogen,美國);實時熒光定量PCR(qRT-PCR)試劑盒和反轉錄試劑(TaKaRa,日本);calnexin 和內參GAPDH 引物(蘇州泓迅生物科技有限公司,中國);蛋白酶抑制劑(Solarbio,中國);RIPA 緩沖液(Sigma,美國);calnexin 蛋白多克隆兔抗人抗體(Abcam,英國);GAPDH 蛋白抗體、羊抗兔二抗(Proteintech,中國),CCK-8 試劑(Dojindo,日本),Transwell 小室及基質膠(Corning,美國)。實時熒光定量PCR 儀(LightCycler 480,Roche,德國);WB曝光機(Mini Chemi 610,北京賽智創業科技有限公司,中國);酶標儀(Multiskan MK3,蘇州賽恩斯儀器有限公司,中國);相機(BX63,Olympus,日本)。
1.2 方法
1.2.1 細胞培養及分組 用含10%胎牛血清的DMEM-F12 培養基培養細胞SCC-9 和SCC-25。培養條件:體積分數5% CO2,37 ℃,飽和濕度。隔天換液1 次,待細胞鋪滿瓶底時傳代。按轉染試劑盒說明對對數生長期細胞進行轉染,分為calnexin 對照序列組(NC)和干擾組(si-CNX),其中實驗證實si-CNX1 和si-CNX2 能夠有效敲低calnexin 的表達,NC 和si-CNX 序列如下表1。

表1 Calnexin 對照序列和干擾序列Table 1 Calnexin control and interference sequences
1.2.2 采用qRT-PCR 檢測calnexin 表達 各組細胞轉染培養48 h 后,用細胞裂解液裂解,提取總RNA,并用紫外分光光度計檢測總RNA 純度。將總RNA 用試劑盒逆轉錄為cDNA,以引物序列為模板,用實時熒光定量PCR 儀擴增。引物序列如下表2。根據制造商的說明,qRT-PCR 是使用SYBR Green Real-time PCR Master Mix(ReverTra Ace,Toyobo)和LightCycler 480(Roche,Basel,Switzer-land)進行的。對照組的相對表達水平設為1,各組樣品設3 個復孔,采用2-△△Ct法對細胞中calnexin 表達量進行計算。

表2 qRT-PCR 引物序列Table 2 Sequences of the qRT-PCR primers
1.2.3 蛋白提取以及Western blot 實驗 用PBS 沖洗細胞5 min,一共3 次。加入含有蛋白酶抑制劑的RIPA 緩沖液。在4 ℃下將細胞溶解0.5 h,刮下樣品并在4 ℃下以12 000 rpm 的速度離心20 min,收集上清液作為總蛋白。蛋白質提取物通過8%SDS 聚丙烯酰胺凝膠電泳轉移到聚偏二氟乙烯膜,用抗人calnexin 抗體(濃度1∶2 000)、GAPDH 抗體(濃度1∶2 000),在4 ℃冰箱中孵育過夜,然后與過氧化物酶結合的二抗結合,通過化學發光觀察條帶,分析條帶的灰度值。
1.2.4 細胞增殖實驗 經過轉染實驗后,收集細胞并按10 000 個細胞/孔種入96 孔板中。所有的細胞都培養24 h 后使用CCK 8 試劑測定1、2、3、4、5 d的活細胞數。檢測前去除每個孔的培養基,添加10 μL CCK 8和90 μL DMEM/F12的混合物,繼續培養2.5 h后,用酶標儀測量A450 nm處的吸光度值。1.2.5 Transwell 法檢測細胞遷移能力 各組細胞培養24 h 后進行轉染實驗,轉染24 h 后,將溶于200 μL無血清培養基中的2×104個SCC-9 和SCC-25細胞分別接種于8 mm 直徑的Transwell 小室中,24孔板下室加入含10% 胎牛血清的DMEM-F12 培養基,37 ℃、體積分數為5%CO2細胞培養箱中恒溫培養24 h。各小室用棉簽去除細胞懸液,PBS 沖洗2 次,4%多聚甲醛固定20 min,0.1%結晶紫染色20 min,顯微鏡下隨機挑選5個視野拍照計數穿膜細胞。
1.2.6 Transwell 法檢測細胞侵襲能力 取基質膠,4 ℃解凍后用無血清培養液稀釋,平鋪于Transwell小室上室,過夜風干備用。其余步驟同1.2.5。
1.3 統計學分析
采用SPSS 21.0 統計軟件分析數據,計量資料采用均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t 檢驗,P <0.05 差異有統計學意義。
2 結 果
2.1 siRNA 干預calnexin 基因表達
qRT-PCR 檢測發現,SCC-9 和SCC-25 細胞的干擾組si-CNX1 和si-CNX2 中calnexin mRNA 表達量較NC 組下調,差異有統計學意義(P<0.001,圖1a)。Western blot 結果也顯示SCC-9 和SCC-25 細胞的干擾組si-CNX1 和si-CNX2 中calnexin 蛋白表達量下降(圖1b)。
2.2 沉默calnexin 對細胞增殖能力的影響
與NC 組相比,si-CNX1 和si-CNX2 組SCC-9 細胞的增殖速度在第4 天減慢,差異有統計學意義(P <0.01),在第5 天增殖速度進一步減慢(圖2a,P <0.001);在SCC-25 細胞中si-CNX1 和si-CNX2 組增殖速度也是在第4 天(P <0.01)和第5 天較NC組減慢(圖2b,P <0.001)。
2.3 沉默calnexin 對細胞侵襲和遷移能力的影響
與NC 組相比,si-CNX1 和si-CNX2 組SCC-9 細胞的侵襲和遷移能力減弱(圖3a),差異有統計學意義(P <0.001);同樣,與NC 組相比,si-CNX1 和si-CNX2 組SCC-25 細胞的侵襲和遷移能力也減弱(圖3b),差異有統計學意義(P <0.001)。

Figure 1 Expression of calnexin in tongue squamous cell carcinoma cells transfected with siRNA圖1 Calnexin siRNA 轉染舌鱗狀細胞癌細胞后calnexin 的表達
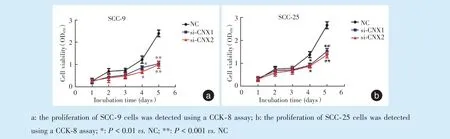
Figure 2 Knockdown of calnexin inhibited the proliferation of tongue squamous cell carcinoma cells圖2 沉默calnexin 基因能夠抑制舌鱗狀細胞癌細胞的增殖
3 討 論
內質網是蛋白質合成的重要細胞器,功能包括跨膜和分泌性蛋白質折疊、脂質生物合成、藥物解毒、鈣儲存和信號傳導等。在穩定狀態下,內質網蛋白折疊機制可以輕而易舉滿足腫瘤細胞的需求。然而,如果錯誤折疊的蛋白質積累超過可耐受的閾值,未折疊蛋白反應將被觸發以提高內質網蛋白質折疊能力。如果未折疊蛋白反應調節失敗,細胞將會走向凋亡[15]。內質網應激在腫瘤中普遍存在,與腫瘤進展和化療耐藥密切相關,耐受持續內質網應激的能力增強了腫瘤細胞的生存和發展。研究發現在舌鱗狀細胞癌中同樣存在內質網應激,且線粒體分裂在內質網應激中具有重要的調控作用[14]。近期又有學者發現內質網應激蛋白calnexin 可以控制線粒體位置和呼吸鏈反應[13]。在本研究中,沉默calnexin 的表達可抑制舌鱗狀細胞癌的增殖、侵襲和遷移能力,揭示了內質網應激在舌鱗狀細胞癌進展中具有關鍵作用。
鈣是一種參與蛋白質修飾、蛋白質折疊、細胞存活和死亡信號傳導等過程的常見信號分子,它儲存在內質網中,在內質網中受到鈣結合的內質網伴侶蛋白Calreticulin 和calnexin 的調節。calnex-in 是內質網上的I 型整合膜蛋白,具有輔助蛋白質折疊、監控內質網蛋白折疊質量和調節內質網應激等作用[16]。一項肺癌患者隊列研究的結果提示calnexin 可能是肺癌血清診斷標志物[17]。此外,calnexin 蛋白水平可能成為5FU 化療Ⅱ/Ⅲ期結直腸癌患者不良臨床預后的一個新指標。體外研究進一步證實calnexin 對結直腸癌細胞生長增殖的重要性,也證明了下調calnexin 的表達可以提高結直腸癌對5FU 化療的敏感性[18]。沉默calnexin 基因可顯著抑制胃癌細胞的增殖和提高細胞凋亡率[19]。孫為增等[20]在腎母細胞瘤中的研究提示沉默calnexin 可促發內質網應激,通過激活JNK 通路從而促進腫瘤細胞的凋亡。用calnexin 中和抗體下調calnexin 的表達,發現肝癌細胞的增殖以及乳腺癌細胞和肝癌細胞的肺轉移均被抑制[21]。因此,calnexin 可能通過調節內質網應激影響腫瘤細胞的生物學功能。
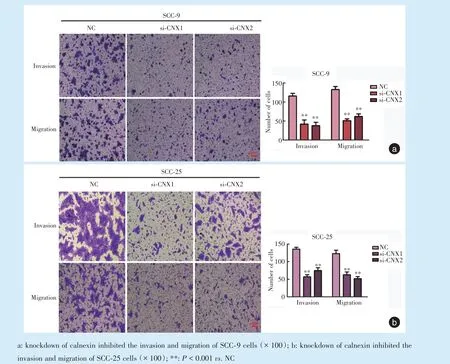
Figure 3 Knockdown of calnexin inhibited the invasion and migration of tongue squamous cell carcinoma cells圖3 沉默calnexin 基因能夠抑制舌鱗狀細胞癌細胞的侵襲和遷移
研究者發現calnexin 在口腔鱗狀細胞癌組織中的表達顯著上調,而且calnexin 的高表達與口腔鱗癌患者預后不良呈正相關,其具體機制可能與免疫逃逸有關[12]。Alam 等[22]發現支架基質附著區結合蛋白1(scaffold matrix attachment region binding protein1,SMAR1)通過下調calnexin 促進腫瘤細胞表面主要組織相容性復合體1(major histocompati-bility complex 1,MHC I)的表達升高,抑制腫瘤的增長。然而,上述研究側重于從免疫學角度探究calnexin 的功能和具體機制,并未揭示calnexin 的直接生物學功能。在本研究中,通過siRNA 敲低cal-nexin 的表達,并在mRNA 水平和蛋白水平證實了calnexin 的沉默效果。CCK8 實驗結果提示下調calnexin 的表達能夠抑制舌鱗狀細胞癌細胞的增殖,Tranwell 實驗則證實沉默calnexin 的表達能夠顯著抑制舌鱗狀細胞癌細胞的侵襲和轉移。cal-nexin 可能是舌鱗狀細胞癌新的治療靶點。
【Author contributions】 Zhong QJ performed the experiments,ana-lyzed the data,and wrote the article. Jin TT,Peng Y revised the arti-cle. Chen WX,Li JS designed the study. All authors read and ap-proved the final manuscript as submitted.

