自身免疫性胰腺炎和IgG4相關硬化性膽管炎的臨床診治
熊慧芳 劉志堅 舒 徐 呂農華 祝 蔭
南昌大學第一附屬醫院消化內科(330006)
背景:自身免疫性胰腺炎(AIP)是與免疫因素有關的胰腺慢性炎癥。IgG4相關硬化性膽管炎(IgG4-SC)是AIP常見的胰腺外表現,其最佳治療方案需進一步明確。目的:探討AIP尤其是IgG4-SC的臨床診治方式。方法:南昌大學第一附屬醫院2015年1月—2021年5月收治的25例AIP患者納入研究,對其臨床、實驗室、影像學、病理學表現以及治療方式和臨床結局進行回顧性分析。結果:25例AIP患者均為I型,男女比例為5.25∶1,平均年齡63.5歲。主要臨床表現為梗阻性黃疸(56.0%)和上腹痛(44.0%),影像學表現主要為胰腺增大飽滿、包鞘征、膽總管下段狹窄繼發膽系擴張,伴血清IgG4水平顯著升高。14例IgG4-SC患者中,3例總膽紅素在1~2 倍正常上限(ULN)之間,3例在2~5倍ULN之間,8例>5×ULN。83.3%的患者通過內鏡超聲引導下細針穿刺抽吸(EUS-FNA)獲得病理學診斷。接受單純激素治療與接受膽管支架聯合或不聯合激素治療的IgG4-SC患者治療前肝功能無明顯差異(P均>0.05),治療后多數患者肝功能恢復正常。結論:AIP是臨床少見疾病,老年男性患者常見,病變常累及膽管引起IgG4-SC,以梗阻性黃疸為首發表現。激素治療可有效緩解梗阻性黃疸,無需額外的膽管支架置入。
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)由Yoshida等[1]于1995年首次提出,其發生與免疫因素有關,是胰腺炎的一種特殊類型。根據臨床特征和組織病理學表現,AIP可分為Ⅰ型和Ⅱ型,多數AIP為Ⅰ型,世界各地報道的Ⅰ型AIP占80%以上,亞洲國家占比更高[2],主要表現為胰腺慢性纖維炎性改變,伴有血清和組織IgG4水平升高。AIP表現為局部病灶時難以與胰腺癌鑒別,臨床診治較為困難。Ⅰ型AIP可有胰腺外器官累及表現,累及膽管時引起IgG4相關硬化性膽管炎(IgG4-related sclerosing cholangitis, IgG4-SC)并出現黃疸,約65%的Ⅰ型患者合并黃疸[3]。然而,由于AIP對激素治療反應迅速,對于IgG4-SC合并黃疸患者是否需聯合膽管支架治療目前仍不明確[3-4]。本研究對近年南昌大學第一附屬醫院消化內科收治的AIP患者進行回顧性分析,旨在探討AIP的臨床診治特點,尤其是IgG4-SC合并黃疸的最佳診治方式。
對象與方法
一、研究對象
連續納入南昌大學第一附屬醫院2015年1月—2021年5月收治的AIP患者,診斷參照2011年國際胰腺病學會發布的國際共識診斷標準[5],該診斷標準包括胰腺實質影像學、胰腺導管影像學、血清IgG4水平、其他器官累及、胰腺組織學五個主要特征以及對激素治療的反應。確診患者首選口服潑尼松治療,初始劑量為30~40 mg/d,治療4周,而后根據病情緩解情況每1~2周減量2.5~5 mg,直至病情基本緩解;如病情反復則再次予激素加量治療,視病情逐漸減量。
二、方法和觀察指標
收集、整理研究對象的相關資料進行回顧性分析。包括人口統計學信息、臨床表現、血清IgG4水平、肝功能指標、CT/MRI/MRCP表現、內鏡超聲(endoscopic ultrasonography, EUS)表現、經內鏡逆行胰膽管造影術(endoscopic retrograde cholangiopancre-atography, ERCP)表現、病理結果、治療方式和隨訪情況。
EUS檢查(Olympus EU-ME2)可明確胰腺形態和膽胰管情況,部分患者進一步行EUS引導下細針穿刺抽吸(EUS-guided fine-needle aspiration, EUS-FNA)獲取細胞或組織病理學結果。部分合并黃疸患者行ERCP以明確膽管狹窄情況,并予置入膽管支架行膽管引流。患者術前均簽署操作知情同意書,禁食8 h以上,操作符合規范。
三、統計學分析
結 果
一、臨床資料
根據2011年國際胰腺病學會國際共識診斷標準,共25例AIP患者納入研究,均為Ⅰ型AIP;男性21例,女性4例,男女比例為5.25∶1;年齡45~83歲,平均(63.5±10.9)歲。主要臨床表現為梗阻性黃疸者14例(56.0%),上腹痛11例(44.0%);2例(8.0%)患者有上腹脹、乏力癥狀,2例(8.0%)體格檢查考慮胰腺占位。1例患者合并自身免疫性腎炎;1例因十二指腸漿細胞浸潤致潰瘍、狹窄,行外科手術治療。
23例患者為初治,11例初治和2例復發患者接受激素治療。復發患者中1例既往接受激素聯合經皮肝穿刺膽管引流治療,1例接受單純激素治療。
13例接受激素治療者中9例合并黃疸,4例無黃疸。將25例患者按有或無黃疸(是否IgG4-SC)分為2組,其治療方式和臨床結局見表1(未接受干預者均為拒絕激素或膽管支架置入治療)。

表1 25例Ⅰ型AIP患者的治療方式和臨床結局
二、實驗室檢查
21例患者行血清IgG4檢查,其中2例檢測值在正常范圍內,其余19例IgG4顯著升高,超過正常上限(upper limit of normal, ULN)2倍者2例,超過檢測上限者17例。
14例IgG4-SC患者均存在肝功能異常,各指標均值分別為ALT(179.3±104.3) U/L(4×ULN),AST(130.1±61.4) U/L(3×ULN),總膽紅素(TBil)(131.6±75.8) μmol/L(6×ULN);3例患者TBil在1~2倍ULN之間,3例在2~5倍ULN之間,8例>5×ULN。12例接受治療的IgG4-SC患者中,單純激素治療組與膽管支架聯合或不聯合激素治療組間治療前肝功能差異無統計學意義(P均>0.05;表2);除2例分別合并胰腺癌和嚴重膽道感染者外,其余患者治療后肝功能均恢復正常。
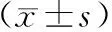
表2 IgG4-SC患者不同治療組間治療前肝功能比較
三、影像學表現
所有患者均行上腹部CT檢查,其中9例同時行上腹部MRI/MRCP檢查,影像學表現包括胰腺體積增大飽滿、臘腸樣改變、低回聲改變16例,包鞘征4例,局灶性胰腺腫塊3例,膽總管下段狹窄繼發膽系擴張14例,胰管狹窄9例,典型表現見圖1A、1B。22例患者行EUS檢查,表現包括胰腺體積增大飽滿、臘腸樣改變16例,包鞘征5例,局灶性胰腺腫塊6例,膽總管壁增厚呈“三明治”征并膽總管上段擴張13例,典型表現見圖1C、1D。6例患者行ERCP檢查,可見膽總管下段不同程度的截斷性狹窄、上段擴張。對激素治療有反應的患者,胰腺增大和膽、胰管狹窄明顯緩解,典型表現見圖1H、1I。
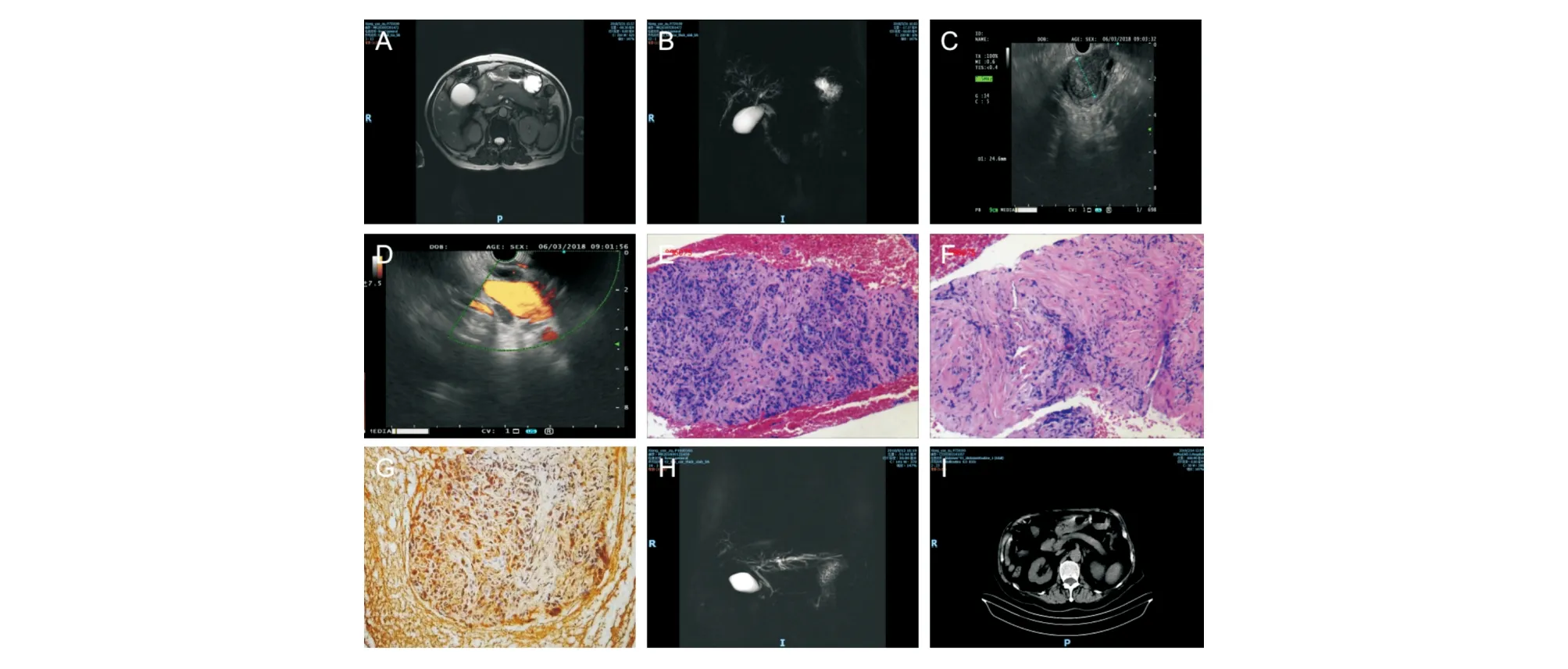
A:MRI示胰腺彌漫性信號異常,包鞘征;B:MRCP示膽總管中下段截斷,胰管顯示不清;C:EUS示胰腺回聲均勻減低,包鞘征;D:EUS示膽管壁增厚,雙邊、“三明治”改變;E:HE染色示胰腺腺泡萎縮(×100);F:HE染色示散在的淋巴細胞和漿細胞浸潤,間質纖維增生伴玻璃樣變性(×100);G:免疫組化染色示漿細胞IgG4強陽性表達(×200);H:激素治療9個月后MRCP示膽總管中下段和胰管顯影(圖B病例治療后改變);I:CT示激素治療后胰腺體積縮小,形態恢復正常(圖A病例治療后改變)
四、病理學表現
Ⅰ型AIP的主要病理學表現為導管周圍淋巴細胞、漿細胞浸潤;席紋狀纖維化;閉塞性靜脈炎;大量IgG4陽性細胞(>10/HPF)[5]。本組18例患者行胰腺EUS-FNA獲得細胞/組織病理學結果,病理完全符合或高度提示AIP改變15例(83.3%),典型表現見圖1E-1G。1例患者因十二指腸潰瘍致狹窄,最終行外科手術治療,術后病理示十二指腸降部大量IgG4陽性漿細胞浸潤;1例患者病變累及十二指腸乳頭,局部活檢病理示大量淋巴細胞和IgG4陽性漿細胞浸潤。
討 論
AIP是有著特殊組織病理學表現的胰腺慢性炎癥,常伴有IgG4水平升高,激素治療有效;病理學上可分為淋巴漿細胞硬化性胰腺炎(IgG4相關性胰腺炎,Ⅰ型)和特發性導管中心性胰腺炎(Ⅱ型)兩種類型。全球范圍內以Ⅰ型AIP為主,我國亦以Ⅰ型多見,約占全部AIP病例的95%[6]。Ⅰ型病例還可累及膽管、腎臟、肺、唾液腺等胰腺外器官,以膽管受累最為常見(60%~74%)[7],即IgG4-SC,受累部位可見IgG4陽性漿細胞浸潤[5]。
Ⅰ型AIP多發生于中老年男性,平均發病年齡約為60歲[3],起病隱匿,臨床表現多樣,包括胰腺和胰腺外表現。多數患者出現梗阻性黃疸,多為輕中度,也可為重度,病情可呈進行性或間歇性。此外,患者可有非特異性的輕度上腹痛或不適,甚至可類似急性胰腺炎,疼痛向背部放射。其他癥狀包括乏力、納差、體質量減輕以及糖尿病、腹瀉等胰腺內、外分泌功能不全表現。本組25例AIP患者最終診斷均為Ⅰ型,平均年齡 63.5歲,男女比例5.25∶1;主要臨床表現為梗阻性黃疸和上腹痛,1例患者伴自身免疫性腎炎。流行病學、癥狀和體征以及胰腺外累及情況均與既往報道一致。
血清IgG4檢測廣泛應用于AIP和其他IgG4相關疾病的早期診斷和鑒別診斷,但關于其在療效監測以及復發和預后預測中的價值證據尚不充分,治療前和治療后高血清IgG4水平可能是AIP復發的危險因素[8]。血清IgG4>2×ULN診斷AIP的敏感性、特異性和陽性預測值分別為53%、99%和75%,包括胰腺癌在內的非AIP患者可有10%出現輕度IgG4水平升高(<2×ULN)[9],IgG4水平正常亦不能排除AIP。本研究中21例行血清IgG4檢測者中19例IgG4>2×ULN,敏感性達90.5%。
AIP的影像學特點是胰腺增大和主胰管不規則狹窄,且常因伴發IgG4-SC而存在膽管狹窄。雖然ERCP能明確膽胰管狹窄,聯合細胞刷檢可排除膽管癌,但刷檢陽性率低,難以鑒別AIP與膽管癌所致的膽管狹窄以及胰腺癌所致的胰管狹窄,且ERCP因有術后胰腺炎風險而較少單純用于診斷AIP,尤其是在患者有典型“胰腺增大”表現且IgG4升高時[10]。本組行ERCP者均為因合并黃疸行膽總管支架置入,造影可見膽總管下段不同程度的狹窄。
EUS在AIP的診斷中起重要作用,可有效明確胰腺回聲、大小和膽管壁厚度。AIP在EUS中的表現通常為均勻低回聲改變,本組AIP患者亦以低回聲改變為主,且回聲較均勻,但有1例患者胰腺實質見片狀高回聲,與Okabe等[11]報道的AIP可表現為類似早期慢性胰腺炎的高回聲改變相一致,考慮可能與不同研究納入的病例疾病處于不同階段有關。2011年國際胰腺病學會國際共識診斷標準推薦通過EUS-FNA獲取AIP的組織病理學診斷[5],可使用19G或22G穿刺針,診斷率可達80%~100%[12],本研究EUS-FNA的病理診斷率為83.3%。19G穿刺針更易獲得充足的組織學標本,但潛在出血風險也相應增加。較之FNA,細針穿刺活檢(fine-needle biopsy, FNB)可獲得更多組織條,因而更易獲得1級組織學診斷(至少滿足3條組織學標準)[13]。對于部分無法獲取胰腺組織的患者,可于內鏡下行十二指腸壺腹部或降部黏膜組織活檢,發現IgG4陽性漿細胞可支持AIP的診斷。本組2例患者病變分別累及十二指腸乳頭和降部,局部活檢病理和術后病理發現大量IgG4陽性漿細胞浸潤。
本研究中1例AIP患者在隨訪2年后發現胰腺癌并死亡。Ishikawa等[14]報道,123例Ⅰ型AIP患者中位隨訪期為55個月,2例(1.6%)患者在確診后17和22個月診斷為胰腺癌,表明AIP有合并癌變的可能。此外,亦不能排除患者在確診AIP時已存在微小胰腺癌病變的可能。胰腺癌患者血清IgG4水平也可上升,并在激素治療后下降,因此,即使胰腺穿刺活檢病理發現IgG4陽性漿細胞,且患者對激素治療有反應,也不能完全排除合并胰腺癌的可能,需慎重診斷并密切隨訪監測。
AIP患者通常使用激素治療,但最終是否給予激素治療取決于患者的臨床表現,對于大部分無癥狀患者可采取“等待觀察”策略[5],部分患者可不予任何干預而自行緩解。激素治療后應結合臨床和影像學表現評估療效,多數患者的各項指標可在2周內明顯改善。由于AIP患者一般年齡偏大,且激素治療易引起血糖升高、骨質疏松、感染加重等,患者在無明顯癥狀時往往會拒絕接受激素治療,而是在出現IgG4-SC合并黃疸時接受治療[15]。本研究中14例IgG4-SC合并黃疸患者中9例接受激素治療,而11例肝功能正常者中僅4例接受激素治療。對于AIP合并梗阻性黃疸患者是否需接受膽管引流治療目前仍不明確。既往常在給予激素治療前行經內鏡或經皮膽管引流,日本2013年AIP共識指出,合并黃疸的AIP患者在開始激素治療前可先行膽管引流[4]。但后續有研究發現,部分患者無需置入膽管支架,單純使用激素即可緩解黃疸[3,16]。2016年國際胰腺病學會AIP治療共識指出,對于無感染跡象的輕癥黃疸患者,激素單藥治療安全有效,無需留置膽管支架[8],但相關研究樣本量較小或為回顧性研究,仍需開展更多臨床研究以進一步明確。本組14例IgG4-SC合并黃疸患者中6例單純使用激素治療,與置入膽管支架(聯合或不聯合激素)治療者相比,兩組治療前肝功能無明顯差異,治療后無其他嚴重合并癥者肝功能均恢復正常。綜上,單純激素治療用于AIP合并輕中度黃疸患者安全、有效,且可改善膽管壁增厚所致的狹窄。如患者已進入病程晚期,則可能因膽管慢性纖維化而導致對激素治療反應降低,但尚未觀察到因激素療效欠佳而需接受長期支架置入或外引流治療的患者[16]。
綜上所述,AIP是一種少見的特殊類型的慢性胰腺炎,老年男性患者常見,診治較為復雜。我國AIP以Ⅰ型為主,與IgG4密切相關,IgG4在AIP的診斷中參考意義較大,通過EUS-FNA獲取組織標本能有效確診AIP。激素治療可有效緩解病變累及膽管者的IgG4-SC合并黃疸,無需額外的膽管支架置入。此外,AIP診治過程中應排除胰腺癌并注意存在病程后期并發胰腺癌的風險。

