下丘腦腹內側核腹外側區激活惡化心肌梗死后的心臟功能
劉子韓 劉志豪 周雨揚 許驍 李澤衍 周麗平 江洪
(武漢大學人民醫院心內科 武漢大學心臟自主神經研究中心 武漢大學心血管病研究所 心血管病湖北省重點實驗室,湖北 武漢 430060)
心血管疾病是目前最常見的疾病及死亡因素之一[1],而社會壓力引起的長期情緒應激在增加心血管疾病患病風險和影響疾病預后中起著重要作用[2]。目前已有大量臨床研究表明,長期的抑郁情緒會通過改變機體神經免疫功能從而加重心臟功能障礙及促進心肌重構[3],而良好地緩解壓力可很好地促進患者心肌梗死后心肌損傷修復及改善預后[4]。在這種壓力下,大腦中主要激活的情緒核團包括下丘腦、杏仁核和孤束核等[5]。下丘腦腹內側核(ventromedial hypothalamus,VMH)是大腦中調控進食、能量代謝和情緒的關鍵腦區[6-8]。下丘腦腹內側核腹外側區(ventrolateral part of ventromedial hypothalamus,VMHVL)是VMH中主要介導攻擊行為和憤怒情緒的關鍵核團亞區,VMHVL活性的升高可直接誘導大鼠產生攻擊行為與憤怒情緒,而抑制其活性可降低大鼠的活動性[9]。目前關于情緒應激行為對心臟影響的動物和臨床研究已有大量報道,但較少關注情緒核團與心臟的關系,而研究這種關系最直接的方法就是特異性激活特定核團來觀察其對心臟的影響。本研究通過化學遺傳技術精準激活憤怒情緒相關核團VMHVL,利用腦立體定位技術將激活型的化學遺傳病毒[rAAV-hSyn-hM3D(Gq)-EGFP-WPRE-pA]精準表達在VMHVL腦區中,并于腹腔注射氯氮平一氧化氮(clozapine N-oxide,CNO)激活神經元上表達的hM3D(Gq)受體從而激活VMHVL,連續干預14 d后檢測其對心肌梗死后心臟結構和功能的影響。
1 材料與方法
1.1 實驗動物準備
本實驗經武漢大學動物實驗倫理委員會審核并批準。10只健康成年SD大鼠(體重200~250 g)由武漢大學實驗動物中心提供,將10只大鼠隨機分為激活組(n=5)和對照組(n=5)。在SPF環境分籠進行適應性飼養1周,每日給予充足標準飼料和水。實驗前大鼠禁食禁飲12 h,在實驗過程中保持環境安靜,室溫保持在(22±2)℃。
1.2 VMHVL腦立體定位注射
用2%戊巴比妥鈉(40 mg/kg)腹腔注射麻醉大鼠,將頭部剃毛并固定。碘伏消毒后切開頭皮,用過氧化氫去除腦膜并暴露顱骨人字縫和矢狀縫。定位針端以前囟為定位原點(X=0 mm,Y=0 mm,Z=0 mm),查閱圖譜可得VMHVL核團中心坐標為(X=0.8 mm,Y=-2.76 mm,Z=9.8 mm)。根據VMHVL定位在右側顱骨鉆孔,并將吸取病毒的微量注射針針尖調整至VMHVL所在坐標處。在激活組右側VMHVL以10 nL/min緩慢注射rAAV-hSyn-hM3D(Gq)-EGFP-WPRE-pA;AAV2/9(2.0×1012viral particles/mL,200 nL,樞密科技,中國武漢)。在對照組相同位置注射等量rAAV-hSyn-EGFP-WPRE-pA;AAV2/9。注射完畢停留10 min后緩慢退出微量注射針,完成定位注射。傷口縫合后將大鼠繼續飼養3周,保證病毒高度表達。
1.3 心肌梗死模型構建
病毒注射3周后,將激活組與對照組的大鼠用戊巴比妥鈉麻醉,仰臥位固定于實驗臺上,連接至小動物呼吸機并給予正壓通氣。經左前胸剃毛、消毒后打開胸腔,暴露心臟。打開心包,暴露左心耳,肉眼可見左心耳下方有一往下走行的左冠狀動脈前降支,結扎后可見結扎部位以下心肌明顯缺血。關胸后密切關注生命體征,等待大鼠清醒。
1.4 超聲心動圖測量
心肌梗死造模后,激活組與對照組均連續14 d腹腔注射CNO[3 mg/kg,2 mL/(次·d)]。14 d后將大鼠麻醉后仰臥固定于實驗臺,左前胸剃毛,測定心臟二維超聲心動圖,分別測量左室射血分數(LVEF)、左室短軸縮短率(LVFS)、左室舒張末期內徑(LVEDd)、左室收縮末期內徑(LVESd)、左室舒張末期容積(LVEDV)和左室收縮末期容積(LVESV)。
1.5 VMHVL核團激活、血清去甲腎上腺素及免疫熒光檢測
處死大鼠之前,打開腹腔并從下腔靜脈收集外周血,以3 000 r/min離心15 min并提取血清,儲存于-80 ℃環境下,之后采用ELISA試劑盒進行血清去甲腎上腺素(norepinephrine,NE)含量測定,檢測步驟根據試劑盒說明書操作。處死大鼠后,將腦組織完全取下,浸泡在多聚甲醛中保存,脫水后在VMHVL腦區取5 μm冰凍切片進行熒光分析。增強綠色熒光蛋白(enhanced green fluorescent protein,EGFP)為自發免疫熒光,直接在熒光顯微鏡下觀察。使用C-FOS抗體(Abcam,英國劍橋)和兔抗二抗對腦區C-FOS進行免疫熒光染色并在熒光顯微鏡下觀察。全程操作注意避光。
1.6 統計學分析
本實驗所有數據均以平均數±標準差表示。采用GraphPad Prism 8.0系統進行統計學分析與作圖。先對所有計量數據進行Kolmogorov-Smirnov檢驗以明確是否符合正態分布,再采用獨立樣本t檢驗進行組間比較,將P<0.05定義為差異具有顯著性。
2 結果
2.1 兩組干預對VMHVL神經元活性的影響
激活組和對照組SD大鼠在接受VMHVL化學遺傳病毒注射3周后,發現VMHVL處有大量綠色熒光蛋白表達,見圖1A。兩組均腹腔注射CNO后,激活組VMHVL神經元活性顯著高于對照組(標準化C-FOS計數,激活組vs對照組:1.40±0.08 vs 1.00±0.09,P<0.01),見圖1B和圖1C。
2.2 VMHVL激活對外周交感神經活性的影響
激活組和對照組SD大鼠接受CNO注射2周后,取外周血清檢測NE活性。發現激活組大鼠血清中的NE相較于對照組,NE的濃度被VMHVL的化學遺傳激活效應升高[激活組vs對照組:(4 372.26±221.10) pg/mL vs (2 018.47±466.89) pg/mL,P<0.001]。見圖1D。
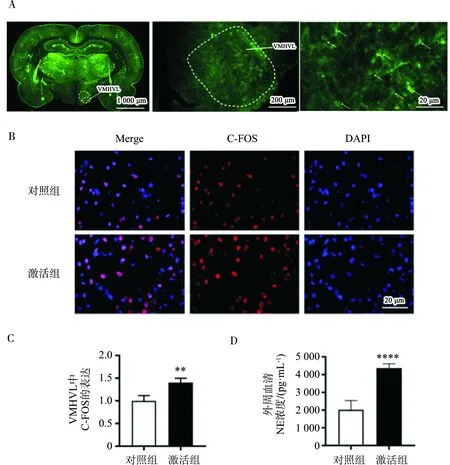
注:圖A左一(1 000 μm):該視野下轉染了化學遺傳病毒的VMHVL層面全腦腦片EGFP熒光圖,白色虛線區域為VMH,白色箭頭所指部位為VMHVL;圖A左二(200 μm):該視野下轉染了化學遺傳病毒的右側下丘腦局部EGFP熒光圖,白色虛線區域為VMHVL;圖A左三(20 μm):該視野下轉染了化學遺傳病毒的VMHVL局部EGFP熒光圖,白色箭頭所指為轉染腺病毒后表達的EGFP的神經細胞;圖B(20 μm):兩組大鼠VMHVL中C-FOS表達;圖C:兩組C-FOS陽性細胞標準化計數,**:P<0.01;圖D:兩組外周血清中NE濃度(pg/mL),****:P<0.001。Merge:熒光圖疊加C-FOS+DAPI;DAPI:4’,6-二瞇基-2-苯基吲哚。圖1 VMHVL中化學遺傳病毒轉染、神經元激活情況以及外周循環交感神經激活情況
2.3 VMHVL激活對心肌梗死后心臟結構和功能的影響
心肌梗死后兩周,測定大鼠二維超聲心動圖,見圖2A。超聲心動圖顯示,激活組大鼠對比對照組大鼠,LVEF明顯降低[(63.60±2.12)% vs (44.90±6.39)%,P<0.005],LVFS明顯降低[(29.39±3.36)% vs (19.62±3.27)%,P<0.01]。LVEDd顯著增寬[(8.36±0.55) mm vs (6.54±0.54)mm,P<0.01],LVESd也顯著增寬[(6.74±0.50) mm vs (4.38±0.48) mm,P<0.005]。此外,LVEDV明顯增加[(1.28±0.21) mL vs (0.65±0.15) mL,P<0.001],LVESV也明顯增加[(0.70±0.15) mL vs (0.22±0.08) mL,P<0.001]。見圖2B。
3 討論
下丘腦是大腦皮層下植物神經的最高中樞,可調節包括心臟在內的許多內臟的生理活動。有研究表明,下丘腦可從經典的情緒相關核團,例如杏仁核和海馬中,接受神經纖維的投射,并已被證明其在復雜的情緒調節中起重要作用[10-11]。在情緒應激的環境下,下丘腦-垂體-腎上腺軸(HPA軸)被認為是導致循環糖皮質激素升高和自主神經活動增加的主要神經生物學機制,并在心血管應激反應中起重要作用[12]。下丘腦中主要的與情緒相關的子核團包括下丘腦腹內側[11]、弓狀核[13]和下丘腦背內側核[14]。VMH是大腦中涉及情緒網絡的一個相關腦區,且有研究表明VMH活性的改變在調節機體的血壓和心率上有一定的作用[15],VMH活性變化也與機體自主神經系統的活性改變密切相關。研究表明,電刺激VMH會增加外周交感神經活性,而直接損毀VMH則會增加外周副交感神經活性[12]。Lin等[9]用光遺傳學和化學遺傳學的方法,通過改變核團活性來改變小鼠的行為,從而證實位于VMH內的子核團VMHVL是介導攻擊行為和憤怒情緒的關鍵核團。由此可見,中樞情緒核團的激活與外周自主神經系統活性是密切相關的。
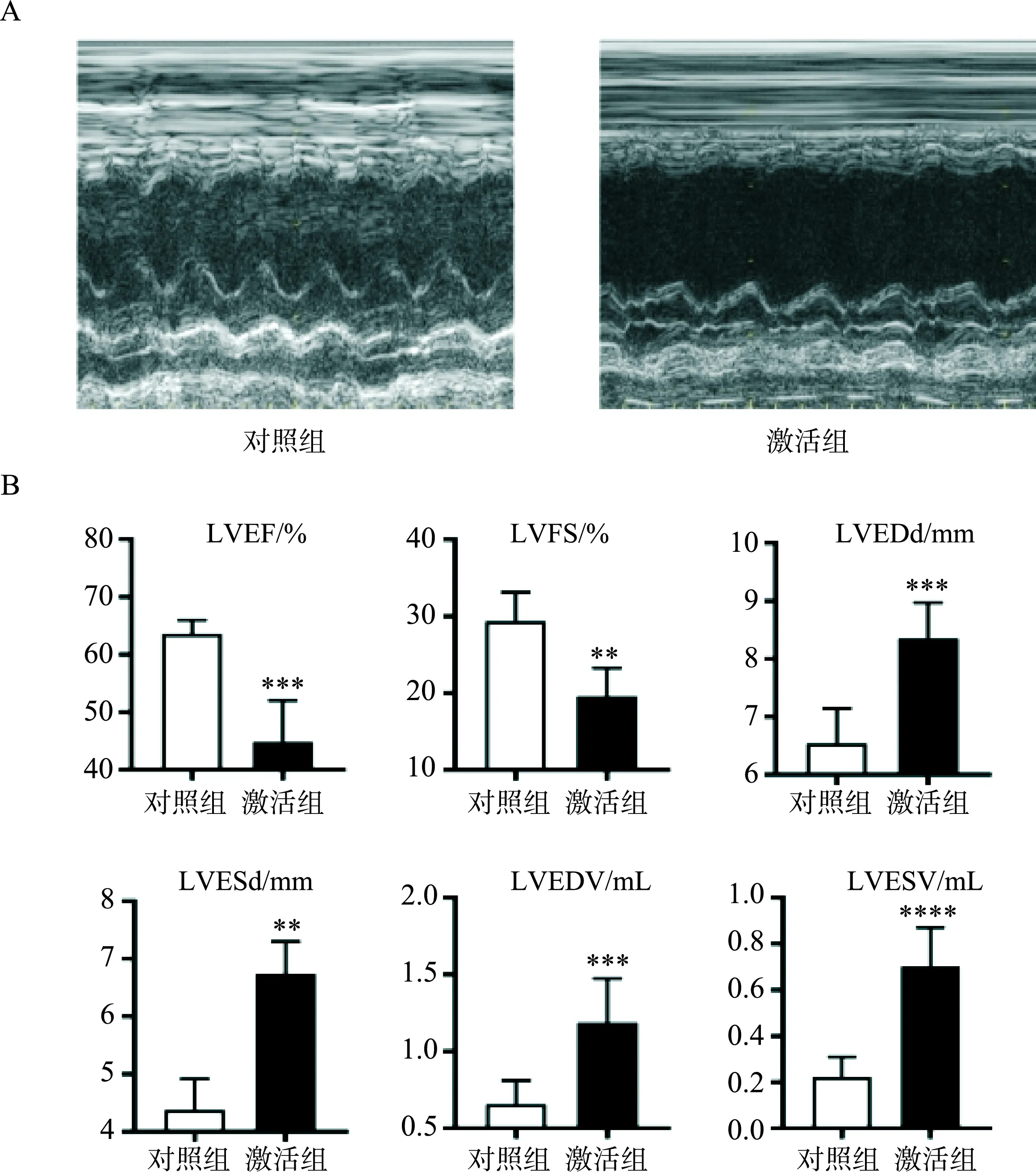
注:圖A為兩組大鼠二維超聲心動圖對比;圖B為經二維超聲心動圖檢查所得各項心臟指標。***表示P<0.005,**表示P<0.01,****表示P<0.001。圖2 VMHVL激活對心肌梗死后心臟結構和功能的影響
在此基礎上,本研究采用化學遺傳方法中僅由定制藥物激活的定制受體(designer receptors exclusively activated by designer drugs,DREADDs)來特異性激活VMHVL。DREADDs可通過惰性藥物(如小分子)激活,以對細胞信號傳導、神經元活動和行為進行長時程的調控[16-17]。通過定向分子轉化的過程,創建人突變型毒蕈堿型乙酰膽堿受體(M1、M2、M3、M4和M5型),該類受體對內源性配體乙酰膽堿無效,卻能被CNO激活[10]。選取激活型受體hM3D(Gq),其激活將觸發細胞膜Ca2+的內流產生膜電位,從而誘發神經元產生神經沖動,該效應會持續至結合的CNO被機體完全代謝消除。目前評價DREADD效應的指標主要有四種(前兩種為最常用的方法):(1)急性離體腦切片電生理學檢測[18];(2)神經元活性相關的蛋白C-FOS含量[19];(3)在體多通道微電極陣列神經信號技術檢測神經元活性;(4)基于鈣成像技術的神經元活性檢測[20]。本研究選擇C-FOS熒光染色作為判斷神經元激活的指標[21]。此外,腺病毒通常用作目的基因傳遞載體,用來在目標神經元中實現目標受體的高水平表達[16]。目前化學遺傳技術已廣泛應用于神經科學領域,并成為鑒定神經回路結構和功能的重要工具,用以特異性激活或抑制特定的中樞腦區[22]。在本研究中,利用化學遺傳技術成功將hM3D(Gq)受體表達在VMHVL神經元上,并通過腹腔注射CNO,激活VMHVL神經元細胞膜上的hM3D(Gq)受體。有實驗熒光結果顯示,激活組VMHVL較對照組有更多的C-FOS表達,提示VMHVL神經元被成功激活。
在外周,自主神經系統在心血管功能的調節上發揮重要作用。生理狀態下,機體交感神經與副交感神經的活性處于動態平衡,而絕大部分心臟疾病的發生和發展都與交感神經的過度激活有關[23]。從大腦皮層到脊髓的各級神經系統,也分布著調節心臟活動的中樞。在大腦中,下丘腦室旁核(paraventricular nucleus,PVN)已被證明是整個交感神經活性和調節心血管功能的中心環節,而PVN功能的激活可增加心臟交感神經活性并加重心臟功能障礙和結構重構[24]。最近的研究表明,PVN與VMHVL之間存在神經纖維的雙向投射,即二者之間存在結構與功能的連接[25]。在本研究中,成功激活心肌梗死后大鼠的VMHVL兩周,超聲結果發現大鼠心臟功能在VMHVL激活后明顯惡化,結構改變也較對照組明顯。這提示,VMHVL的激活可能會通過激活PVN,提高機體的交感神經活性,打破交感神經與副交感神經的動態平衡,從而影響外周心臟的功能障礙和結構改變。值得一提的是,VMHVL與心臟之間相互影響的自主神經通路需進一步的研究和探索。血清NE的結果提示,化學遺傳激活VMHVL神經元確實引起外周交感神經指標的升高,提示一定程度的交感神經激活作用。
由此可見,機體的情緒應激對心肌梗死后心臟功能變化有著重要影響。本研究將中樞情緒腦區與外周器官的功能變化相聯系,通過干預核團活性從而對外周心血管系統的功能和結構進行調控,而實驗結果也提示VMHVL介導的慢性情緒應激可惡化心肌梗死后心臟功能。未來需進一步研究VMHVL情緒核團激活影響心臟的具體神經通路,并探索其潛在的分子機制,可在臨床上為心肌梗死患者精準調控情緒,進一步改善心肌梗死后心功能的恢復,提供新思路和新的治療方案,也為心血管疾病高風險及情緒易激動的患者提供新穎的心血管疾病預防策略。

