NLR預測TIA頸動脈斑塊穩定性的可行性研究
吳后祎,馬領松
(皖南醫學院弋磯山醫院神經內科,安徽 蕪湖 241000)
短暫性腦缺血發作(transient ischemic attack,TIA)是具有腦梗死癥狀的臨床急癥,持續時間短暫,不超過24 h,大部分持續時間小于1 h,且不存在責任病灶[1]。TIA發病機制目前尚未明確,與動脈粥樣硬化、心臟病、血液成分改變及血流動力學變化等多種病因有關。其中,頸動脈粥樣硬化在TIA發生發展中所起的作用被大多數學者認可。在頸動脈斑塊的形成過程中,慢性炎癥反應所起的作用至關重要,包括刺激粥樣斑塊形成、進展及增加斑塊的易損性[2-3]。中性粒細胞與淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)作為一種快速易得的炎癥狀態評估指標,近年來作為心腦血管疾病的一個新的預測指標在臨床上得到應用。有相關報道指出頸動脈斑塊的TIA患者NLR數值偏高[4]。因此探究TIA患者頸部動脈斑塊穩定性與NLR之間是否存在關聯,并將其作為預測指標存在深遠意義。
1 資料與方法
1.1 研究對象 收集77例于2018年1月—2019年1月在皖南醫學院弋磯山醫院就診的TIA合并頸動脈粥樣斑塊患者,包括男性46例,女性31例,年齡50~80歲,平均(62.60±8.52)歲。所有患者中有51例患者合并高血壓,16例患者合并糖尿病。根據頸部超聲結果,分為斑塊不穩定組(45例)和斑塊穩定組(32例)。
1.2 研究方法
1.2.1 納入標準 ①首次發病,診斷符合TIA相關專家共識[5],頭顱CT或頭顱MRI證實無出血及急性梗死;②頸動脈超聲提示有斑塊存在。排除標準:①既往無腦血管疾病;②頭顱影像學資料提示有出血或急性梗死;③嚴重全身感染、心房顫動、癲癇的部分性發作、嚴重肝腎功能不全、嚴重心臟疾患、惡性腫瘤患者;④資料不全者。
1.2.2 方法 收集并錄入所有研究對象的一般資料,包括性別、年齡、相關疾病史(高血壓病、糖尿病)等。入院第二日凌晨禁食禁水狀態下,采外周靜脈血進行血常規及血生化檢測,獲取全部研究對象的白細胞(WBC)、血小板(PLT)、中性粒細胞(NEUT)、淋巴細胞(LYM)、空腹血糖(GLU)、尿酸(UA)及血脂參數[甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)]等。血常規采用邁瑞BC-6900血液分析儀進行檢測,血脂血糖生化系列結果采用日立7600生化分析儀進行檢測。
1.2.3 頸動脈超聲檢查 由2名有經驗的超聲科醫師,采用飛利浦epicc7C型彩色多普勒超聲檢測儀對患者進行頸部血管檢查,檢測觀察患者頸部動脈斑塊的有無和斑塊穩定性情況。判定標準:當患者的頸動脈內中膜厚度(IMT)≥1.3 mm,且向管腔內隆起時,即判定為動脈粥樣硬化斑塊形成。依據斑塊性質判定標準,將斑塊分為穩定及不穩定斑塊[6],若穩定斑塊和不穩定斑塊同時存在,也視為不穩定斑塊。
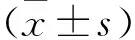
2 結果
2.1 一般資料及血檢結果分析 77例合并頸動脈斑塊的TIA患者中,斑塊不穩定患者45例(58.44%),其中男性30例,女性15例,斑塊穩定患者32例(41.56%),其中男性16例,女性16例。通過對兩組年齡、高血壓病史、NLR等指標進行統計學分析,結果示斑塊不穩定組的NLR中位數及四分位間距明顯高于斑塊穩定組,即3.0(2.19~3.56)>2.0(1.54~2.61),差異有統計學意義(P<0.001),斑塊不穩定組的高血壓患病率高于斑塊穩定組(77.78%>50.00%),差異有統計學意義(P<0.05)。兩組間年齡、性別、白細胞計數、甘油三酯等指標差異無統計學意義(P>0.05),見表1、圖1。

表1 兩組各項指標比較

注:*表示兩組間差異有統計學意義。
2.2 Logistic回歸分析及受試者工作曲線(ROC) 多因素回歸方程結果示,NLR和高血壓病史是影響TIA患者頸部斑塊穩定性的獨立危險因素,P<0.05,見表2。受試者ROC曲線NLR曲線下面積AUC=0.744,取閾值為2.740時,敏感度及特異性分別為57.82%、87.54%,二元Logistic回歸方程結果顯示是否患有高血壓與NLR為頸動脈斑塊穩定性的獨立危險因素(見表2),其預測模型為:Logit(P)=-1.719+ NLR×0.973+是否患有高血壓×(-1.115),Logit(P)的ROC曲線下面積為0.777,取閾值為0.637時,敏感度及特異性分別為64.39%、81.19%。見圖2。

表2 Logistic 回歸分析

注:以Logit(P)模型診斷效能最佳。
3 討論
顱內血管急性堵塞時會引起局部腦組織的血流急劇減少,每100 g腦組織每分鐘血流<20 ml就會引起腦缺血,在腦細胞死亡前,如果供應腦組織的血流得到恢復,那么患者僅會有短暫的神經功能障礙,臨床上稱其為TIA。TIA是缺血性腦卒中的獨立危險因素,TIA后發生缺血性腦卒中的概率極大,未經治療的TIA患者發生腦卒中風險在90 d內達20%,大部分在最初的10 d內發生[7]。有學者指出,TIA的發生與頸動脈斑塊發生發展顯著相關[8]。當部分TIA患者頸動脈斑塊碎裂形成微栓子,隨血流堵塞遠端血管發生腦梗死,嚴重威脅人們的健康。慢性炎癥反應和高血壓在動脈斑塊粥樣硬化斑塊的形成發展中起著重要作用。NLR作為一種臨床上快速廉價的反應炎癥的血液指標,目前尚未有NLR與TIA患者頸動脈斑塊穩定性的相關研究。本研究旨在探討NLR對TIA患者頸動脈斑塊穩定性的預測價值,進而降低腦卒中的發生風險。
本研究結果顯示頸動脈不穩定斑塊組的NLR 顯著高于頸動脈穩定斑塊組。多因素回歸分析示,NLR和高血壓病史是影響TIA患者頸動脈斑塊穩定性的獨立危險因素。因此,可以用NLR對TIA患者頸動脈斑塊的穩定性進行預估,并根據NLR水平的高低對相應的患者進行提前干預及治療。另外本研究結果表明,既往患有高血壓也會影響TIA患者頸動脈斑塊的穩定性,可能與高血壓影響血管內皮的形態、結構和功能有關,血壓變化同樣需要引起患者和臨床醫師的關注。隨著各項研究的展開,動脈粥樣硬化斑塊的形成發展與慢性炎癥反應的關系逐漸被學者發現,并發現多種炎癥細胞和炎癥因子[9-10]。NLR作為一種簡單易得的評估炎癥水平的指標,能夠較好地反映機體免疫炎癥狀態。現已廣泛用于評估心腦血管疾病的轉歸和預后,對疾病的協助診斷具有重要意義。Tamhane U等[11]研究指出,炎癥細胞參與動脈粥樣硬化的形成發展,其中性粒細胞會分泌各種炎癥介質、蛋白水解酶和活性氧自由基,促進組織損傷的炎癥反應的發生,此外,淋巴細胞的改變,使得抗炎細胞因子分泌物減少[12],如此一來,中性粒細胞與淋巴細胞之間的平衡狀態被打破,炎癥反應加重,繼而斑塊的形成速度加快。NLR增高表明炎癥增加,動脈粥樣硬化風險相應地增加,那么NLR可以作為頸動脈粥樣硬化斑塊存在發展的有力預測因子[13]。同時,中性粒細胞還會影響斑塊的穩定性及易損性,Ionita MG等[14]研究發現,對于動脈粥樣硬化斑塊而言,其穩定性能夠被中性粒細胞這一炎癥激活因子所破壞,存在越多中性粒細胞的斑塊,其穩定性越差,就越易于碎裂形成栓子。這與Yükseli ?等[15]的結論也基本相符。
綜上所述,本研究揭示了NLR能夠對TIA患者頸動脈斑塊穩定性進行預測,即NLR越高,斑塊的穩定性就越差。NLR檢測在臨床上的獲得容易、快速、廉價,或許可以作為一種評估TIA患者頸動脈斑塊穩定性的輔助手段,為患者的臨床治療方案提供一定的參考依據,在一定程度上減少急性腦梗死的發生。本研究存在不足之處:①本研究屬于單中心回顧性研究,未對本研究患者有無發生急性腦梗死進行隨訪調查;②未對有高血壓及糖尿病患者的藥物使用情況進行統計分析,血壓血糖控制藥物可能會對結果造成影響;③僅僅對NLR值作了定性分析,未給出具體的臨界值,仍需更多的資料進一步研究。

