IRE1對重癥急性胰腺炎大鼠淋巴細胞凋亡的作用研究
宋嗣恩,覃月秋,黃贊松,周喜漢
(1. 右江民族醫學院研究生學院,廣西 百色 533000;2.右江民族醫學院附屬醫院消化內科,廣西 百色 533000)
重癥急性胰腺炎(severe acute pancreatitis,SAP)是消化內科常見的急危重癥,約占急性胰腺炎(acute pancreatitis,AP)20%,該病起病兇險、并發癥多、治療費用高、預后差、病死率高[1-2]。臨床上SAP的早期表現為全身炎癥反應綜合征(systemic inflammatory response syndrome,SIRS),晚期常因繼發感染導致多器官功能障礙(multiple organ dysfunction,MODS)。有研究發現淋巴細胞凋亡異常導致機體免疫失衡是SAP患者繼發感染及膿毒癥的重要原因[3],但其分子機制尚不清楚。最近研究發現肌醇需求酶1(inositol requiring enzyme 1,IRE1)參與了細胞凋亡的調節[4],而IRE1是否參與SAP淋巴細胞凋亡的調節文獻報道較少。為明確IRE1在大鼠SAP淋巴細胞凋亡中的作用,本研究應用逆行胰膽管注射牛磺膽酸鈉誘導SD大鼠SAP動物模型,RT-qPCR檢測脾臟淋巴細胞IRE1 mRNA、Caspase-3 mRNA的表達情況,流式細胞術檢測淋巴細胞凋亡,初步探討IRE1對SAP大鼠脾淋巴細胞凋亡的作用,為闡明SAP機體免疫失衡機制,尋找干預和治療SAP新靶點,提供可靠的理論依據。
1 材料與方法
1.1 材料 20只體重控制在250~300 g的成年SD大鼠,牛磺膽酸鈉(美國Sigma);大鼠淀粉酶和脂肪酶測定試劑盒(北京冬歌博業生物科技有限公司) ;總RNA提取試劑盒(上海閃晶分子生物科技有限公司);Fastking RT Kit(上海閃晶分子生物科技有限公司); SYBR Green(上海閃晶分子生物科技有限公司);PCR引物IRE1、 Caspase-3合成(上海捷倍思基因技術有限公司);Anti- IRE1抗體、Anti-Caspase-3抗體(默克生命科學);紫外分光光度計;羅氏LightCycler96實時熒光定量PCR儀。
1.2 方法
1.2.1 動物分組 采用隨機數字表法將20只大鼠隨機分為假手術組(SO組)、SAP組,每組10只。SO組大鼠僅開腹翻動胰腺后關腹,SAP組大鼠在胰膽管逆行注射5%牛磺膽酸鈉0.1 ml/100 g構建SAP模型[5]。
1.2.2 胰腺組織病理學及評分 按照Schmidt評分細則及方法[6],胰腺組織石蠟包埋,超薄切片機切成4微米/片,HE染色后,采用雙盲法,轉顯微鏡下由兩名病理醫生進行閱片評分,隨機選取5個400×視野/片,進行觀察以下4種病理狀態:①水腫(edema);②出血(hemorrhage);③壞死(necrosis);④炎癥浸潤(inflammatory infiltration),這4種病理狀態作為病理損傷嚴重程度評分的參考依據,逐一進行評分,并做好記錄。
1.2.3 淀粉酶和脂肪酶檢測方法 按照大鼠淀粉酶和脂肪酶檢測試劑盒說明書進行檢測。
1.2.4 脾臟淋巴細胞分離 研磨脾臟組織,制備脾臟組織單細胞懸液,加1×PBS或1640無血清培養液3 ml按照1∶1 比例稀釋;混勻,37℃水浴中平衡,吸取脾臟組織單細胞懸液至淋巴細胞分離液液面上,置于20℃,2000 r/min水平離心機離心20 min,吸取乳白色淋巴細胞層,加入15 ml離心管中,然后加入細胞洗滌液10 ml,混勻細胞,離心10 min(轉速1500 r/min),倒掉上清液,重復操作本步驟一次。將重懸的細胞轉移到平皿中, 5%CO2培養箱中設定溫度37℃,進行培養60 min,待單核細胞貼壁后,收集所需的淋巴細胞懸液。
1.2.5 RT-qPCR檢測 IRE1 mRNA、Caspase-3 mRNA表達內參β-actin引物序列:F5′-GGGAATGGGTCAGAAGGACT-3′,R5′-CTTCTCCATGTCGTCCCAGT-3′。IRE1序列:F5′-GGACTGCCTGGGTCTTTGAT-3′,R5′-TGTGGGGTCAAACGCCTATT-3′。Caspase-3序列:F5′-CTAGCTCCTAGTCTCTGCTCCC-3′,R5′-TCCGTCCCCAATACGTGTCGAATGCA-3′。按照操作說明書,分別提取各組脾臟組織的總RNA,采用紫外分光光度計檢測OD260、OD280其濃度。抽取2 μg總RNA采用逆轉錄法合成cDNA,將其存入-80℃冰箱。采用SYBR Green擴增cDNA,并使用PCR儀檢測。以β-actin分析IRE1和Caspase-3的mRNA表達水平。每組設3個復孔進行對照,利用2-△△CT法計算IRE1及 Caspase-3的mRNA相對表達量。
1.2.6 流式細胞術檢測淋巴細胞凋亡 分離好的淋巴細胞懸液,采用低溫PBS重復洗滌細胞,細胞用1×Binding Buffer調為1×106/ml,吸取100 μl淋巴細胞懸液轉移至5 ml流式管中,各加入5 μl PI 和5 μl AnnexinV-FITC,緩慢混勻細胞懸液,孵育(條件為:室溫25℃,避光15 min),將400 μl 1×Binding Buffer加入每個流式管,上機檢測。
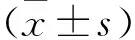
2 結果
2.1 大鼠胰腺病理評分 SO組胰腺腺泡結構清晰,無明顯水腫,偶有炎性細胞浸潤;SAP組胰腺腺泡高度水腫,出現腺泡結構的破壞,可見間質內的紅細胞滲出和出血、壞死,血管損傷或血栓形成, 間質水腫,間隔模糊變寬,炎癥反應明顯,可見脂肪壞死,導管擴張,腺泡細胞萎縮。按照Schmidt評分細則,SAP組與SO組比較,胰腺病理組織學評分顯著性增加,見表1。

表1 大鼠胰腺病理組織損傷評分
2.2 大鼠的血清淀粉酶和脂肪酶水平 SAP組中大鼠的血清淀粉酶和脂肪酶水平含量均顯著升高,與SO組相比,差異有統計學意義(P<0.001),見表2。

表2 大鼠的血清淀粉酶和脂肪酶水平含量 單位:U/L
2.3 大鼠脾臟淋巴細胞IRE1、Caspase-3 mRNA相對表達量 SO組大鼠脾臟淋巴細胞中IRE1 、Caspase-3 mRNA相對表達量呈低表達,SAP組大鼠中IRE1 mRNA相對表達量顯著升高,與SO組相比,差異有統計學意義(P<0.05),見圖1。


注:與SO組相比較,*:P<0.05。
2.4 流式細胞術檢測大鼠脾淋巴細胞凋亡情況 使用二維散點圖表示大鼠脾淋巴細胞凋亡率,以Annexin-V FITC為橫坐標,PI為縱坐標,以陰性對照、PI單染管和FITC單染管設定界限,把淋巴細胞分成:正常活細胞(左下象限Q4,Annexin-V FITC-、PI-);早期凋亡細胞(右下象限Q3,Annexin-V FITC+、PI-);死亡細胞(右上象限Q2,Annexin-V FITC+、PI+)。SAP組脾淋巴細胞凋亡率與SO組比較,脾淋巴細胞凋亡率升高(P<0.001),見表3、圖2。

表3 實驗大鼠脾血淋巴細胞凋亡率
2.5 SAP大鼠脾淋巴細胞中IRE1與Caspase-3 mRNA相對表達量相關分析 SAP組中脾臟淋巴細胞IRE1 mRNA與脾臟淋巴細胞Caspase-3 mRNA相對表達量呈正相關(r=0.884,P<0.05),提示脾臟淋巴細胞IRE1 mRNA表達增高,脾臟淋巴細胞Caspase-3 mRNA水平隨之上升,見圖3。
2.6 SAP大鼠脾淋巴細胞中IRE1 mRNA表達與凋亡率的相關分析 SAP組中脾臟淋巴細胞IRE1 mRNA與脾臟淋巴細胞凋亡率呈正相關(r=0.875,P<0.05),顯示脾淋巴細胞中IRE1表達的增高,脾臟淋巴細胞凋亡率升高,見圖4。
3 討論
SAP是由胰腺的局部炎癥引發嚴重的全身多器官損害的疾病,它主要以致命的MODS和SIRS為特征[7]。盡管臨床上大部分的SAP患者能夠得到及時診斷和必要的治療,但治療手段和方法的選擇仍然十分有限[8]。目前,SAP仍然是一個高發病率和死亡率的消化系統疾病,據統計僅在歐洲SAP患者死亡率甚至高達44%[9]。AP首先從無菌的局部炎癥開始,誘發SIRS,然后是代償性抗炎反應綜合征(compensatory anti-inflammatory response syndrome,CARS),有相關研究表明在SAP小鼠中SIRS和CARS可并行發展[10],最終導致機體免疫抑制。SAP初期始于胰腺組織的局部炎癥,可導致多種胰腺外器官功能障礙的發生,然而,潛在的機制仍不清楚[11]。研究表明淋巴細胞大量凋亡導致SAP患者淋巴細胞亞群減少,是影響機體產生免疫抑制的重要因素[5,12]。我們采用流式細胞術檢測SAP大鼠脾淋巴細胞凋亡率,結果發現SAP淋巴細胞凋亡率增高,與前人的研究結果一致[13-14],提示機體免疫功能受損。

SO組

SAP組

圖3 SAP大鼠脾淋巴細胞中IRE1與Caspase-3mRNA表達水平的相關性

圖4 SAP大鼠脾淋巴細胞中IRE1與凋亡率的相關性
內質網應激(endoplasmic reticulum stress,ERS)是新近研究發現的調控細胞凋亡的信號轉導通路[15]。細胞應激是AP等胰腺疾病發生的先決條件,當細胞受到刺激時,內質網發生紊亂,且堆積著大量的錯誤/未折疊蛋白質,引發未折疊蛋白反應(UPR)以保持內質網穩態。但持續性內質網應激可誘發炎癥,嚴重時可致細胞凋亡,且與AP的細胞凋亡存在顯著關系[16]。越來越多的證據表明ERS是損傷胰腺腺泡細胞的早期反應,是AP的發病機制之一[15]。
IRE1內質網應激信號途徑,是啟動的觸發UPR的最保守的途徑[17]。有文獻報道AP通過IRE1通路激活胰腺的ERS,IRE1、 XBP1 mRNA和蛋白水平顯著升高[4],而ERS可能通過胰腺腺泡細胞凋亡導致實質損傷[18]。IRE1α內切酶是ERS的關鍵調控因子,控制著腫瘤細胞的存活和凋亡。抑制IRE1α內切酶可導致剪接XBP1的減少,從而降低癌細胞的增殖,增加細胞的死亡[19]。通過抑制自適應的UPR反應信號通路,IRE1還激活內質網應激通路,促進細胞死亡和胰腺炎[20]。我們研究發現SAP大鼠脾淋巴細胞IRE1表達明顯升高,提示SAP時內質網IRE1途徑激活,IRE1可能參與SAP的發病,這與Jia G等[21]在其他動物身上的研究結論相符,但是否與淋巴細胞凋亡相關尚不明確,因此我們進一步檢測了脾淋巴細胞Caspase-3表達,并進行了相關研究。
為明確IRE1與SAP淋巴細胞凋亡的關系,我們做了IRE1與Caspase-3表達及淋巴細胞凋亡率相關性分析,結果顯示SAP組中脾臟淋巴細胞中IRE1 mRNA表達增高,同時脾臟淋巴細胞Caspase-3 mRNA水平及淋巴細胞凋亡率亦升高。進一步分析發現,脾臟淋巴細胞IRE1 mRNA表達水平與Caspase-3 mRNA表達水平呈正相關,IRE1 mRNA與淋巴細胞凋亡率呈正相關。綜合以上分析, IRE1高表達,有可能是在SAP中導致淋巴細胞凋亡增加的重要原因。淋巴細胞是一種重要的炎性細胞,其表達水平通常代表著炎癥水平的高低。在SO組中,淋巴細胞的比例低,凋亡水平低,正說明了SO組中淋巴細胞處于一個良性的循環中。相反,淋巴細胞在SAP組中的高表達與高凋亡,說明了淋巴細胞的生成與因抗炎所致的凋亡,處于一個高速的循環之中。由于淋巴細胞能分泌諸多炎性因子,炎性因子在SAP患者體內的蓄積,可導致“炎癥風暴”的產生,這是胰腺炎患者死亡最常見的原因之一[22-23]。因此通過調控IRE1的表達,干預淋巴細胞的凋亡,減少炎癥因子的釋放可能是SAP的一個新的治療思路。

