原發性閉角型青光眼脈絡膜厚度的變化
迪麗尼格爾·艾克拜爾,穆塔里甫
0引言
原發性閉角型青光眼(primary angle-closure glaucoma,PACG)是普遍存在于亞洲的一種青光眼類型,在我國尤為突出。全球超過四分之三(76.7%)的PACG患者在亞洲[1]。自1990/2015年,在我國PACG患者從322萬上升至714萬。2015年,我國一半以上的(54.42%)青光眼患者為PACG[2]。房角關閉的最初機制尚未被完全揭示。Sng等[3]證實眼前段解剖結構的變化僅能解釋三分之一的原發性急性房角關閉(acute primary angle-closure,APAC)。Quigley等[4-6]提出脈絡膜的膨脹在房角關閉中起著重要的作用。他們認為脈絡膜膨脹后向前推動晶狀體-虹膜隔,從而引起或加重了房角的關閉。然而,脈絡膜膨脹機制尚需進一步證實。隨著頻域光學相干斷層掃描增強技術(enhanced depth imaging optical coherence tomography, EDI-OCT)的產生,實現了脈絡膜高質量圖像的獲取,有利于觀測脈絡膜厚度(choroidal thickness, CT)[7-8]。本研究通過測量CT及眼軸長度(axial length,AL)、前房深度(anterior chamber depth, ACD)探討它們的相關性,探討原發性急性閉角型青光眼(acute primary angle-closure glaucoma,APACG)及原發性慢性閉角型青光眼(chronic primary angle-closure glaucoma,CPACG)與CT的相關性,為不同類型PACG患者CT的變化提供參考。
1對象和方法
1.1對象研究對象為本院2019-01/2020-05期間符合納入標準的PACG患者及正常對照組。納入標準:(1)患者年齡40~80歲。(2)包含APACG及CPACG。(3)屈光介質清晰。(4)通過EDI-OCT得到黃斑區圖像清晰,能夠準確測量CT。(5)患者均未接受任何抗青光眼治療。診斷標準:根據國際區域性流行病學眼科學會(International Society of Geographical and Epidemiological Ophthalmology,ISGEO)的分類系統將PACG分為:(1)可疑原發性房角關閉(primary angle-closure suspect,PACS):Goldmann房角鏡靜態下≥180°范圍內均無法見色素小梁網且眼壓低于21mmHg,無周邊部虹膜前黏連或視神經及視野的損害;(2)原發性房角關閉(primary angle-closure,PAC):指周邊虹膜黏連或眼壓升高(房角鏡靜態下房角關閉范圍>180°),但無視神經及視野損害;(3)PACG:原發性房角關閉伴視神經的損害。診斷為PACG的患者根據臨床發展規律與其病理發展過程相結合,分為APACG和CPACG。APACG患者有房角突然關閉且范圍較大、眼壓明顯升高等特點,CPACG患者的房角黏連由點到面的逐步發展,眼壓逐步上升等特點。APACG組、CPACG組分別與正常組進行比較。排除標準:(1)晶狀體脫位、葡萄膜炎、虹膜新生血管、外傷、腫瘤或任何晶狀體明顯混濁引起晶狀體膨脹而繼發青光眼;(2)糖尿病及原發性高血壓;(3)任何內眼手術;(4)無法行超聲生物顯微鏡及房角鏡檢查;(5)高度近視及高度遠視,等效球鏡度數大于-6D或+6D;(6)視網膜脫離或視網膜色素上皮層的脫離;(7)任何引起視網膜異常的疾病,如脈絡膜新生血管,無癥狀的視網膜色素上皮層脫離及近視引起的脈絡膜萎縮;(8)屈光介質混濁或低質量圖像從而無法準確測量CT。正常對照組納入標準:年齡40~80歲;Goldmann房角鏡靜態下房角開放,無視神經損害,除了輕度白內障外無其它眼病,無任何內眼手術病史;隨機納入正常對照組。本研究得到新疆醫科大學第一附屬醫院倫理委員會審核,同意進行臨床研究。所有研究對象知情并簽署知情同意書。
1.2方法首先,所有受試對象由一位經驗豐富的眼科醫師進行裂隙燈、眼壓、Goldman房角鏡、+78D間接眼底鏡(Ocular,Bellevue,WA,USA)檢查。納入眼行超聲生物顯微鏡(ultrasoundbiomicroscopy,UBM)、光學生物測量儀(IOL Master)、眼部B超、視野檢查。除此之外,使用全自動電腦驗光儀完成驗光。ACD是由UBM測得,AL由IOL Master獲取。ACD:為角膜內表面與晶狀體前表面的垂直距離。完成上述步驟后,由一位操作熟練的眼科技師完成EDI-OCT檢查。所有測量的數據由兩位醫師用雙盲法單獨測量后取平均值。CT:是由視網膜RPE層到外層高反射帶的距離,此高反射對應的是鞏膜。本研究測量的位點包括黃斑中心凹下、距黃斑中心凹2mm鼻側、顳側、上方、下方的CT,分別標記為黃斑中心凹下脈絡膜厚度(SFCT),鼻2mm(N 2mm)、顳2mm(T 2mm)、上2mm(S 2mm)、下2mm(I 2mm)。獲得的圖像在脈絡膜和鞏膜之間具有最佳可視化效果,稱為脈絡膜-鞏膜界面(choroidal sclera interface,CSI)。如果圖像沒有可清晰識別的CSI,則將拍攝其他圖像以產生最佳CSI。
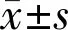
2結果
2.1三組受檢者人口統計學特征的比較三組性別和眼壓差異有統計學意義(P<0.05)。APACG組、CPACG組眼壓較正常組高且APACG組眼壓明顯高于CPACG組(P<0.001),見表1。

表1 三組受檢者人口統計學特征的比較
2.2三組眼前段生物學參數及黃斑區脈絡膜厚度的比較表2顯示ACD、AL在三組間均有差異(P<0.001),針對這兩個參數進行兩兩比較后得到:APACG組與CPACG組間在AL上差異無統計學意義(P=0.75),其余均有差異(P<0.001)。然而,三組間每個位點CT差異均無統計學意義(P>0.05)。正如以往的研究結果,PACG患者具有較短的AL,較淺的ACD。其次,APACG相對于CPACG具有ACD更淺等特征。
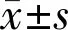
表2 三組眼前段生物學參數及黃斑區脈絡膜厚度的比較
2.3一元線性回歸分析各位點CT的相關因素分析性別、年齡、眼壓、AL、ACD與各位點CT的關系。所有方位的CT與AL呈負相關,即AL越長,CT越薄。N 2mm、I 2mm還與年齡、ACD呈負相關關系,SFCT與年齡、AL呈負相關關系(所有B<0,P<0.05),即年齡越大、ACD越淺、眼軸越長,N 2mm、I 2mm越薄;年齡越大、眼軸越長,SFCT越薄。性別、眼壓與所有位點的CT相關系數無統計學意義(P>0.05),見表3~5。

表3 一元線性回歸分析SFCT、N 2mm的相關因素

表4 一元線性回歸分析T 2mm、S 2mm的相關因素

表5 一元線性回歸分析I 2mm的相關因素
2.4多因素Logistic回歸分析APACG的影響因素以APACG為因變量(0,正常組;1,APACG組),將單因素分析有統計學意義的變量納入到多因素Logistic回歸模型中分析,自變量包括性別、AL、ACD、各位點CT,結果表明變薄的S 2mm與APACG有相關性,其余位點CT及AL、ACD、性別均不是APACG的影響因素。APACG組與正常組比較時S 2mm的OR值<1,即它每增加1μm發生APACG是之前的0.975倍(95%CI0.953,0.997),見表6。

表6 多因素Logistic回歸分析APACG的影響因素
2.5多因素Logistic回歸分析CPACG的影響因素以CPACG為因變量(0,正常組;1,CPACG組),將單因素分析有統計學意義的變量納入到Logistic回歸模型中分析,單因素Logistic回歸分析發現性別不是CPACG的影響因素(P>0.05),故自變量包括AL、ACD、各位點CT,結果表明只有ACD是發生CPACG的影響因素,即ACD是CPACG的保護因素,它每增加1mm發生CPACG是之前的0.005倍(95%CI:0.001,0.033),見表7。

表7 多因素Logistic回歸分析CPACG的影響因素
3討論
房角關閉的主要機制是瞳孔阻滯機制。PACG的發生有較多的危險因素,包括年齡的增長,女性,淺ACD,短AL,小角膜直徑以及位置較靠前或(和)較厚的晶狀體。此外,PACG在中國人中更普遍[2],由此可以得出不同種族的房角關閉機制可能不同。研究發現,即使在校正年齡、體質量指數、眼壓、種族和眼球生物學參數后,仍可得到女性患PACG的風險比男性高[9]。本研究再次證實了PACG具有短AL、淺ACD的解剖學特征。其次,APACG組與性別有相關性并且女性較男性多,而CPACG組與性別無相關性。這結果一定程度上回答了為什么同樣具有較擁擠的眼前段結構的PACG患者一部分發展為APACG,而另一部分發展為CPACG。
此研究分別探討了APACG急性發作期及CPACG患眼與CT的相關性。與之前的研究相比,本研究的不同之處是APACG患者急性發作期眼壓異常高,平均為46.40±11.05mmHg。在評估PACG患者的CT時,國內外學者熱衷于比較SFCT,有些學者會另加幾個距中心凹鼻側、顳側、上方、下方1mm及3mm處CT[10-12]。然而,本研究除測量SFCT外,還測量了距黃斑中心凹鼻側、顳側、上方、下方2mm處CT。不難看出,變薄的S 2mm與APACG有相關性,APACG組與正常組比較時S 2mm的OR值<1,即它每增加1μm發生APACG是之前的0.975倍(95%CI:0.953,0.997)。然而,CT與CPACG不存在相關性,可能是長期的高眼壓刺激和短暫急劇的眼壓升高引起的脈絡膜血流的變化不同。
盡管我們僅僅測量了黃斑區4mm范圍的區域,但是我們發現各位點CT的分布存在較大的變化。我們得到三組CT按大小順序排列如下,APACG:SFCT>T 2mm>S 2mm>I 2mm>N 2mm,CPACG:T 2mm>SFCT>S 2mm>I 2mm>N 2mm,正常人:SFCT>T 2mm>S 2mm>I 2mm>N 2mm。其中,CPACG組黃斑區CT分布情況比較新穎,現有文獻中尚未報道。除CPACG組外,其余兩組SFCT最厚,這可能與黃斑區更高的代謝需要有關。N 2mm處CT最薄,這可能與眼球發育有關。但是,確切的機制需要進一步研究。
CT與諸多因素有關,例如:脈絡膜變薄與年齡的增長[13-14],高眼壓[15]及長AL[13-14]有關。本研究測得每一位點CT與眼壓無相關性。所有位點CT與AL呈負相關,即AL越長,CT越薄。N 2mm、I 2mm還與年齡、ACD呈負相關關系,即年齡越大、ACD越淺、眼軸越長,N 2mm、I 2mm越薄。同時,本研究得到S 2mm的變薄與APACG相關,這可能是眼球擴張使得中心凹上方脈絡膜受到較大的牽拉,從而導致S 2mm變薄。因此,臨床實踐中應對AL較長的PACG患者給予重點關注。一些學者通過校正與CT相關因素后,提出PACG患眼CT會增厚[11-12,16],他們認為CT的增厚使晶狀體、虹膜等結構向前推導致房角的關閉。Zhou等[17]在研究PACG與CT的相關性時,發現PACG組的CT比正常對照組厚并且經過多因素分析后得到CT是PACG的危險因素。還有學者比較同一APAC患者急性發作眼與對側眼的CT后得出急性發作眼CT明顯比對側眼厚[18]。這與Quigley等[4-6]脈絡膜膨脹機制相符。Aung等發現,APACG急性發作眼及對側眼行虹膜切開術術前2wk及術后2wk眼球生物學相關參數未發生顯著的變化[19]。上述研究及本研究結果均不支持脈絡膜膨脹引起的晶狀體-虹膜隔前移假說,瞳孔阻滯機制,高皺褶虹膜機制等機制可能單獨或一起引起房角關閉,脈絡膜膨脹機制需進行大量研究證實。
APACG急性發作期CT變薄機制尚未被詮釋,可能有以下幾個原因:CT部分取決于經葡萄膜鞏膜房水流出途徑從睫狀肌束間進入脈絡膜上腔的房水[20]。研究表明局部使用抗膽堿藥物使睫狀肌松弛,導致SFCT明顯增加[21]。因此,在APACG急性發作期前房角的突然關閉引起通過葡萄膜鞏膜途徑的房水流出量下降,可能會導致CT變薄。
脈絡膜是一個富含血管的組織,它在維持外層視網膜高代謝中起著重要的作用[22]。眼球長期處于高眼壓狀態下會壓迫脈絡膜血管,引起脈絡膜血流的減少。在Akahori等[23]的研究中,人為壓迫眼球使眼壓升高后,引起脈絡膜血流的減少從而導致CT變薄。有學者報道,在懷疑患有APACG眼睛中,眼壓的升高會伴隨CT的變薄。通過有效地治療使眼壓下降并恢復到正常范圍后,引起CT顯著的增加,考慮眼壓恢復正常后脈絡膜突然腫脹[15,24]。
CT變薄又一可能機制是眼球處于高眼壓狀態下使脈絡膜血管直徑減小或(和)脈絡膜毛細血管塌陷[25-26]。雖然有些學者報道CT與眼壓存在相關性,但是本研究以及其他一些研究[12-13]表明兩者之間無關聯性。但是,AL與眼壓正相關這一論點廣泛被接受。隨著眼壓的升高,鞏膜-角膜由于眼球的膨脹而伸展,這好比氣球,隨著氣壓的增加,容積變大。Chen等[10]及Saeedi等[27]發現PACG及原發性開角型青光眼患者行青光眼濾過手術后,隨著眼壓的下降脈絡膜擴張和AL變短。Song等[28]得到APACG急性發作期隨著眼壓的升高,CT變薄同時AL變長。因此,我們推測眼壓雖然不是引起CT變化的直接原因,但是它可能通過影響AL間接改變CT。
Hata等[24]觀察到,PACS患者在進行暗室試驗時,眼壓急劇增加7mmHg的同時CT變薄30μm,并且AL變長。脈絡膜體積的增加是發生APACG或者PACG的觸發因素還是疾病導致的眼球生物學參數的變化尚無定論。為證實CT與PACG的因果關系,未來的研究應增大樣本量,測不同種族PACG患者發作之前,期間及之后的CT并做前瞻性研究觀察CT的動態變化。
本研究同時存在下列幾個不足之處:(1)我們僅測量了APACG急性發作時的CT,發作之前及之后一段時間CT怎么變化不得而知。(2)CT的測量是手動進行的,故隨機誤差無法避免。然而,測量是由同一位經驗豐富的醫師進行,并測兩次后取平均值作為最終結果盡可能減少誤差。(3)樣本數量有限,樣本只從一個醫療中心抽取。未來患者來自多中心的研究可能會提供更準確的結果。但是,我們沒有理由認為本研究樣本量不具有代表性。(4)本研究及國內外的研究僅測量幾個位點的CT。但是,脈絡膜是富含血管且部分為不規則的組織,因此某個位點的數值不能代表完整的脈絡膜組織。
綜上所述,對于PACG的發病機制的解剖危險因素如角膜較小、前房較淺、眼軸長度較短、晶狀體相對較厚已經被我們所熟知,雖然已有研究認為脈絡膜厚度在房角關閉機制中起到一定作用,但其具體病理生理過程仍需進一步探索。今后我們需要通過大量臨床試驗研究葡萄膜組織及脈絡膜靜脈系統,確定脈絡膜厚度在PACG中的變化。同時,得知脈絡膜厚度相關因素要對高危人群進行篩查,還應對參與發病的各因素進行深入研究,并界定其參數范圍。這正是未來原發性房角關閉的主要研究方向之一。本研究的結果為未來研究APACG發作時眼球解剖結構的變化機制以及這種變化在APACG進展中的病理生理作用開辟了新的方向。

