熱毒寧與血必凈“同病異治”新型冠狀病毒肺炎的網絡藥理學作用機制研究
蔡孟成,金永生
(1.海軍軍醫大學基礎醫學院,上海 200433;2.海軍軍醫大學藥學院有機化學教研室,上海 200433)
同病異治是指對于同一疾病,因人、因地、因時的不同,或由于病情的發展、病型的各異、病機的變化差異,治療時應根據不同的情況采用不同的治療方法[1]。新型冠狀病毒肺炎(Corona Virus Disease 2019,COVID-19)是一種急性感染性肺炎,重型患者可出現呼吸困難、高熱神昏等癥狀,危重型患者可出現急性呼吸窘迫綜合征或膿毒血癥。目前,COVID-19診療方案中采用熱毒寧、血必凈注射液對重型和危重型患者進行治療[2],熱毒寧處方由金銀花、青蒿、梔子組成,功效以清熱解毒為主;血必凈處方由丹參、紅花、當歸、赤芍、川芎組成,功效以涼血活血為主。這兩種注射液的藥物組成差異較大,但都對COVID-19有確切療效。本研究利用網絡藥理學探究熱毒寧和血必凈“同病異治”COVID-19的可能作用機制,以期為COVID-19的治療及相關藥物研發提供基礎。
1 材料和方法
1.1 藥物成分與靶點的篩選 本研究采用計算系統生物學實驗室的中藥系統藥理學數據庫和分析平臺(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,http://lsp.nwu.edu.cn/tcmsp.php) 檢索熱毒寧(處方中含金銀花、青蒿、梔子)與血必凈(處方中含丹參、紅花、當歸、赤芍、川芎)的潛在活性成分。根據化合物口服生物利用度≥30%與類藥性≥0.18進行篩選,并利用TCMSP獲取這些潛在活性成分對應的靶點[3]。
1.2 COVID-19靶點的收集 分別以“novel coronavirus pneumonia”、“COVID-19”、“SARS-Cov-2”為關鍵詞,檢索GeneCards數據庫(https://www.genecards.org/),獲取COVID-19的靶點,將檢索到的靶點進行交集,將交集靶點作為研究對象。
1.3 藥物-疾病交集靶點 將1.1項的熱毒寧靶點與1.2項的COVID-19靶點進行交集,獲得熱毒寧和COVID-19交集靶點;將1.1項的血必凈靶點與1.2項的COVID-19靶點進行交集,獲得血必凈和COVID-19交集靶點。再將兩部分交集靶點進行交集,獲得的交集靶點作為兩藥治療COVID-19的關鍵靶點。
1.4 構建活性成分-靶點網絡圖 為了進一步明確COVID-19同病異治的機制,利用Cytoscape 3.6.1軟件構建出化合物-靶點網絡,將活性成分與靶點的作用關系可視化。
1.5 構建蛋白相互作用網絡 為了明確靶點與靶點之間的相互作用關系,將熱毒寧和血必凈治療COVID-19的交集靶點上傳至線上軟件String10.5 (http://stringdb.org),構建蛋白相互作用網絡。物種選擇為 Homosapiens,其余參數保持默認設置,獲取靶點與靶點之間的相互作用關系以及度值,利用Cytoscape 3.6.1軟件將結果可視化。
1.6 KEGG富集分析 利用Cytoscape 3.6.1軟件中的ClueGo功能將熱毒寧和血必凈治療COVID-19的交集靶點進行KEGG富集分析,選擇P<0.05并且通路內最少含有7個熱毒寧和血必凈治療COVID-19交集靶點的通路,將結果可視化。利用KEGG數據庫(https://www.kegg.jp/)獲取熱毒寧和血必凈治療COVID-19的交集靶點的信號通路圖。
1.7 分子對接 利用PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)檢索1.4項下高度值的活性成分,利用PDB數據庫(http://www1.rcsb.org/)檢索新型冠狀病毒產生的主要蛋白酶(3CLpro)的蛋白結構(PDB:6LU7)。利用Openbabel軟件將活性成分由SDF格式文件轉換為PDBQT格式文件,作為對接配體;將3CLpro蛋白結構在Pymol中刪除配體,在AutoDock軟件中進行去水、加氫、計算電荷操作,作為對接受體。利用AutoGrid軟件與AutoDock軟件進行分子對接,并用Pymol軟件將結構可視化。
2 結 果
2.1 活性成分與靶點獲取 利用TCMSP數據庫檢索到熱毒寧和血必凈中的潛在活性成分:金銀花236個,青蒿126個,梔子98個,丹參202個,當歸125個,紅花189個,川芎189個,赤芍119個。根據口服生物利用度和類藥性篩選后,獲得潛在活性成分:金銀花23個,青蒿22個,梔子15個,丹參65個,當歸2個,紅花22個,川芎7個,赤芍29個。獲得COVID-19靶點1751個,其中熱毒寧的藥物靶點702個,血必凈的藥物靶點1049個,去除重復靶點后,獲得熱毒寧靶點196個,血必凈靶點217個。
2.2 COVID-19靶點的獲取 利用GeneCards數據庫獲得COVID-19靶點438個。
2.3 藥物-疾病交集靶點的獲取 將2.1項下196個熱毒寧中藥靶點與2.2項下438個疾病靶點進行交集,獲得熱毒寧和COVID-19的交集靶點51個;將2.1項下217個血必凈中藥靶點與2.2項下438個疾病靶點進行交集,獲得血必凈和COVID-19的交集靶點56個。將兩部分靶點進行交集,獲得51個相同靶點,血必凈較熱毒寧多5個單獨靶點。熱毒寧、血必凈中藥靶點與疾病靶點的維恩圖見圖1。
2.4 活性成分-疾病靶點網絡圖 利用Cytoscape 3.6.1軟件構建活性成分-靶點網絡圖 (見圖2), 該圖中共有129個節點,330條邊。其中藍色圓形節點51個, 代表熱毒寧、血必凈的公共靶點; 黃色圓形節點5個,代表血必凈獨有的靶點;紅色方形節點65個,代表血必凈獨有的活性成分;綠色方形節點24個,代表熱毒寧獨有的活性成分;紫色方形節點8個,代表血必凈與熱毒寧共有的活性成分。度值較高的活性成分包括:木犀草素、槲皮素、山奈酚、黃芩素、異鼠李素,其度值分別為43、20、14、9、8;度值較高的靶點包括:PTGS2、PTGS1、NOS2、PPARG、GSK3B,其度值分別為91、47、25、23、18。
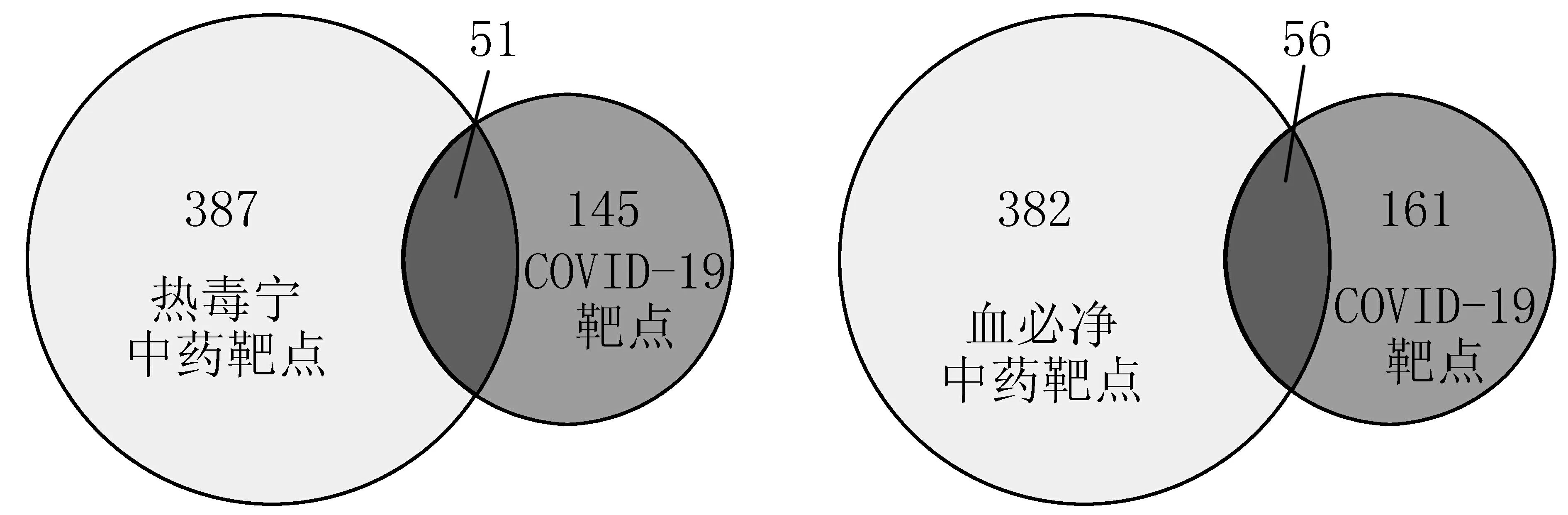
圖1 熱毒寧、血必凈中藥靶點與COVID-19疾病靶點的維恩圖
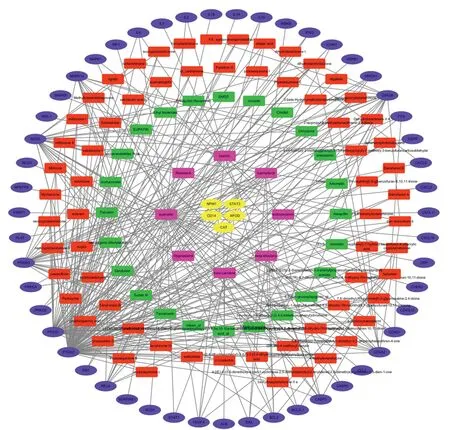
圖2 熱毒寧、血必凈活性成分與COVID-19的疾病靶點網絡圖
2.5 蛋白相互作用網絡 利用Cytoscape 3.6.1軟件構建熱毒寧、血必凈與COVID-19公共靶點的蛋白相互作用網絡圖(見圖3),圖中有51個節點,690條邊。圖中的節點越大、顏色越紅表明靶點的度值越高,靶點作用越關鍵。度值排名前10位的靶點是:血管內皮生長因子-A(VEGF-A)、胱天蛋白酶3(CASP3)、白介素6(IL-6)、絲裂原活化蛋白激酶1(MAPK1)、MAPK8、ALB、CXCL8、IL-10、CCL2、PTGS2,其度值分別為47、43、43、41、41、40、39、39、38、38。
2.6 KEGG富集分析結果 KEGG富集分析結果表明,熱毒寧、血必凈與COVID-19交集的公共靶點主要參與了糖尿病并發癥的AGE-RAGE信號通路、恰加斯病、百日咳、IL-17信號通路、類風濕關節炎等。其中富集程度最高的糖尿病并發癥的AGE-RAGE信號通路,包括Jak-STAT信號通路、PI3K-Akt信號通路、MAPK信號通路、TGF-β信號通路等(見圖4)。
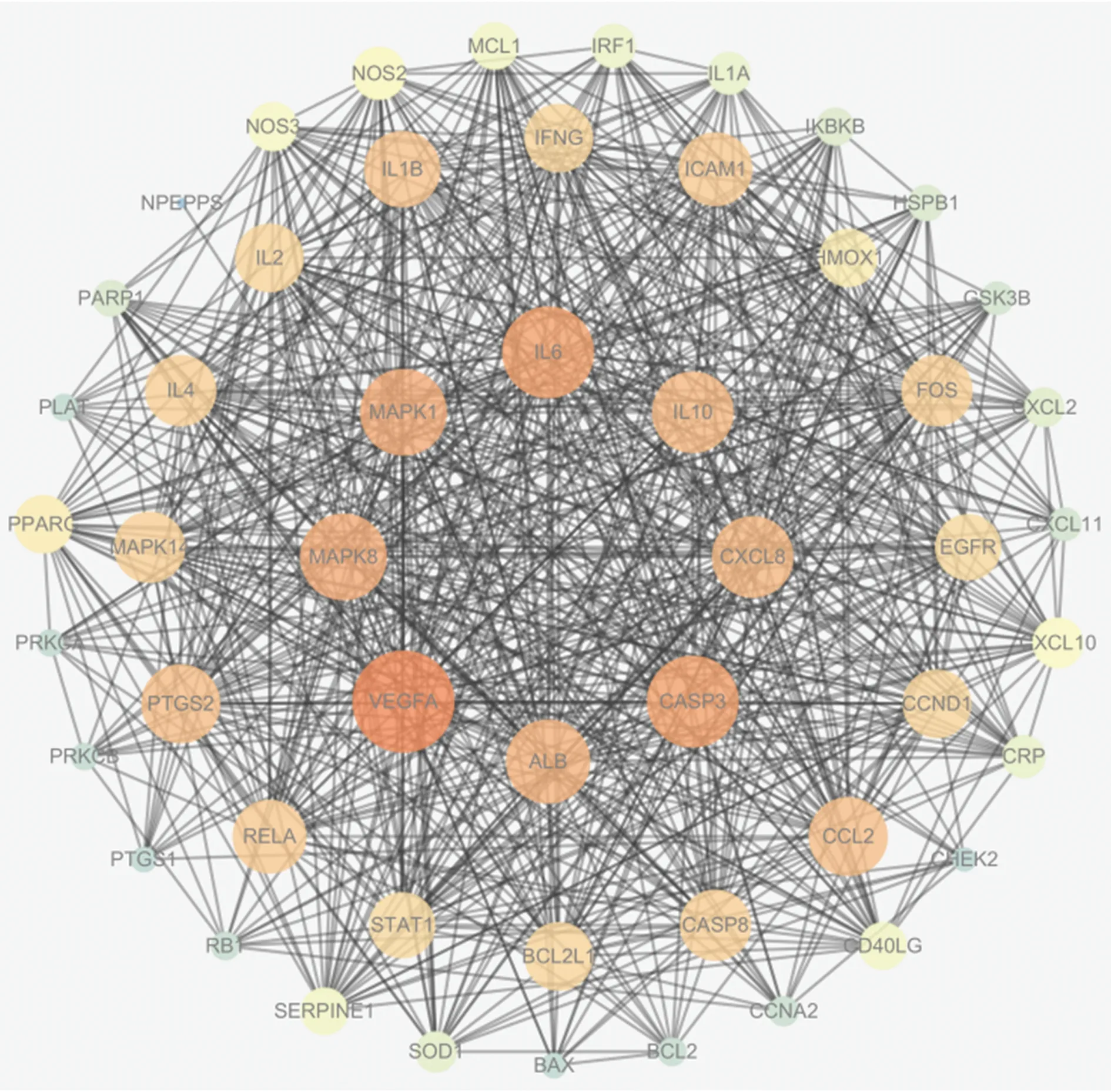
圖3 公共靶點的蛋白相互作用網絡圖
2.7 分子對接 以木犀草素、槲皮素、山奈酚作為對接配體,3CLpro作為對接受體,分子對接結果表明木犀草素與3CLpro的結合能為-1.96 kJ/mol,槲皮素與3CLpro的結合能為-2.30 kJ/mol,山奈酚與3CLpro的結合能為-3.83 kJ/mol。山奈酚與3CLpro的對接能力最強。三種化合物與3CLpro的對接模式圖見圖5。
3 討 論
COVID-19主要由新型冠狀病毒感染引起,抗病毒是治療病毒性感染的基本策略,目前研究的抗擊COVID-19藥物主要是通過3CLpro受體及跨膜絲氨酸蛋白酶2(TMPRSS2)以抑制病毒侵入、病毒膜融合,或抑制SARS-CoV-2的3-胰凝乳蛋白酶樣蛋白酶和RNA依賴的RNA聚合酶的活性[4]。現代研究表明,熱毒寧注射液有廣譜抗病毒作用,可治療病毒性肺炎、手足口病、皰疹性咽峽炎等多種病毒感染性疾病[5-7]。循證醫學研究表明,熱毒寧注射液可以縮短病毒性肺炎患者的退熱時間、啰音消失時間和咳喘消失時間,提高治療有效率[8]。血必凈注射液和抗病毒藥物聯合使用也可提高COVID-19患者的治療效果[9]。熱毒寧注射液和血必凈注射液有明確的臨床療效,但其物質基礎與作用機制尚不明確,利用網絡藥理學探究其共有的活性物質與作用機制,對臨床應用與新藥研發具有重大意義。
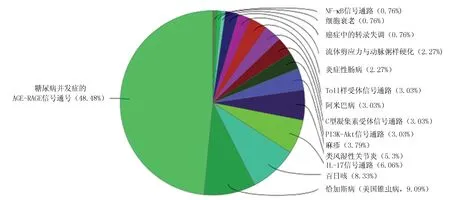
圖4 公共靶點的KEGG富集分析圖
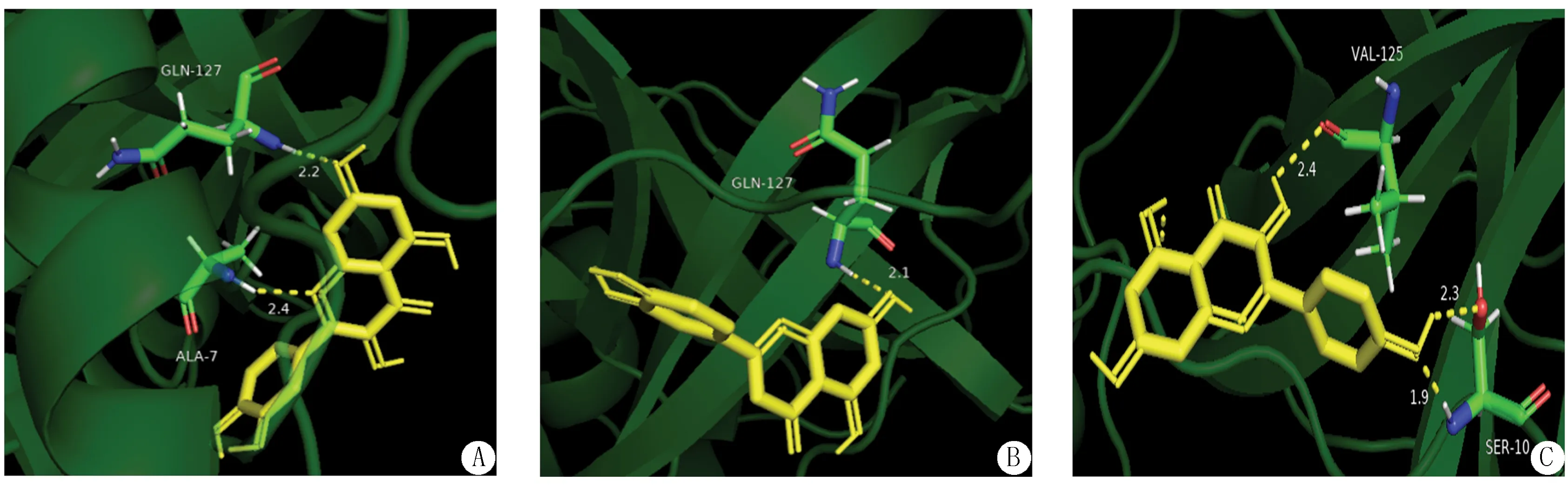
圖5 化合物與3CLpro (PDB:6LU7)對接作用模式
網絡藥理學研究發現,熱毒寧注射液和血必凈注射液公共的且度值較高的靶點包括VEGF-A、CASP3、IL-6。VEGF-A在組織纖維化,內皮細胞的增殖、遷移、存活和血管通透性的維持等多種生理、病理過程中發揮重要作用,COVID-19可導致患者肺纖維化[10],熱毒寧和血必凈可能是通過調控VEGF-A抑制肺纖維化,從而改善患者的肺部癥狀。CASP3與細胞凋亡密切相關,作者推測熱毒寧和血必凈可能是通過抑制CASP3抑制肺泡細胞的凋亡,從而促進肺功能恢復。IL-6與炎癥密切相關,熱毒寧和血必凈可能是通過抑制炎癥反應從而起到解熱鎮痛、止咳平喘的作用。Jak-STAT信號通路、PI3K-Akt信號通路、MAPK信號通路、TGF-β信號通路等可能是熱毒寧和血必凈作用的相關通路,這些通路主要與炎癥反應、細胞凋亡、纖維化相關,提示抑制炎癥反應、抑制細胞凋亡、抑制肺纖維化可作為COVID-19的輔助治療方法。
網絡藥理學研究表明,熱毒寧和血必凈共有的成分包括木犀草素、槲皮素、山奈酚、異鼠李素和植物甾醇等。研究表明,山奈酚和槲皮素具有抗病毒、抗炎、調節免疫、保護臟器的作用[11]。木犀草素對多種病毒的感染具有抑制作用,主要通過影響病毒感染宿主細胞中激酶或轉錄因子的活性,從而影響病毒的復制和轉錄;或者直接對病毒產生抑制作用[12]。異鼠李素也具有明確的抗病毒作用,可提高小鼠的抗病毒能力,并提高小鼠病毒感染后的生存率[13]。進一步的分子對接實驗結果表明,槲皮素、木犀草素、山奈酚和3CLpro具有一定的結合能力,但其結合能較弱,這也證實了黃酮類小分子化合物具有多靶點但作用弱的特點,這提示在日后的應用過程中應當提高黃酮類化合物的劑量,從而提高臨床療效。此外,大量研究表明植物甾醇可以參與免疫調節并發揮抗炎作用,降低促炎細胞因子的含量,結合網絡藥理學研究結果,提示其主要是通過抑制炎癥反應而改善COVID-19患者的癥狀[14]。
綜上所述,熱毒寧和血必凈由于組方差異,在抗COVID-19靶點方面既有相同也有不同。本研究通過對VEGF-A、CASP3、IL-6、MAPK1、MAPK8等共有靶點闡釋COVID-19“同病異治”中的“同病”,通過對NPM1、STAT3、CAT、APOD、CD14特有靶點闡釋COVID-19“同病異治”中的“異治”。上述預測靶點與已有文獻報道的藥理作用相吻合,表明預測靶點的準確性。此外,關于上述討論中剩余靶點的相關研究報道較少,這可為今后深入研究抗COVID-19潛在靶點的分子作用機制提供線索。

