ChCl-EG中銅錫合金的電沉積行為及耐蝕性研究
李奇松,錢慧璇,付旭,孫海靜,孫杰
ChCl-EG中銅錫合金的電沉積行為及耐蝕性研究
李奇松,錢慧璇,付旭,孫海靜,孫杰
(沈陽理工大學 環境與化學工程學院,沈陽 110159)
研究氯化膽堿-乙二醇低共熔溶劑中進行不同濃度比例下的銅錫合金電沉積的電化學行為及鍍層微觀形貌、相組成、耐蝕性能。使用陰極極化曲線對銅錫合金還原行為進行研究,使用掃描電子顯微鏡以及X射線衍射儀等研究電極電位對銀鍍層微觀形貌的影響及銀鍍層的相組成,同時采用EDS分析銅錫合金鍍層的元素組成。使用極化曲線對銅錫合金鍍層的耐蝕性能進行研究分析。在?0.95 V電位時,銅錫發生共沉積。在該電位下,銅以合金形式存在,而錫以合金和單質的形式存在。不同金屬離子含量的電沉積體系得到不同成分的鍍層。鍍液中的銅錫含量明確影響鍍層中的銅錫含量,當鍍液中銅或錫含量偏高時,鍍層質量更好。在ChCl-EG低共熔溶劑中,當CuCl2·2H2O與SnCl2·2H2O的含量(mol/L)分別為0.192:0.048、0.192:0.192、0.048:0.192時,得到的鍍層的相組成分別為β-Cu5.6Sn、η-Cu6Sn5+β-Cu5.6Sn、η-Cu6Sn5。隨著鍍液中錫含量不斷增多,其相組成由β-Cu5.6Sn相向η-Cu6Sn5相發生轉變,并且在沉積層中出現了錫相。鍍液中銅或錫含量偏高時,鍍層質量反而更好。耐蝕性測試顯示鍍液中Sn含量為84.2%時,鍍層腐蝕速率最小,鍍層的耐蝕性最優。
低共熔溶劑;銅錫合金;電沉積;相組成;耐蝕性
銅錫合金因具有良好的焊接性、延展性、耐腐蝕性等性能而被廣泛地應用于物品裝飾、焊接、形狀記憶材料及電池制備等領域[1-5]。目前,因具有成本低、效率較高等優點,使用水溶液電沉積制備銅錫合金鍍層得到了廣泛的應用[6-7]。然而,水溶液體系中銅錫合金的電沉積存在氫脆、pH改變及廢棄物難處理等問題[8]。因此,具有“綠色溶劑”之稱的離子液體進入了研究者的視野,并逐漸應用于銅錫電沉積的研究中[9-10]。
關于離子液體中銅錫合金的電沉積研究,Takayuki等人[11]在雙三氟甲磺酰鈉-雙三氟甲磺酰鉀體系中,通過退火處理制備出了不同相組成的銅錫合金,并研究了其穩定性。Sun等人[12]在氯化1-丁基-3-甲基咪唑離子液體中,采用電沉積法制備出了相組成為Cu13.7Sn的單相銅錫合金。
在用于電沉積研究的諸多離子液體中,低共熔溶劑(Deep Eutectic Solvents, DESs)因成本較低且所涉及的組分安全、無危害而受到了越來越多的重視[13-17]。DESs通常由兩種或三種組分構成,這些組分通過氫鍵結合形成共熔物,其熔點遠低于任一單獨組分[18-19]。制備DESs的原料很容易獲得,可以在常溫下制備,并且制取過程不需要復雜的化學反應[20]。作為溶劑,DESs具有生物降解性、無毒性、環保等諸多優點[21-22]。關于其電沉積應用方面,研究者們在不同的DESs體系中分別進行了鎳[23]、鋅[24]、錫[25]等金屬的電沉積研究。
本文以氯化膽堿-乙二醇(choline chloride-ethylene glycol,ChCl-EG)低共熔溶劑為基礎液,進行了銅錫合金的電沉積。陰極極化曲線有助于深入理解銅錫合金在該體系中的金屬離子還原過程,因此本文在不同鍍液成分下進行陰極極化測試,并深入討論鍍液成分對金屬還原的影響,通過改變溶液中銅錫離子含量的比例,對其電沉積得到的鍍層的微觀形貌、相組成、耐蝕性進行進一步研究。
1 實驗
以ChCl-EG為基礎液,加入不同摩爾濃度比(0.192:0.192、0.048:0.192、0.192:0.048)的CuCl2·2H2O及SnCl2·2H2O。使用CS350電化學工作站對電解液進行陰極極化測試,對不同摩爾比體系的銅錫合金電沉積電化學行為進行研究。陰極極化測試及電沉積過程均采用三電極體系,銀電極為參比電極,鉑電極為對電極,黃銅片為工作電極。對工作電極使用不同型號的砂紙打磨至鏡面光滑。測試前,使用丙酮、無水乙醇和去離子水充分清潔所有電極。使用D/max-RB X射線衍射儀進行電沉積鍍層的物相測試分析。使用Tafel曲線測試方法對電鍍層的耐蝕性進行分析。耐蝕性測試以3.5%NaCl水溶液作為介質,在室溫下進行,試樣測試面積為1 cm2。測試前,將試樣浸入腐蝕介質中靜置30 min。
使用VEGA3掃描電子顯微鏡(scanning electron microscopy,SEM)對金屬沉積層的微觀形貌進行分析。使用D/max-RB X射線衍射儀(X-ray diffracto-meter,XRD)對沉積層的相組成進行研究分析。
2 結果與討論
2.1 銅錫離子在DESs中的電化學還原行為
圖1為DESs中分別含有銅離子、錫離子以及銅錫離子共存時的陰極極化曲線。曲線a是鍍液體系為ChCl-EG-0.192 mol/L CuCl2·2H2O的陰極極化曲線。從圖中可以觀察到,曲線上分別在0 V和?1.2 V處存在a1和a2兩個還原峰,說明Cu2+在ChCl-EG低共熔溶劑中為兩步還原,分別對應于Cu2+/Cu+和Cu+/Cu0的還原過程。Ali等人[3]在ChCl-EG中也進行了Cu2+的電化學行為研究,證明了Cu2+為兩步還原。曲線b是鍍液體系為ChCl-EG-0.192 mol/L SnCl2·2H2O時所測得的陰極極化曲線。可以觀察到,在?0.85 V處存在一個還原峰b1,因此確定Sn2+在ChCl-EG低共熔溶劑中為一步還原,反應式為:Sn2++2e→Sn[5]。曲線c是鍍液體系為ChCl-EG-0.192 mol/L CuCl2-0.192 mol/L SnCl2的陰極極化曲線。可以看到,存在c1和c2兩個還原峰。c1對應Cu2+/Cu+。c1的峰位置較a1略有偏移,這說明Sn2+的存在影響了Cu2+/Cu+的還原。當兩種離子都存在于溶液中時,沉積過程始于0.65 V,比Cu2+沉積電位要更正一些。這是在Cu-Sn電沉積過程中,Sn2+誘導去極化效應導致的結果[2]。這與Bengoa等人在甲磺酸溶液中的研究結果一致[1]。c2對應的還原峰位置介于a2和b1之間,這說明c2這一還原峰可能為銅和錫發生共沉積所致,即c2為銅錫合金的還原峰。
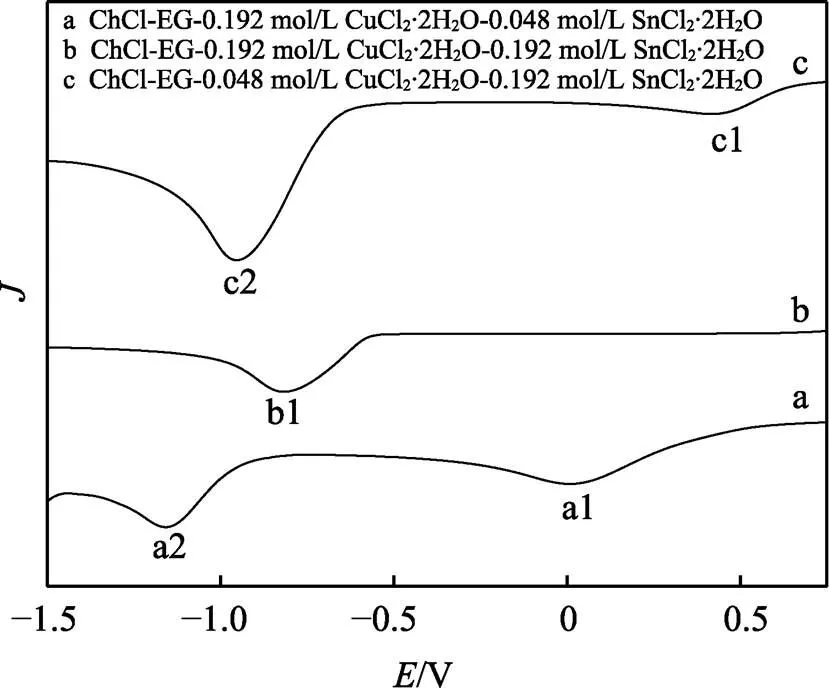
圖1 不同鍍液的陰極極化曲線
2.2 SEM分析
從圖2可以看到,在?0.75 V電位條件下,不同配比的ChCl-EG-CuCl2-SnCl2下所得的鍍層微觀形貌差異較大。當鍍液成分為ChCl-EG-0.192 mol/L CuCl2·2H2O-0.048 mol/L SnCl2·2H2O時,晶體結構排列緊湊,鍍層十分致密。在ChCl-EG-0.192 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O鍍液中進行電沉積得到的鍍層,表面主要由白色羽毛狀物質、白色小顆粒物質和黑色部分組成,并且分布不均勻。在ChCl- EG-0.048 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O鍍液中電沉積得到的鍍層,表面可以看到大量的柏樹葉狀物質,不存在之前的白色小顆粒和黑色部分。再結合EDS結果進行分析發現,鍍液中的銅錫含量影響鍍層中的銅錫含量,當鍍液中銅或錫含量偏高時,鍍層質量反而更好。
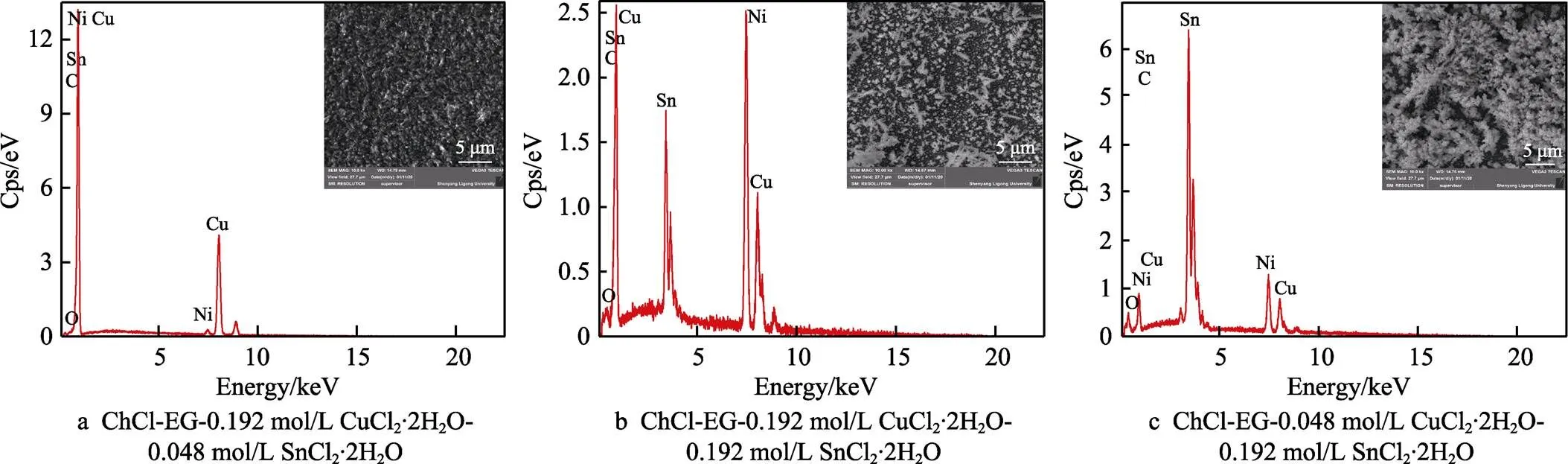
圖2 不同配比的ChCl-EG-CuCl2-SnCl2下所得的鍍層形貌及EDS能譜
2.3 鍍層的相組成分析
圖3及表1分別為在不同鍍液成分下所得鍍層的XRD衍射圖及相組成。在鍍液成分為ChCl-EG-0.192 mol/L CuCl2·2H2O-0.048 mol/L SnCl2·2H2O(a)時,鍍液中錫含量為1.03%,鍍層中主要成分為β-Cu5.6Sn合金相。鍍液成分為ChCl-EG-0.192 mol/L CuCl2·2H2O- 0.192 mol/L SnCl2·2H2O時(b),鍍液中錫含量為57.2%,此時鍍層主要成分為η-Cu6Sn5和β-Cu5.6Sn合金相,此結果和其他作者所報道的相符[1]。當鍍液成分改變為ChCl-EG-0.048 mol/L CuCl2·2H2O- 0.192 mol/L SnCl2·2H2O(c)時,即鍍液中錫含量為84.2%,隨著鍍液中錫含量的增加,鍍層中合金的主要成分發生了變化,變為η-Cu6Sn5合金相,并且由于鍍液中錫離子濃度過高,出現了單獨的錫相。表明隨著錫含量的增加,其相組成由β-Cu5.6Sn相向η-Cu6Sn5發生轉變。
表1 不同條件下得到的鍍層的相組成
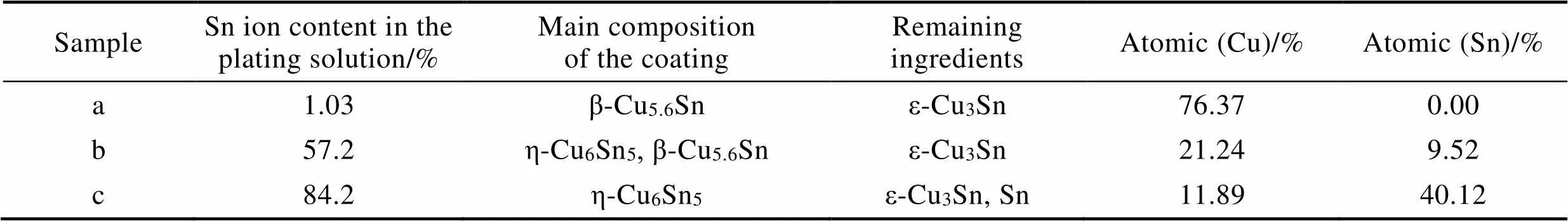
Tab.1 Phase composition of the coating obtained under different conditions
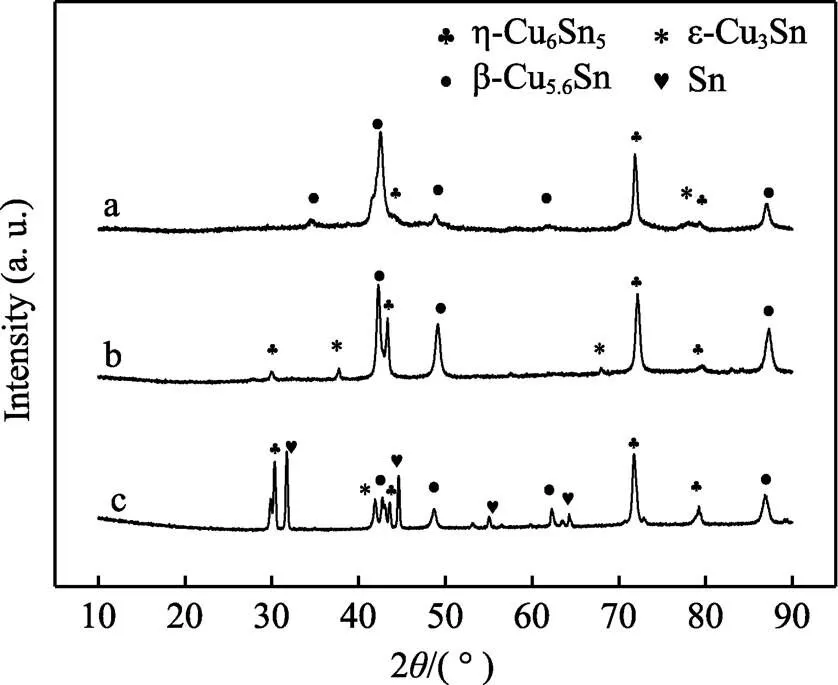
圖3 不同配比的ChCl-EG-CuCl2-SnCl2下所得鍍層的XRD圖譜
實驗結果表明,Sn2+濃度的提高有助于合金的電沉積,而錫離子濃度過高時會導致大量的金屬錫被還原,這與電化學分析結果十分吻合。當銅離子濃度過高時,只存在合金相。結合圖1可知,在峰c2處,該電位下,Cu2+以合金相進行沉積,沒有Cu單質的存在。而Sn以錫單質及合金相的形式存在,所以在該峰處只存在錫及銅錫合金。
2.4 金屬鹽濃度對陰極極化的影響
圖4為不同摩爾比的銅錫離子在DESs中的陰極極化曲線。可以觀察到,隨著溶液中錫含量的增加,0.45 V處(峰a)的電流密度明顯減小,并且峰值向右偏移,這與圖1現象一致,進一步證實了該處為Cu2+/Cu+的還原。而在Cu2+濃度為0.192 mol/L時,在0.45 V電位下,電流密度和電位幾乎不發生變化,說明Sn2+大量存在才會影響Cu2+的還原過程。
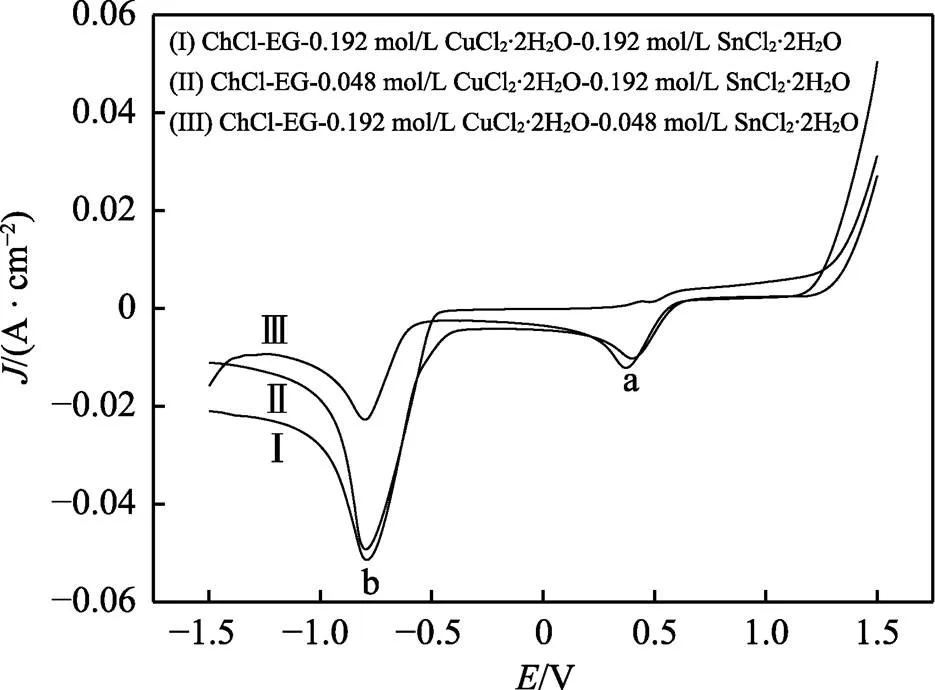
圖4 不同配比的ChCl-EG-CuCl2-SnCl2低共熔溶劑陰極極化曲線
從圖4中還可以觀察到,隨著鍍液中錫含量的減少,峰b的電流效率明顯減小,并且該峰起始沉積電位發生了偏移。這也是由于Sn2+誘導去極化效應所導致[2]。此現象說明在該電位下,鍍液中Sn2+含量的減少會影響合金的沉積。而隨著鍍液中Sn2+含量的增加,該峰的電流密度相近。說明此區間隨著銅濃度的減少(鍍液中錫含量占比增加),峰值幾乎未發生改變。結合圖3c說明,由于此處存在大量的Sn2+,出現了錫單質的沉積,即該還原峰為錫單質及銅錫合金的共沉積電位。而Cu2+的濃度減小,對其沉積沒有十分明顯的影響。鍍液中Sn2+含量的提高,有助于合金的沉積。根據以上結果可以確認,適當提高鍍液體系中的Sn2+濃度,有助于銅錫合金的共沉積,但過量的Sn2+存在,會導致大量錫金屬的還原。
2.5 Sn2+對Cu2+還原行為的影響
圖5為ChCl-EG-0.1 mol/L CuCl2·2H2O鍍液中加入不同濃度錫離子的陰極極化曲線。從曲線中可以明顯觀察到兩個還原峰a和b。還原峰a為Cu2+/Cu+的還原,還原峰b為錫及銅錫合金共沉積。從還原峰可以看出,隨著錫離子濃度增加,峰值電流減小。這可能是由于游離錫離子在電極上產生的吸附作用,抑制了銅離子的還原,導致銅離子還原過電位增大,使峰值電位正移[26]。與還原峰a相反,峰b的峰值電流隨錫離子濃度的增加反而增大。在該峰值電位下,由于大量的Sn2+存在,導致了錫金屬的還原,使得峰值電流增加。在此處發生的銅錫共沉積涉及錫的欠電位沉積。這個結果導致錫與銅弱結合,從而產生抑制作用,導致峰值電位正移[26]。
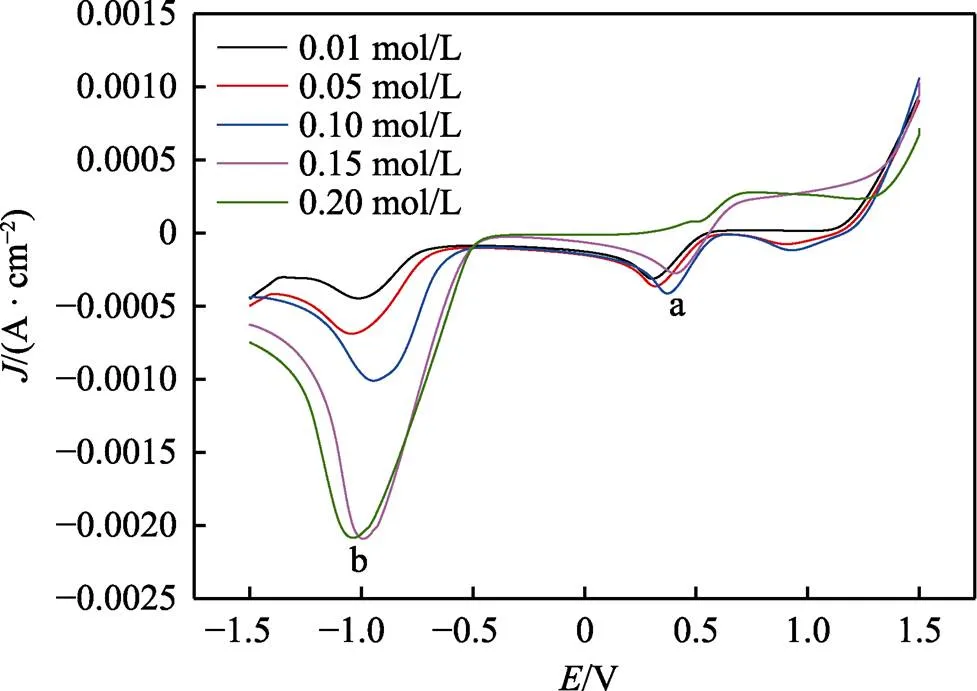
圖5 不同濃度錫離子在ChCl-EG-0.1 mol/L CuCl2·2H2O低共熔溶劑中的陰極極化曲線
2.6 鍍層的耐蝕性分析
為了研究Cu-Sn合金的耐蝕性能,對不同配比的ChCl-EG-CuCl2·2H2O-SnCl2·2H2O溶液中所獲得的金屬鍍層進行了Tafel極化曲線測試,結果如圖6所示。金屬在同一腐蝕介質中的腐蝕電流越小,即腐蝕速率越低,則耐腐蝕效果越好。表2的數據表明,當鍍液成分為ChCl-EG-0.048 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O(即此時鍍液中錫含量為84.2%)時,銅錫合金鍍層腐蝕電流密度最小,為1.02×10?5A/cm2。
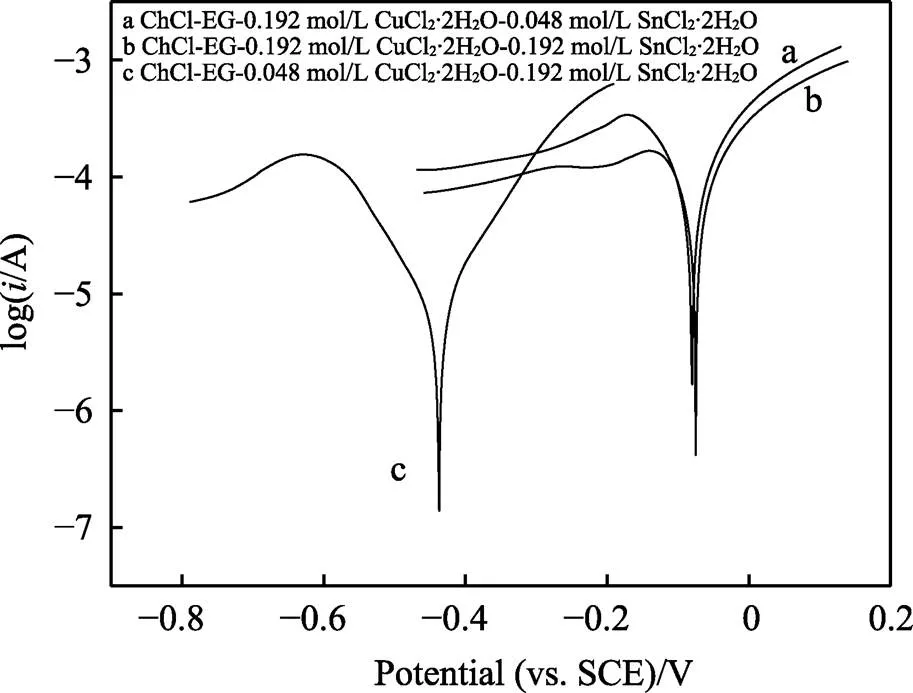
圖6 不同金屬成分比例鍍層的Tafel極化曲線
表2 極化曲線數據

Tab.2 Data of the polarization curves
3 結論
在ChCl-EG低共熔溶劑中可以進行銅錫合金鍍層的電沉積制備。電解液中錫離子的存在會影響Cu2+的還原,導致其還原電流密度明顯減小。在銅錫發生共沉積時,銅不以合金形式存在,而錫以合金和單質的形式存在。鍍液中Sn2+含量的提高,有助于合金的沉積。在不同摩爾比銅錫離子鍍液中所得到的銅錫合金相組成不同,隨著錫含量不斷增多,其相組成由β-Cu5.6Sn向η-Cu6Sn5發生轉變。當鍍液成分為ChCl- EG-0.048 mol/L CuCl2·2H2O-0.192 mol/L SnCl2·2H2O時,得到的銅錫鍍層的耐蝕性最優。
[1] 蔡險峰, 林直榮. 全光亮氰化銅錫合金在仿金電鍍工藝中的應用[J]. 電鍍與精飾, 1992(1): 34-35. CAI Xian-feng, LIN Zhi-rong. Application of fully bright copper tin cyanide alloy in gold imitation electroplating process[J]. Electroplating and finishing, 1992(1): 34-35.
[2] 鐘云, 何永福, 賀飛, 等. 電鍍銅錫合金工藝研究進展[J]. 電鍍與環保, 2007, 27(4): 1-3.ZHONG Yun, HE Yong-fu, HE Fei, et al. Research progressof copper-tin alloy electroplating process[J]. Electroplating and environmental protection, 2007, 27(4): 1-3.
[3] 袁國偉, 謝素玲. 銅錫合金代鎳電鍍工藝的研究進展[J]. 電鍍與環保, 2002(4): 3-6. YUAN Guo-wei, XIE Su-ling. Research progress of copper-tin alloy nickel plating process[J]. Electroplating and environmental protection, 2002(4): 3-6.
[4] 鄭麗, 羅松, 李祉豪, 等. 新型銅錫合金電鍍添加劑的制備[J]. 表面技術, 2018, 47(9): 214-218. ZHENG Li, LUO Song, LI Zhi-hao, et al. Preparation of new additives for copper-tin alloy electroplating[J]. Surface technology, 2018, 47(9): 214-218.
[5] BENGOA L N, PARY P, CONCONI M S, et al. Elec-trodeposition of Cu-Sn alloys from a methanesulfonic acid electrolyte containing benzyl alcohol[J]. Electrochimica acta, 2017, 256: 211-219.
[6] 左正忠, 何細華. 無氰溶液中電沉積銅錫合金電化學行為的研究[J]. 武漢大學學報(自然科學版), 1996, 42(2): 141-166. ZUO Zheng-zhong, HE Xi-hua. Study on electrochemical behavior of electrodeposition of copper-tin alloy in cyanide-free solution[J]. Journal of the Wuhan University (natural science edition), 1996, 42(2): 141-166.
[7] 郭艷, 曾振歐, 趙洋, 等. 焦磷酸鹽溶液體系電沉積白銅錫的電化學行為[J]. 電鍍與涂飾, 2014(8): 317-320. GUO Yan, ZENG Zhen-ou, ZHAO Yang, et al. Electro-chemical behavior of electrodeposition of copper-tin in pyrophosphate solution system[J]. Electroplating and finishing, 2014(8): 317-320.
[8] SUN Jie, MING Ting-yun, QIAN Hui-xuan, et al. Electro-chemical behaviors and electrodeposition of single-phase Cu-Sn alloy coating in [BMIM]Cl[J]. Electrochimica acta, 2019, 297: 87-93.
[9] 詹中偉, 孫志華, 湯智慧, 等. 離子鍍鋁與離子液體電鍍鋁涂層性能對比研究[J]. 裝備環境工程, 2017, 14(5): 74-81. ZHAN Zhong-wei, SUN Zhi-hua, TANG Zhi-hui, et al. Study on the performance of ionic aluminum plating and ionic liquid coating[J]. Equipment environment engineering, 2017, 14(5): 74-81.
[10] 孫杰, 明庭云, 錢慧璇, 等. BMIMPF6離子液體中銅沉積的電化學行為[J]. 高等學校化學學報, 2018, 39(7): 1497-1502. SUN Jie, MING Ting-yun, QIAN Hui-xuan, et al. Electrochemical behavior of copper electrodeposition in BMIMPF6ionic liquid[J]. Chemical Journal of Chinese Universities, 2018, 39(7): 1497-1502.
[11] YAMAMOTO T, NOHIRA T, HAGIWARA R, et al. Improved cyclability of Sn-Cu film electrode for sodium secondary battery using inorganic ionic liquid electrolyte [J]. Electrochimica acta, 2014, 135: 6067.
[12] SUN Jie, MING Ting-yun, QIAN Hui-xuan, et al. Pre-paration of black Cu-Sn alloy with single phase composi-tion by electrodeposition method in 1-butyl-3-methylimi-dazolium chloride ionic liquids[J]. Materials chemistry and physics, 2018, 219: 421-424.
[13] WEI Zuo-fu, QI Xiao-lin, LI Ting-ting. Application of natural deep eutectic solvents for extraction and determi-nation of phenolics in cajanus cajan leaves by ultra per-formance liquid chromatography[J]. Separation and puri-fication technology, 2015, 149: 237-244.
[14] 侯玉翠, 王震, 任樹行, 等. 低共熔溶劑在混合物分離中的應用[J]. 科學通報, 2015(26): 40-49. HOU Yu-cui, WANG Zhen, REN Shu-xing, et al. Applica-tion of low eutectic solvent in mixture separation[J]. Chinese science bulletin, 2015(26): 40-49.
[15] LIANA Anicai, AURORA Petica, STEFANIA Costovici. Electrodeposition of Sn and NiSn alloys coatings using choline chloride based ionic liquids—Evaluation of corro-sion behavior[J]. Electrochimica acta, 2013, 114: 868-877.
[16] SIM L N, YAHYA R, AROF A K. Infrared studies of polyacrylonitrile-based polymer electrolytes incorporated with lithium bis(trifluoromethane)sulfonimide and urea as deep eutectic solvent[J]. Optical materials, 2016, 56: 140- 144.
[17] 譚婷, 喬鑫, 萬益群, 等. 低共熔溶劑新型親水作用色譜流動相改性劑[J]. 色譜, 2015(9): 934-937. TAN Ting, QIAO Xin, WAN Yi-qun, et al. A novel hydrophilic chromatographic mobile phase modifier with low eutectic solvent[J]. The chromatographic, 2015(9): 934-937.
[18] 胡麗華, 陳礪, 方泳華, 等. 低共熔溶劑的分子結構及物性估算的研究進展[J]. 化學試劑, 2017, 39(9): 937-941. HU Li-hua, CHEN li, WAN Yong-hua, et al. Advances in molecular structure and physical property estimation of low eutectic solvents[J]. Chemical reagent, 2017, 39(9): 937-941.
[19] 白芳, 華超, 李靜, 等. 低共熔溶劑在萃取/萃取蒸餾分離中的研究進展[J]. 現代化工, 2017, 37(2): 20-24. BAI Fang, HUA Chao, LI Jing, et al. Research progress of low eutectic solvent in extraction/extractive distillation[J]. The modern chemical industry, 2017, 37(2): 20-24.
[20] WU Ben-pei, WEN Qing, XU Hong, et al. Insights into the impact of deep eutectic solvents on horseradish peroxidase: Activity, stability and structure[J]. Journal of molecular catalysis B: Enzymatic, 2014, 101: 101-107.
[21] DAI Y T, WITKAMP G J, VERPOORTE R, et al. Natural deep eutectic solvents as a new extraction media for phenolic metabolites in Carthamus tinctorius L[J]. Anal chem, 2013, 85(13): 6272-6278.
[22] SWATILEKHA Ghosh, SUDIPTA Roy. Characterization of tin films synthesized from ethaline deep eutectic solvent[J]. Materials science and engineering B, 2014, 190: 104-110.
[23] 譚勇, 張久凌, 孫杰. ChCl-EG低共熔溶劑體系中鎳沉積的電化學行為研究[J]. 表面技術, 2018, 47(11): 245- 249. TAN Yong, ZHANG Jiu-ling, SUN Jie. Electrochemical behavior of nickel deposition in ChCl-EG eutectic solvent system[J]. Surface technology, 2018, 47(11): 245-249.
[24] PEREIRA N M, PEREIRA C M, ARAúJO J P, et al. Zinc electrodeposition from deep eutectic solvent containing organic additives[J]. Journal of electroanalytical chemistry, 2017, 801: 545-551.
[25] NAOKI Tachikawa, NOBUYUKI Serizawa, YASUSHI Katayama, et al. Electrochemistry of Sn(II)/Sn in a hydro-phobic room-temperature ionic liquid[J]. Electrochimica acta, 2008, 53: 6530-6534.
[26] SURVILA A, MOCKUS Z, KANAPECKAITE S. Code-position of copper and tin from acid sulphate solutions containing polyether sintanol DS-10 and micromolar amounts of halides[J]. Electrochimica acta, 2007, 52: 3067-3074.
Electrodeposition Behaviors and Corrosion Resistance of Copper-Tin Alloy Coating in ChCl-EG Deep Eutectic Solvents
,,,,
(School of Environmental and Chemical Engineering, Shenyang Ligong University, Shenyang 110159, China)
The work aims to study the electrochemical behavior, microstructure, phase composition and corrosion resistance of electrodeposited Cu-Sn alloy with different concentration ratio in low eutectic solvent. The cathodic polarization curve was used to study the reduction behavior of copper-tin alloy, the influence of electrode potential on the microstructure of silver coating and the phase composition of silver coating were studied by means of scanning electron microscope (SEM) and X-ray diffraction (XRD), and EDS was used to analyze the element composition of copper-tin alloy coating. The corrosion resistance of Cu-Sn alloy coating was studied by polarization curve. Cu-Sn co-deposition occurs at ?0.95 V potential. At this potential, copper exists in alloy form, while tin exists in alloy and elemental form. Electrodeposition system with different metal ion content can obtain different coatings. The content of copper and tin in the plating bath definitely affects the content of copper and tin in the plating bath. In the ChCl-EG deep eutectic solvents, when the content (mol/L) of CuCl2·2H2O and SnCl2·2H2O was 0.192:0.048, 0.192:0.192 and 0.048:0.192, respectively, the phase composition of the obtained coating was β-Cu5.6Sn phase, η-Cu6Sn5phase and β-Cu5.6Sn phase, and η-Cu6Sn5phase. As the tin content in the plating solution increased, the phase composition changed from β-Cu5.6Sn phase to η-Cu6Sn5phase, and the tin phase appeared in the coating. When the copper or tin content in the bath is on the high side, the coating quality is better. The corrosion resistance test showed that the corrosion rate was the lowest when the content of Sn ions in the plating solution was 84.2%, and the corrosion resistance of the coating was optimal under this condition.
deep eutectic solvents; copper-tin alloy; electrodeposition; phase composition; corrosion resistance
2020-04-01;
2021-03-03
LI Qi-song (1996—), Female, Master, Research focus: corrosion science and protection techniques.
孫杰(1971—),男,博士,教授,主要研究方向為金屬的腐蝕行為與先進防護。郵箱:jiersun2000@126.com
Corresponding author:SUN Jie (1971—), Male, Ph. D., Professor, Research focus: behaviors of metal corrosion and advanced surface engineering. E-mail: jiersun2000@126.com
李奇松, 錢慧璇, 付旭, 等. ChCl-EG中銅錫合金的電沉積行為及耐蝕性研究[J]. 表面技術, 2021, 50(4): 313-318.
TQ153
A
1001-3660(2021)04-0313-06
10.16490/j.cnki.issn.1001-3660.2021.04.032
2020-04-01;
2021-03-03
遼寧省-沈陽材料科學國家研究中心聯合研發基金資助(2019JH3/30100021)
Fund:Supported by Liaoning Province-Shenyang National Laboratory for Materials Science Joint Research Fund (2019JH3/30100021)
李奇松(1996—),女,碩士,主要研究方向為腐蝕科學與防護技術。
LI Qi-song, QIAN Hui-xuan, FU Xu, et al. Electrodeposition behaviors and corrosion resistance of copper-tin alloy coating in ChCl-EG deep eutectic solvents[J]. Surface technology, 2021, 50(4): 313-318.

