白藜蘆醇對環磷酰胺誘導的人精子氧化損傷的保護作用
乜照燕,張亞楠,花 蕊,陳麗君,李 亮,吳海峰
(1.河北醫科大學第四醫院生殖醫學科,河北石家莊 050011;2.河北醫科大學組織胚胎學教研室,河北石家莊 050010;3.河北省胸科醫院醫學檢驗科,河北石家莊 050061)
環磷酰胺(Cyclophosphamide,Cy)是一種抗腫瘤藥物,常用于治療各種惡性腫瘤及自身免疫性疾病。Cy的生殖系統毒性越來越受到人們重視。已有研究顯示Cy可以造成雄性生殖系統損害[1]。動物模型研究顯示Cy可以導致大鼠睪丸和附睪組織發生病理學改變[2]。白藜蘆醇(Resveratrol,RES)是一種天然多酚類物質,主要存在于虎杖、葡萄和紅酒中[3]。RES具有多種生物學活性如抗腫瘤、抗炎、抗氧化等,成為目前體外和體內研究的熱點[4]。有研究發現RES通過激活沉默調節蛋白1(Sirtuin1,Sirt1)保護造血細胞免受放療誘導的損傷[5]。還有研究發現RES可以保護放療誘導的腸道損傷[6]。鑒于此,RES對化療藥物誘導的生殖細胞損傷是否有保護作用尚待研究。此外,Cy屬于前體藥,需在體內完成代謝才能發揮作用,其活性代謝產物4-過氧化氫環磷酰胺(4-Hydro-peroxy Cyclophosphamide,4-HC)可直接作用于細胞[7]。鑒于此,本研究選用4-HC作為體外毒性藥物,研究RES在改善化療導致精子損傷的保護作用及可能機制。
1 材料與方法
1.1 研究對象收集2018年1月至2018年4月河北醫科大學第四醫院生殖醫學中心就診患者的正常精液標本。年齡25~34歲,健康狀態良好,以女方輸卵管因素就診,無高血壓、糖尿病等基礎疾病,性功能狀態正常,實驗參與者均簽署知情同意書。患者禁欲3~7 d,采用手淫法取精液,獲取全部精液于干凈容器,立即送精液檢查室,在室溫下精液完全液化后,依據世界衛生組織人類精液實驗室檢驗手冊第5版進行各項精液參數分析[8],收集正常精液標本用于后續實驗。
1.2 方 法
1.2.14-HC誘導精子細胞毒性作用濃度和RES保護作用濃度的選擇 取正常精液標本進行密度梯度離心后,調整精子濃度為20×106/mL,處理后精液每份取0.1 mL,加入終濃度(0、1.0、2.5、5.0、7.5 μmol/L) 4-HC (Cayman,19527)繼續培養24 h,每組設5個標本,24 h后計數精子活力,伊紅苯胺黑染色計數精子存活率,選擇4-HC適合作用濃度。選用不同濃度(5、10、25、50、75 μmol/L)RES(VETEC,900386-5G)預處理2 h后,再加入按上述已確定的半抑制濃度(50% inhibiting concentration,IC50)4-HC,繼續培養24 h,每組設5個標本,24 h后計數精子活力,伊紅苯胺黑染色確定精子存活率,確定RES保護作用濃度。
1.2.2實驗分組確立4-HC誘導的精子細胞的毒性作用濃度和RES保護作用濃度后,將本實驗研究分為4組:①對照組(CON),精子不加任何藥物在培養液中培養24 h;②單純RES組,精子在含50 μmol/L RES(RES濃度按1.2.1確定)培養液中培養24 h;③4-HC組,精子在含2.5 μmol/L 4-HC(4-HC濃度按1.2.1確定)培養液培養24 h;④RES+4-HC組,50 μmol/L RES培養液預處理2 h后,加入2.5 μmol/L 4-HC繼續培養24 h。分別取上述4組標本檢測精子活力、精子活率、精子氧化應激水平和精子凋亡水平。
1.2.3精子活力、活率測定精子活力測定采用WHO 《人類精液及精子-宮頸黏液相互作用實驗室檢驗手冊》第5版要求。精子活率采用伊紅-苯胺黑染色。使用移液器頭吸取10 μL各組處理后精液于干凈EP管內,吸取10 μL伊紅-苯胺黑溶液在EP管內充分攪拌混勻,靜置60 s。滴加上述混合液10 μL于載玻片上,制成涂片,室溫自然干燥后于×100油鏡下觀察。用血細胞計數器來計數染色(膜不完整,淡紅色)和不染色(膜完整,白色)細胞的數目。為了達到可接受的低樣本誤差,每張玻片評估200個精子。
1.2.4氧化應激指標測定精液微量丙二醛(Malondialdehyde,MDA)精子膜脂類過氧化反應的程度以反應產物MDA表示,MDA測定采用硫代巴比妥酸比色法,采用南京建成生物工程研究所生產的試劑盒測定。取待測精液0.1 mL為測定管,并設測定空白管、標準管及標準空白管,按照說明書操作,分別加入相應試劑,450 nm處BioTek酶標儀測定。超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽過氧化物酶(Glutathione peroxidase,GSH-Px)按試劑盒說明進行檢測,取各組精子懸液,按照說明書操作,分別于550 nm和412 nm BioTek酶標儀測定。
1.2.5精子凋亡測定將上述處理后的精子懸液加入磷酸鹽緩沖液(phosphate buffer saline,PBS)離心洗滌2次,離心后取精子沉淀100 μL放入試管中,加入FITC-AnnexinV 10 μL和PI 5 μL染色,室溫下避光靜置15 min后加400 μL孵育緩沖液,1 h內流式細胞儀測定結果。每次檢測至少5 000個精子。采用前向散射/側向散射設門來排除細胞碎片和細胞聚集的干擾。先通過散射光信號分選精子與細胞碎片,然后再在雙變量熒光信號散點圖上區分出活細胞、死亡細胞與凋亡細胞。激發波長為488 nm,綠色熒光(480~530 nm)采用FL1通道檢測,紅色熒光(580~630 nm)采用FL2通道檢測,陽性細胞比率和平均熒光強度采用CellQuest軟件進行分析。
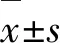
2 結 果
2.1 4-HC導致精子活力和存活率下降不同濃度4-HC(0、1.0、2.5、5.0、7.5 μmol/L)處理精子24 h后。結果顯示:與對照組比較,隨著4-HC濃度的增加,精子活力和活率逐漸降低,呈劑量依賴關系,差異有統計學意義(P<0.05,表1)。按給藥濃度IC50標準,選擇2.5 μmol/L 4-HC為后續實驗給藥濃度。
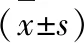
表1 4-HC對精子活力和活率影響
2.2 RES改善了4-HC導致的精子活力和活率下降
為了研究RES對4-HC誘導精子活力和活率的改善作用,加入4-HC前使用不同濃度的RES預處理,24 h檢測精子活力和活率。結果顯示:隨著RES作用濃度的增加,精子的活力和活率逐漸增加;RES濃度達50 μmol/L時,精子的活力和活率顯著升高,與2.5 μmol/L 4-HC組相比,差異有統計學意義(P<0.05),上述結果提示RES預處理能改善4-HC誘導的精子損傷。在RES濃度為50 μmol/L時效果最佳,選擇50 μmol/L為后續實驗藥物濃度(P<0.05,表2)。
2.3 RES改善4-HC導致精子氧化應激對各組氧化應激水平進行分析,結果顯示,4-HC組精子MDA水平增高,SOD、GSH-Px酶活性顯著下降,與對照組相比差異具有統計學意義(P<0.05)。在RES+4-HC組,MDA水平降低,SOD、GSH-Px酶活性升高(P<0.05),與4-HC組相比,差異具有統計學意義(P<0.05)。由此可見,RES預處理降低了4-HC誘導的精子氧化應激產物產生,增強了抗氧化酶活性,起到保護精子的作用。
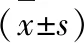
表2 RES預處理對4-HC誘導精子活力和活率的影響
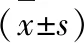
表3 RES預處理對4-HC誘導精子氧化應激水平的影響
2.4 RES改善了4-HC誘導的精子凋亡對各組精子進行流式細胞儀凋亡檢測,結果顯示,4-HC組精子凋亡情況(42.6%),與對照組(6.8%)比較,差異有統計學意義(P<0.05),RES+4-HC組精子細胞凋亡率明顯降低為14.0%,與4-HC比較,差異有統計學意義(P<0.05),RES預處理改善了4-HC誘導的精子凋亡(圖1)。
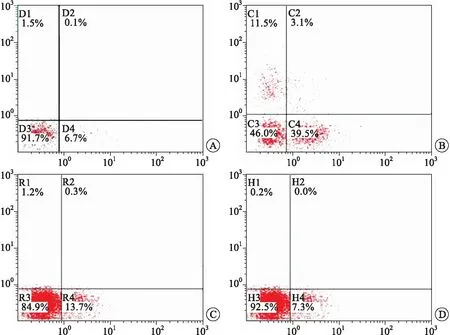
A:對照組;B:4-HC組;C:RES+4-HC組;D:RES組。
3 討 論
近年來,隨著惡性腫瘤年輕化的趨勢,探尋化療前保護性腺功能、減少性腺損傷或化療后提高生育力的補救治療顯得尤為重要。精準醫療、化療方案改善、現代手術方式改進以及精子和睪丸組織保存、輔助生殖技術的大力發展,使更多腫瘤患者能夠生育后代。目前,上述措施各有利弊,尚需進一步探尋新的保護腫瘤患者生育力的方法。
研究認為多數化療藥物會影響生育,約50%男性患者在化療結束后會出現少弱精子癥,其中烷化劑和鉑類化療藥物對生育力影響最大[9]。氧化應激損傷是化療藥物導致性腺損傷的原因之一。抗氧化劑應用可以減弱氧化應激對精子的損傷。劉波等[10]研究發現通過提高抗氧化能力可以改善Cy致精子濃度減少和活力降低的情況。李杜娟等[11]在灌注Cy小鼠的實驗中,抗氧化劑維生素E組通過提高抗氧化酶水平改善了Cy誘導的睪丸組織損傷。RES由于其化學結構中存在酚羥基,能有效清除羥基和過氧化物,防止細胞膜脂質過氧化和活性氧對DNA的損傷[12]。RES能夠激活體內抗氧化酶系統SOD、CAT等酶活性,具有細胞內抗氧化活性的功能[13]。目前有一些研究證實RES在體外氧化應激環境中對精子有一定的保護作用。王莉莉等[14]在精子優選過程中加入RES,結果發現RES顯著降低了精子優選過程中活性氧(reactive oxygen species,ROS)的含量。此外,RES通過降低精子氧化應激水平,改善了氧化劑導致的精子膜完整性破壞并且增加了精子活力和受精能力[15]。但RES對化療藥物導致的精子損傷是否有保護作用尚未見報道。本研究首先采用Cy構建精子損傷模型,結果顯示,隨著4-HC濃度增加,精子活力和存活率下降,在2.5 μmo1/L時精子活力下降至52.2%,根據藥物濃度選擇的IC50原則,將2.5 μmo1/L 4-HC作為后續研究濃度。RES+4-HC組,隨著RES濃度升高,精子活力得到提升,50 μmol/L RES對精子改善效果最佳,選擇50 μmol/L為后續實驗藥物濃度。
氧化應激可以造成精子結構和功能損害,是導致男性不育的主要原因[16]。本研究進一步評估了氧化應激產物MDA和抗氧化酶GSH-Px、SOD酶活性的變化,MDA是氧化應激損傷過程中產生的主要氧化應激產物之一,對精子細胞有明顯損傷作用,是引起不育的常見代謝產物[17]。
本研究結果顯示,4-HC組MDA水平顯著上升,GSH-Px、SOD酶活性顯著下降。ROS破壞線粒體呼吸功能,降低線粒體膜電位,導致能量生成障礙使得精子活力進一步下降[18]。高水平的ROS可損害線粒體膜,引起細胞色素C釋放觸發細胞凋亡[19]。本研究顯示4-HC組精子活力、存活率下降,流式細胞儀檢測精子凋亡增加。我們推測4-HC誘導精子產生過量的氧化應激反應,導致精子發生高氧化應激損傷,高濃度的ROS破壞精子線粒體的結構和功能,導致精子活力減弱,也加速生殖細胞的凋亡過程。本研究發現RES預處理組GSH-Px、SOD氧化酶酶活性增加,MDA水平降低,RES組精子活力和活率得到改善,精子凋亡降低。在RES組,MDA水平顯著下降,GSH-Px、SOD酶活性上升。精子活力、存活率得到提高,流式細胞儀檢測精子凋亡降低。由此可見,RES抵抗了過度氧化應激對精子的損傷作用,從而改善了4-HC誘導的精子損傷。在一些其他體外研究中發現RES可以增強細胞的抗氧化功能,可以保護細胞免受氧化應激損傷而延緩細胞死亡[20]。RES預處理通過抗氧化改善了4-HC誘導的精子損傷。
綜上所述,本研究為臨床腫瘤治療中應用化療藥物的男性生育力保護提供了一定的依據。未來研究將進一步闡明RES改善化療藥物對精子的損害機制和RES應用安全性的問題。

