共價有機骨架功能材料及其在糖肽選擇性富集中的應用
盛騫瑩, 周 揚, 趙治全, 王耀慧, 李偉誠, 柯燕雄, 藍閩波*, 卿光焱, 梁鑫淼,3
(1. 華東理工大學化學與分子工程學院, 上海 200237; 2. 華東理工大學藥學院, 上海 200237; 3. 中國科學院大連化學物理研究所, 遼寧 大連 116023)
繼基因組學之后,蛋白質組學成為新的研究熱點。作為生命活動的主要承擔者,蛋白質的多種翻譯后修飾(糖基化、磷酸化、甲基化、泛素化修飾等)參與或者調控生物體內重要的生理、病理過程,并在人體不同的健康狀況或生長時期發生改變[8-10]。其中,蛋白質的糖基化修飾是上述幾種修飾蛋白質中最常見、最重要的翻譯后修飾之一[11,12]。糖蛋白組學研究有幾個任務,分別為發生糖基化的蛋白質的鑒定、糖肽結構的解析、糖基化位點的鑒定和研究糖基化對蛋白質功能的影響[13-16]。生物質譜技術的發展使人們能在分子水平上進行糖蛋白或糖肽的有效監測[17,18]。但是,和其他蛋白質相比,糖蛋白的數量較低,酶解后的糖肽豐度就更低了,因此,需要一些手段對糖肽進行有效的富集,以提高其檢測豐度[19-22]。開發新的富集方法和富集材料是糖蛋白組學領域的研究熱點[23-30]。
COFs有序堅固的框架孔道結構,提供了作為糖肽富集材料載體的條件,同時基于載體骨架結構的功能化修飾也將大大提升糖肽富集分離效率[31-34]。Zhang課題組[35]將一種新型COF功能化的磁性石墨烯復合物(MagG@COF-5)作為超敏感基質用于識別糖肽,通過LC-MS/MS分析,成功地檢測到了232個獨特的N-連接糖肽和85個特征糖蛋白。N-連接糖肽已被證明是治療各種疾病的關鍵生物標志物,Zhang課題組[36]研究出的還原型谷胱甘肽功能化銀納米粒子修飾COFs材料應用于N-連接糖肽的富集研究中,提高了COFs的富集選擇性,并提供了一種新的方法。Wu課題組[37]使用磁性膠體納米晶體簇(MCNC)作為核心,利用后修飾策略制備了另一種谷胱甘肽功能化的高親水性磁性COFs,用于人唾液中內源性N-連接糖肽的富集,同樣表現出優異的糖肽富集性能,如高靈敏度及選擇性、良好的尺寸排阻效應和可重復使用性等。但目前將結構修飾功能化的COFs材料應用于糖蛋白組學的研究還在起步階段,相關研究較少,也存在糖肽選擇性不足、相互特異性作用不強等問題。
本文以開發新的糖肽富集材料為目的,結合COFs材料的功能化修飾,以2,5-二甲氧基苯-1,4-二甲醛(DMTA)和1,3,5-三(4-氨苯基)苯(TAPB)為單體,通過溶劑熱法,首先制備得T-D-COF,再用亞氯酸鈉溶液進行氧化,發展出一種新的材料O-T-D-COF。將該材料進行糖肽的富集應用,在復雜體系驗證富集選擇性,以及考察富集檢測限、富集容量和回收率。基于COFs功能化修飾的新材料,有望為開發糖肽富集新材料提供新的思路,為糖蛋白組學提供了一種選擇性更優、可控性更好的糖肽富集新思路。
1 實驗部分
1.1 儀器、試劑與材料
TAPB、DMTA、正丁醇、鄰二氯苯、冰醋酸、碳酸氫銨、尿素購自麥克林生化科技有限公司(中國上海)。甲醇購自國藥集團化學試劑有限公司(中國上海)。四氫呋喃、硼氫化鈉、乙腈(ACN)、三氟乙酸(TFA)購自上海阿拉丁生化科技股份有限公司(中國上海)。人血清免疫球蛋白G(IgG)、牛血清白蛋白(BSA)、二硫蘇糖醇(DTT)、碘代乙酰胺(IAA)、胰蛋白酶、N-糖苷酶F(包含Glycobuffer)、2,5-二羥基苯甲酸(DHB)購自Sigma-Aldrich(美國)。此外,實驗用水為Milli-Q超純水系統(美國Millipore公司)制備的超純水。人血清樣本采集自健康人,按照標準臨床程序從上海交通大學附屬第六人民醫院獲得。
掃描電子顯微鏡(SEM)的型號為S-3400N (Hitachi,日本),透射電子顯微鏡(TEM)的型號為JEOL JEM-1400(JEOL,日本),固體核磁測試采用500MHz核磁共振波譜儀(Bruker,瑞士),紅外光譜采用全反射傅立葉紅外光譜儀(ATR-FTIR)型號為Nicolet 6700 (Thermo Scientific,美國)。
1.2 COFs的制備
稱取TAPB 0.526 g(1.5 mmol),裝于50 mL三口燒瓶中;量取10 mL鄰二氯苯和10 mL正丁醇,混合均勻后加入到三口燒瓶中,將燒瓶放在攪拌器上充分攪拌。接著,稱取0.436 g(2.25 mmol)DMTA,倒入三口燒瓶中,用移液槍吸取2 mL(6 mol)冰醋酸,裝入三口燒瓶中作為催化劑。用橡皮塞把三口燒瓶的兩端塞緊,中間放上冷凝管,冷凝管的上方接上油封裝置,將針頭插入橡皮塞后插到液面以下,通入氮氣作為保護,調節氮氣流量為每秒一個氣泡。將三口燒瓶放入油浴鍋中,120 ℃冷凝回流,磁力攪拌。72 h后停止攪拌和加熱,待裝置冷卻到室溫后,抽濾得到黃色的固體產物。產物用四氫呋喃重復洗滌7次,去除雜質。洗滌后的產物放入30 ℃干燥箱隔夜烘干,得到黃色粉末,標記為T-D-COF。稱取47.08 mg T-D-COF粉末,溶于4 mL二惡烷中制成懸浮液。向懸浮液中依次加入2.548 mL(24.0 mmol)2-甲基-2-丁烯、400 μL濃度為3.3 mol/L的亞氯酸鈉水溶液、137.6 μL(2.4 mmol)冰醋酸。所用的T-D-COF、2-甲基-2-丁烯、亞氯酸鈉和冰醋酸的物質的量之比為1∶100∶5.5∶10。在室溫避光的條件下,將兩相懸浮液持續攪拌20 h,所得產物為紫黑色固體。反應后的體系通過過濾分離,得到的固體依次用40 mL超純水、40 mL 10%(體積分數)硫代硫酸鈉、40 mL超純水和40 mL丙酮洗滌,產物置于60 ℃真空干燥箱中干燥10 h,得到紫色粉末,標記為O-T-D-COF,制備過程如圖1所示。
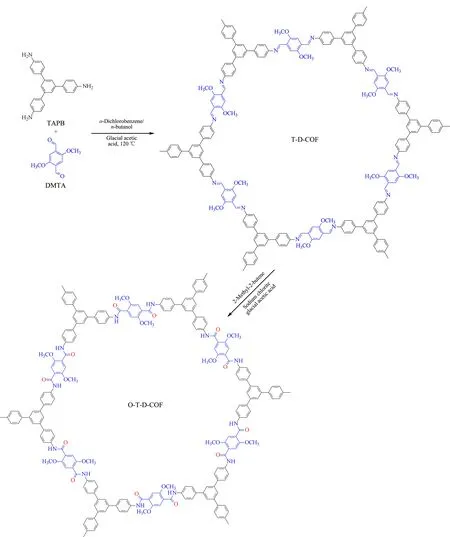
圖 1 O-T-D-COF的合成路線Fig. 1 Synthetic route of O-T-D-COF
1.3 蛋白酶解
稱取1 mg IgG (或1 mg BSA),用100 μL含有8 mol尿素的50 mmol碳酸氫銨的溶液將IgG完全溶解,向溶液中加入5 μL DTT(200 mmol),在恒溫56 ℃的條件下振蕩45 min。取20 μL IAA(200 mmol)避光條件下配制,加入到振蕩后的溶液中,避光條件下靜置30 min。然后向溶液中繼續加入碳酸氫銨溶液,直至溶液體積達到1 mL。向溶液中加入20 μg胰蛋白酶后,將溶液放置在37 ℃的培養器中,持續酶解17 h后向體系中加入5 μL甲酸(FA)使酶解反應停止。
《Java程序設計》課程在泛雅平臺上的應用,是一種新型的教學模式,仍然存在些許缺陷,但如今各高校都開始重視這種富媒體與教學結合的模式,開始進行不斷的探索,在具體應用中發現問題,解決問題:
1.4 糖肽的富集
使用離心法進行O-T-D-COF材料對糖肽的富集實驗,在離心管中加入500 μg O-T-D-CO材料,加入100 μL上樣液(ACN∶H2O∶TFA=90∶5∶5, v/v/v),超聲1 min、振蕩5 min進行潤洗,離心去除上清液;取IgG樣品(之前已分裝旋干)6 μL,用180 μL上樣液重溶;20 μL上樣液溶解O-T-D-COF材料,將溶解了O-T-D-COF材料的上樣液轉移至IgG的溶液中,超聲1 min、振蕩30 min進行孵化,離心去除上清液;將上樣后的材料分散在200 μL的淋洗液(ACN∶H2O∶TFA=90∶9.9∶0.1, v/v/v)中,超聲1 min、振蕩5 min進行淋洗,離心去除上清液,重復該步驟3次;取10 μL洗脫液(H2O∶TFA=99∶1, v/v)加入離心管中,超聲1 min、振蕩20 min將富集在材料中的糖肽分離出來,離心后保留上清液。復雜體系中的富集、富集檢測限、富集容量和回收率操作參照以上操作流程。
1.5 脫糖基實驗
人血清蛋白酶解液的富集按照1.4節進行操作,將糖肽樣品凍干后加入17 μL水和2 μL Glycobuffer,混勻,再加入1 μLN-糖苷酶F(PNGase F)。37 ℃下振蕩17 h后,離心濃縮,重溶于10 μL含0.1%(v/v)的FA溶液中,等待進一步進行分析。
1.6 分析條件
糖肽樣品洗脫液的檢測使用基質輔助激光解吸電離-飛行時間-質譜(簡稱MALDI-TOF/TOF-MS, AB Sciex,美國),在反射正離子模式下進行分析。取1 μL富集后的洗脫液,點在靶上,待溶液自然干燥后,取1 μL質量濃度為25 mg/mL的DHB基質溶液(ACN∶H2O∶H3PO4=70∶29∶1, v/v/v)覆蓋在樣品點上。質譜儀的檢測范圍是m/z2 000~3 500,激光強度是3 800 μJ。得到的結果利用軟件Data Explorer (TM) Software進行數據分析,獲得質譜圖峰的信息,其中峰的分辨率設置為0.95,S/N>3。
人血清提取蛋白酶解液的糖基化肽段/蛋白質采用賽默飛高分辨液相色譜-質譜聯用儀Thermo EASY-nanoLC 1000 Nano HPLC System (Thermo Fisher Scientific,德國)分析,該儀器配備了納升液相色譜和Q-Exactive plus質譜儀。采用同公司納米反相C18柱(15 cm×75 μm)。流動相A為ACN-FA(99.9∶0.1, v/v), B為H2O-FA (99.9∶0.1, v/v)。洗脫方式如下:0%B~4%B, 2 min; 4%B~35% B, 90 min; 35%B~45% B, 10 min; 45%B~90%B, 5 min; 90% B, 5 min;最后用100%A沖洗柱子15 min。流動相流速為300 nL/min,柱溫為25 ℃,進樣量為1 μL。Q-Exactive plus質譜的實驗參數為:電噴霧電壓為2.0 kV,掃描范圍為m/z400~2 000; MS/MS采集在Orbitrap中進行,分辨率為35 000(m/z200)。數據處理:采用搜索軟件Protein Discovery 1.4對數據進行搜庫,搜索引擎為Sequest HT,該搜索引擎可搜索所有數據庫包括人的UniProtKB/SwissProt數據庫。
2 結果與討論
2.1 O-T-D-COF材料的合成
本實驗用到的合成方法是溶劑熱法。本實驗合成的O-T-D-COF材料是一種具有二維(2D)結構的材料,反應單體分別是TAPB和DMTA。這兩種單體中分別含有醛基和氨基,通過共聚縮合反應生成的席夫堿構成了T-D-COF材料的框架,每6份單體組合成一個六邊形的大環,這些大環再通過層層堆疊形成2D的管狀結構。該反應對原料和產物的溶解性要求較高。在溶劑中,原料慢慢溶解到溶劑中參與反應,這樣有利于合成的材料具有有序的結構,并且能夠最大限度地減少材料結構上的缺陷。因此本實驗選擇的溶劑是正丁醇和鄰二氯苯,這二種溶劑對上述兩種單體的溶解性都比較小,有利于原料緩慢溶解到溶劑中。冰醋酸作為反應的催化劑可以活化反應物中的羰基,有利于脫水縮合反應。然后對合成后的COFs材料進行氧化處理,可以提高材料的富集性能。2D層狀的O-T-D-COF材料的結構穩定性來自于層與層的作用力,夾層間的作用力是形成堆積結構的重要作用力,直接影響到材料的孔隙率和結晶性。在材料中引入的甲氧基就很好地加強了層與層之間的作用力,甲氧基處于苯基的邊緣上,每個氧原子上的二對孤電子對轉移到苯環中心,這就使得層與層之間電荷排斥力減小,從而增強了夾層間的作用力,改善了O-T-D-COF材料的穩定性和結晶性。

圖 2 O-T-D-COF材料放大(a)5 000倍和(b)18 000倍的SEM圖及(c)固體核磁13C譜和(d)紅外光譜圖Fig. 2 SEM images of O-T-D-COF at (a) 5 000 and (b) 18 000 magnifications, and (c)13C NMR spectra and (d) IR spectra of O-T-D-COF
2.2 O-T-D-COF材料的表征
通過掃描電鏡觀察O-T-D-COF材料的形貌,圖2a和2b是材料O-T-D-COF在掃描電鏡下成像的圖片,從圖中可以看到O-T-D-COF材料呈略規則狀聚集在一起。放大倍數為5 k倍時,從圖2a可以看出O-T-D-COF材料的空間分布很密集,單個單元尺寸較小。放大倍數為18 k倍時(見圖2b)可以看到每個單元之間結合比較緊密,結構較為規則。圖2c是O-T-D-COF材料的固體核磁表征圖,從圖中的1號峰位置可以看出材料被部分氧化。紅外光譜進一步表征T-D-COF與O-T-D-COF材料的特征峰差異(見圖2d)。在材料氧化后,譜圖上1 668 cm-1附近的峰是酰胺鍵的C=O伸縮振動,1 515 cm-1出現新的伸縮振動峰,該峰為酰胺基帶的峰,這一結果也說明了COFs材料已被成功制備。
通過透射電鏡觀測物質微觀形貌時,能夠看到其聚集狀態,分辨率高時還能看到晶體的晶格條紋,從而可以測量材料的孔徑大小。圖3為O-T-D-COF材料在透射電鏡中形成的圖像,從圖中可以看到,材料中單元的規則結構呈現密集狀態,在高倍分辨率下能看到晶體的晶格條紋明暗對比,單元呈中空狀態,表明該材料具有規則的孔道結構。

圖 3 O-T-D-COF材料的TEM圖Fig. 3 TEM images of O-T-D-COF
2.3 O-T-D-COF材料的糖肽富集條件優化
IgG是人體免疫系統中的一種保護物質,對IgG的研究在疾病診斷等領域有重要意義。IgG主要分為IgG 1和IgG 2兩個亞型,都具有糖基化的位點,且位點上均連接了一個以五碳作為核心的聚糖。本文利用MALDI技術測定富集洗脫液中的糖肽,通過譜圖分析探討富集效果。
在上樣液酸度條件的優化中,使用了4種不同酸度的上樣液進行實驗。其中TFA的體積分數分別是:0.1%、1%、3%、5%,配制成乙腈體積分數為90%的酸性溶液。如圖4a所示,當上樣液中TFA的體積分數為0.1%、1%和3%時,6條糖肽的信號峰都較弱;相比之下,在TFA體積分數在5%時,每一個柱形都明顯比前3組對應柱形的長度更長,說明此酸濃度下的上樣條件更有利于富集,因此得出上樣液中TFA的最佳體積分數為5%。
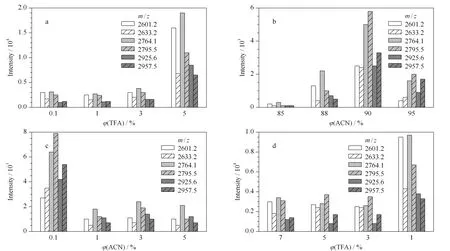
圖 4 (a)上樣液的酸度、(b)上樣液中的乙腈體積分數、(c)淋洗液的酸度、(d)洗脫液的酸度對富集效果的影響Fig. 4 Effects of (a) loading buffer acidity, (b) ACN volume percentage in loading buffer, (c) washing buffer acidity, and (d) eluent buffer acidity on enrichmentm/z 2601.2, 2633.2, 2764.1, 2795.5, 2925.6, and 2957.5: six highly abundant glycopeptides of IgG digests.
考察上樣液中的乙腈的體積分數,分別設為85%、88%、90%、95%, TFA的體積分數固定為5%。如圖4b所示,隨著上樣液中乙腈濃度的增加,信號強度先增加后減少。當乙腈達到90%時,6條肽的信號均比其他3組的結果好,說明此時富集效果最好。這一結果可以說明,乙腈低于90%時,糖肽不能很好地與O-T-D-COF材料結合,而乙腈高于90%時,糖肽在上樣液中的溶解性較差,從而降低了富集效果。因此得出結論,上樣液中最佳的乙腈體積分數為90%。
為了更好地淋洗與分離材料上的非糖肽物質和其他雜質,進一步優化了淋洗液。考察不同酸度的淋洗液對富集效果的影響,分別配制了TFA體積分數為0.1%、1%、3%和5%的淋洗液,淋洗液中ACN的體積分數固定為90%。從圖4c可以看出,淋洗液中TFA的體積分數為0.1%時,糖肽的信號最好,隨著淋洗液酸度的增加,糖肽信號強度逐漸降低。這一結果說明,淋洗液的酸度變高可能會造成糖肽的流失,不利于材料對糖肽的富集。
最后,為了考察洗脫液中酸濃度對富集效果的影響,分別配制了4種洗脫液條件,其中TFA的體積分數分別為7%、5%、3%、1%。從圖4d可以看出,只有第4組的6條信號峰信號較強,此時洗脫液中酸的體系分數為1%。因此得出結論,洗脫液中TFA的最佳體積分數為1%。
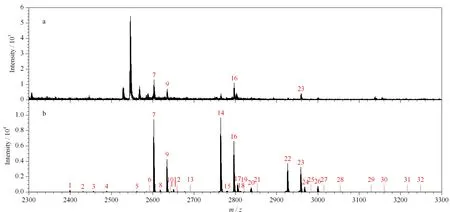
圖 5 富集(a)前和(b)最優條件下富集的糖肽質譜圖Fig. 5 Mass spectra of the tryptic digest of IgG (a) before and (b) after enrichment under optimum conditions m/z of glycopeptide peak No. 1: 2398.5; 2: 2430.4; 3: 2455.5; 4: 2487.5; 5: 2560.5; 6: 2592.5; 7: 2601.2; 8: 2617.5; 9: 2633.2; 10: 2642.4; 11: 2649.5; 12: 2659.0; 13: 2691.0; 14: 2764.1; 15: 2779.6; 16: 2795.5; 17: 2804.5; 18: 2811.5; 19: 2821.3; 20: 2836.5; 21: 2853.3; 22: 2925.6; 23: 2957.5; 24: 2966.6; 25: 2983.2; 26: 2998.5; 27: 3015.1; 28: 3054.5; 29: 3129.2; 30: 3160.5; 31: 3216.6; 32: 3248.6.
以上的優化實驗表明,O-T-D-COF材料對糖肽的保留是結合親水作用和靜電作用的結果。O-T-D-COF對糖肽有較強的親水作用,對糖肽有很強的保留。通過親水模式的洗脫富集,以及淋洗操作條件優化,可以很好地去除非糖肽。圖5是未經過材料富集的糖肽酶解液的質譜圖和經材料在最優條件下富集的IgG糖肽樣品的質譜圖的對比。圖5a中,由于糖肽酶解液中存在高豐度的非糖肽及雜質信號,這些物質在質譜檢測中會嚴重干擾和抑制糖肽的信號,使得質譜儀不容易檢測到糖肽的信號,未經材料富集的糖肽的信號峰只有4條,豐度低且選擇性差。而圖5b中,一共可以鑒定到32條糖肽的信號峰,并且幾乎沒有非糖肽信號的干擾,很好地提高了糖肽富集選擇性與檢測豐度。
2.4 O-T-D-COF材料的富集選擇性驗證
為考察O-T-D-COF材料在復雜體系中對富集糖肽的選擇性,將IgG和BSA的酶解液混合,以此為研究對象,考察O-T-D-COF材料在復雜體系中的糖肽富集情況。圖6a為IgG和BSA酶解液物質的量之比為1∶10的糖肽富集結果,可以鑒定到30條糖肽的信號峰,并且信號豐度佳。圖6b為IgG和BSA酶解液物質的量之比為1∶50的糖肽富集結果,可以鑒定到24條糖肽信號峰,依然保持了較好的富集豐度及富集選擇性。以上結果都展示出O-T-D-COF材料在糖肽富集領域較好的應用潛力。
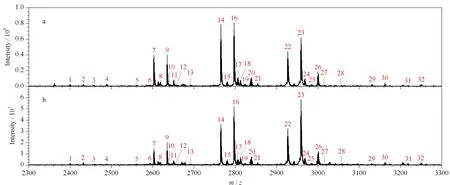
圖 6 復雜體系的糖肽富集質譜圖Fig. 6 Mass spectra of the complex system for glycopeptides enrichment Mixture of tryptic digests of human serum immunoglobulin G (IgG) and bovine serum albumin (BSA) at amount of material ratios of (a) 1∶10 and (b) 1∶50. Peak Nos.: see Fig. 5.
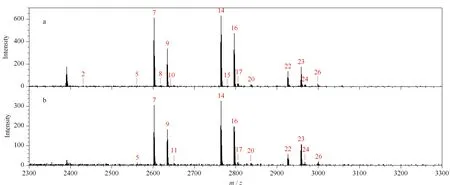
圖 7 (a)5 fmol/μL和(b)2.5 fmol/μL的IgG酶解液的富集質譜圖Fig. 7 Mass spectra of the tryptic digests of (a) 5 fmol/μL and (b) 2.5 fmol/μL IgGPeak Nos.: see Fig. 5.
2.5 O-T-D-COF材料的富集檢測限
在糖肽富集實驗中的檢測限是指在滿足實驗要求的情況下,待測糖肽樣品的最小濃度。O-T-D-COF材料檢測限的大小代表了材料在低豐度糖肽樣品中,對糖肽的特異性吸附能力大小。因此,在富集檢測限的研究中,分別配制了5 fmol/μL和2.5 fmol/μL的低濃度IgG酶解液溶液進行富集操作。圖7a為5 fmol/μL樣品的富集結果,可以鑒定到16條糖肽的信號峰,其中6條高豐度糖肽的信號較強。圖7b圖為2.5 fmol/μL樣品的富集結果,仍能鑒定到12條糖肽信號峰,且6條高豐度糖肽的信號較強。從這一結果可以得出,當樣品的濃度低至2.5 fmol/μL時,依然可以進行糖肽信號的有效鑒定,說明O-T-D-COF材料在低濃度的糖肽樣品中仍然對糖肽有較好的特異性識別能力。
2.6 O-T-D-COF材料的富集容量
O-T-D-COF材料的富集容量是一項重要的考察指標,實驗中固定糖肽樣品的質量為6 μg,以不同質量(10、20、30、40、50、100、150和200 μg)的材料進行富集。圖8為不同材料用量的實驗結果,縱坐標為質譜信號的強弱。從圖8中可以看出,隨著材料量的增加,質譜信號逐漸增加;當材料質量增至50 μg時6條信號峰的強度最強;此后,信號強度趨于平緩。因此,得出O-T-D-COF材料對糖肽的富集容量為120 mg/g。
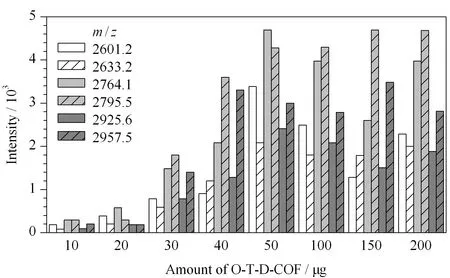
圖 8 不同質量O-T-D-COF材料富集6 μg IgG酶解液的結果Fig. 8 Results of enrichment of 6 μg IgG tryptic digest with different amount of O-T-D-COF materials m/z 2601.2, 2633.2, 2764.1, 2795.5, 2925.6, and 2957.5: glycopeptides.
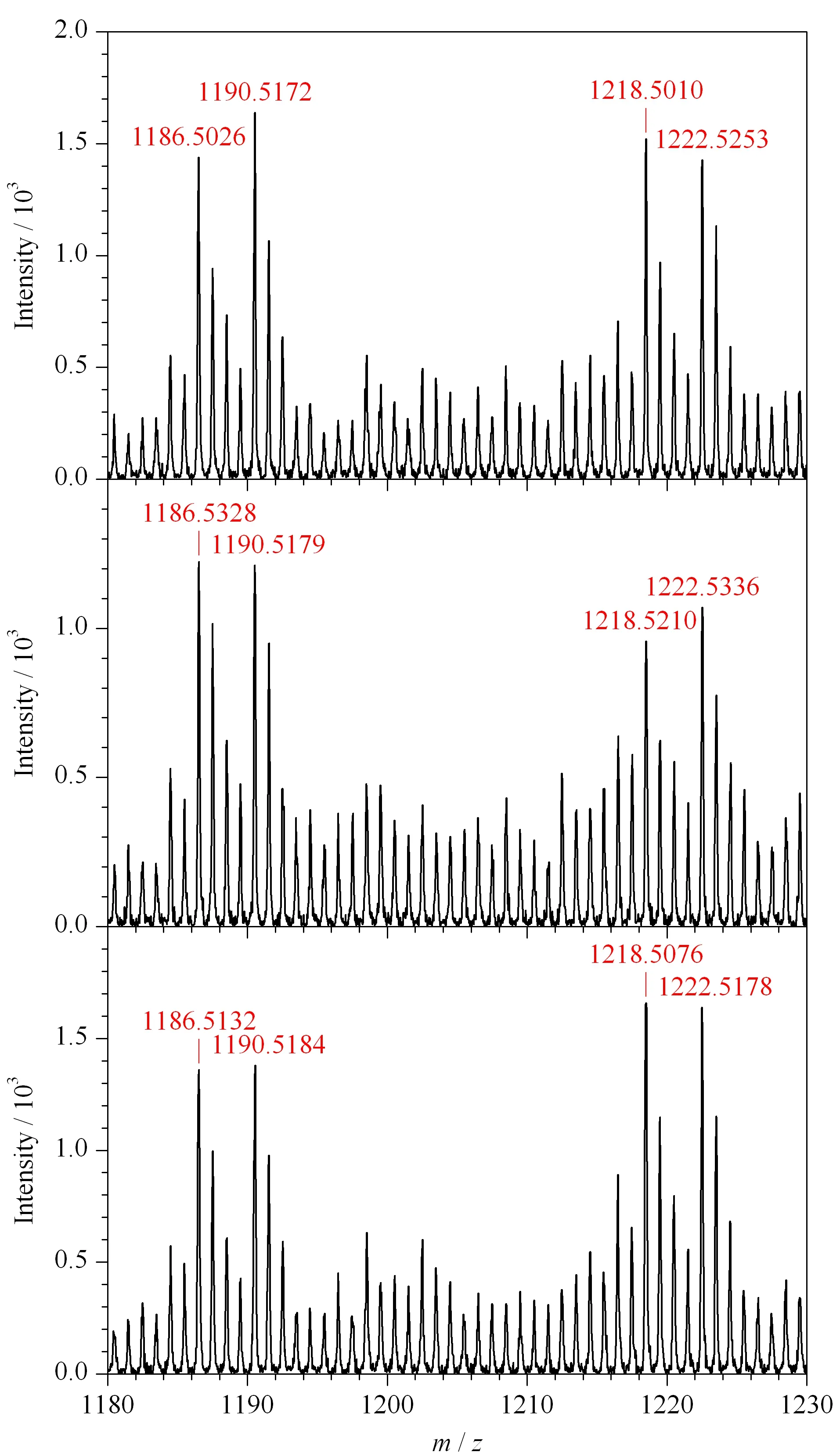
圖 9 從IgG酶解液回收輕/重二甲基標記的去糖基化肽的3組平行試驗Fig. 9 Three paralleled experiments of the recovery of the light- and heavy-dimethyl labeled deglycosylated peptides from human IgG tryptic digest
2.7 O-T-D-COF材料的富集回收率
通過穩定同位素二甲基標記的方法進行了O-T-D-COF材料富集回收率的考察。該實驗需要通過兩步進行,第一次富集的樣品是3 μg氘代二甲基標記的IgG酶解液,將第一次實驗所得洗脫液凍干,與3 μg二甲基標記的IgG酶解液混合得到第二次待富集樣品。經第二次富集所得的洗脫液經過凍干,脫糖基后用于MALDI分析,本實驗平行做3組進行對比。IgG的兩條糖肽序列分別為EEQYN#STYR和EEQFN#STFR(N#為修飾位點)。經過脫糖基后的兩條糖肽的m/z分別是1 158.5和1 190.5,由二甲基標記過的兩條糖肽的m/z分別是1 186.6和1 218.5(標記為輕樣);用氘代二甲基標記后兩條脫糖基肽段的m/z分別增加至1 190.6和1 222.5(標記為重樣)。如圖9所示,輕樣和重樣的信號峰同時出現在譜圖中,同一條糖肽的輕樣和重樣信號峰的信號強度之比即為O-T-D-COF材料的回收率。
將3組平行實驗的結果統計到表1中,再計算其平均值分別為103.5%和101.5%,該值即為O-T-D-COF材料的回收率。

表 1 人IgG酶解液經O-T-D-COF材料富集后兩個去糖基化肽的回收率(n=3)
2.8 O-T-D-COF材料在實際樣品中的應用
從前期的結果可知,該材料擁有良好的富集性能,因此被進一步應用于人血清樣品的糖肽富集。人血清樣品是目前糖肽富集中研究最多的生物樣品,包含了豐富的生理和病理狀況信息。但血清中,糖蛋白的分析因其豐度低具有較大的難度,需要用有效的樣品富集前處理操作,才能將其檢測到。我們利用高分辨液相色譜-質譜聯用儀對O-T-D-COF材料富集結果進行了檢測與分析,得到了血清中來自53個N-糖蛋白中的86個N-糖肽序列,并鑒定到了94個N-糖基化位點(見附表1,詳見http://www.chrom-China.com/)。
3 結論
本文利用溶劑熱合成法制備了一種2D層狀、具有孔洞結構的O-T-D-COF材料,結合SEM和TEM對其進行了表征。將制備的材料進行了氧化后處理以提高材料對糖肽富集的效率,且成功應用于糖肽的選擇性富集。建立了一個較為完整的體系,探討了富集過程中上樣液條件、淋洗液條件、洗脫液條件等對富集結果的影響,對富集條件進行了優化。并在復雜樣品體系進行了富集選擇性的驗證,表明O-T-D-COF材料在IgG和BSA酶解液的物質的量之比為1∶50時,具有良好的糖肽富集選擇性。同時。具有較低的檢測限(2.5 fmol/μL)、較高的富集容量(120 mg/g),及較好的富集回收率(103.5%、101.5%)。最后,我們將O-T-D-COF應用于實際樣品中的糖肽富集,得到了血清中來自53個N-糖蛋白中的86個N-糖肽序列,并鑒定到了94個N-糖基化位點。這些都展現了O-T-D-COF材料在糖肽富集領域的應用潛力。